مقدمهای بر رنگ آمیزی منفی
هدف اصلی از رنگ آمیزی منفی، بررسی شکل مورفولوژیکی (Morphological)، اندازه و آرایش سلولهای باکتریایی که رنگ آمیزی آنها دشوار است (به عنوان مثال: اسپیرلا (Spirilla))، میباشد. همچنین میتوان از آن برای رنگ آمیزی سلولهایی که بیش از حد نسبت به تثبیت حرارتی حساس هستند، استفاده کرد.
رنگ آمیزی منفی در تهیه نمونههای بیولوژیکی برای میکروسکوپ الکترونی استفاده میشود. همچنین برای مشاهده ویروسها، باکتریها، تاژکهای باکتریایی، ساختارهای غشایی بیولوژیکی و پروتئینها یا تودههای پروتئینی که همگی قدرت پراکندگی الکترون (Electron-scattering) پایینی دارند، استفاده میشود.
همچنین برای مطالعه و شناسایی تودههای لیپیدی (Lipid) آبدار مانند لیپوزومهای (Liposome) لایهای (le)، میسلهای (Micelle) کروی معکوس (M) و فازهای استوانهای HII شش ضلعی معکوس (H) توسط میکروسکوپ الکترونی عبوری از رنگ آمیزی منفی استفاده میشود.
اصول رنگ آمیزی منفی
رنگ آمیزی منفی به یک رنگ اسیدی مانند مرکب هند (India Ink) یا نیگروسین (Nigrosin) نیاز دارد.
مرکب هند یا نیگروسین یک رنگ اسیدی است. این بدان معنی است که رنگ به راحتی یک یون هیدروژن (پروتون) را از دست میدهد و کروموفور (Chromophore) رنگ دارای بار منفی میشود. از آنجایی که سطح اکثر سلولهای باکتریایی دارای بار منفی است، سطح سلول رنگ را دفع میکند. شیشه لام (Slide) رنگ آمیزی میشود، اما سلولهای باکتریایی رنگ نمیگیرند. باکتریها به صورت نقاط شفاف در یک پس زمینه تاریک ظاهر میشوند.
شناساگرهای رنگ آمیزی منفی
- مرکب هند
- نیگروسین
- نیگروسین 100 گرم در لیتر، فرمالین (Formalin) 5 میلیلیتر در یک لیتر آب.
روش رنگ آمیزی منفی
- یک قطره بسیار کوچک (بیشتر از یک لوپ آزمایشگاهی پر و کمتر از یک قطره که از قطره چکان خارج میشود) از نیگروسین را در نزدیکی یک انتهای یک لام که به خوبی تمیز و حرارت داده شده، قرار دهید.
- مقدار کمی از کشت را با یک لوپ تلقیح از محیط کشت شیبدار برداشته و بدون اینکه قطره رنگ را پخش کنید، آن را در قطره توزیع کنید.
- از یک لام تمیز دیگر برای پخش قطره رنگ حاوی ارگانیسم با استفاده از تکنیک زیر استفاده کنید.
- یک سر لام تمیزی را روی مرکز لامی که رنگ روی آن وجود دارد، قرار دهید. اسلاید تمیز را به سمت قطره کج کنید و یک زاویه حاد تشکیل دهد و آن لام را به سمت قطره بکشید تا قطره را لمس کند و باعث شود که قطره در امتداد لبه لام پخش کننده، پخش شود. با حفظ یک زاویه حاده کوچک بین اسلایدها، لام پخش کننده را به سمت انتهای تمیز لامی که رنگ دار شده بود، فشار دهید و قطره را به پشت لام پخش کننده بکشید و اسمیری (Smear) پهن و یکنواخت و نازک ایجاد کنید.
- اجازه دهید اسمیر بدون حرارت دادن، خشک شود.
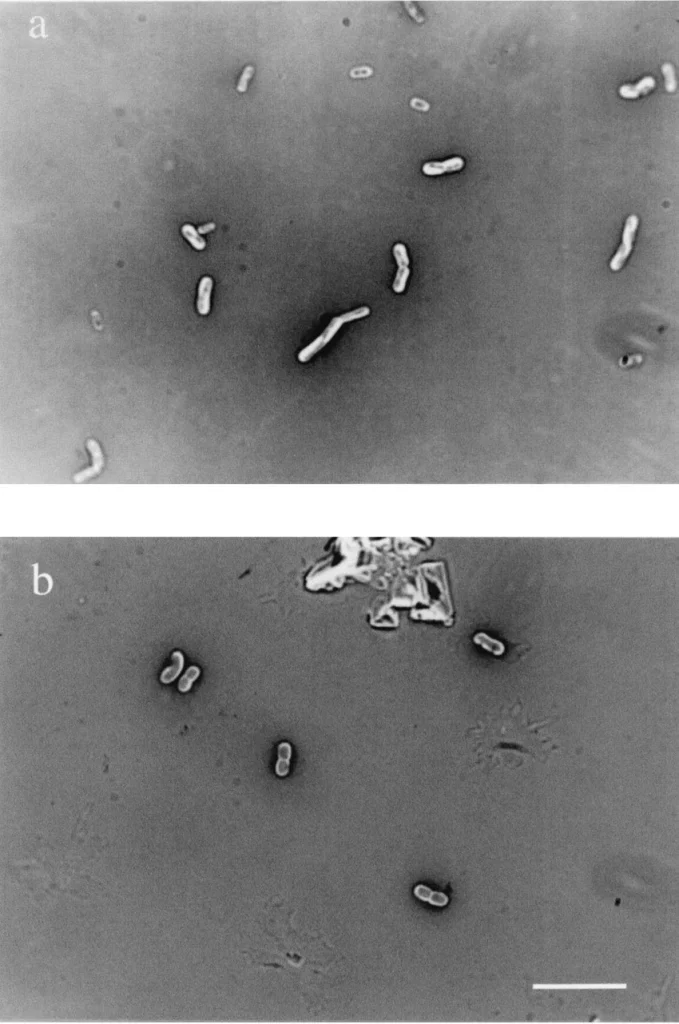
- ناحیه نازک را زیر میکروسکوپ با روغن ایمرسیون (Oil immersion) قرار دهید و سلولهای رنگ نشده را که توسط رنگ خاکستری احاطه شدهاند، مشاهده کنید.
روش مشاهده در میکروسکوپ الکترونی عبوری (TEM)
- یک طرف فیلم توری روکششده را به سمت بالا با یک جفت کلمپ فورسپس (Clamp forceps) خودگیر نگه دارید.
- مخلوطی با نسبت 1 به 1 از نمونه و رنگ منفی (مثلاً اورانیل استات 2 درصد (Uranyl acetate) یا سدیم یا پتاسیم فسفاتنگستات 2 درصد (Sodium or potassium phosphotungstate)، و pH برابر 7.4) بسازید. 5 میکرولیتر به توری اضافه کنید. ذرات کوچکتر سریعتر از ذرات بزرگتر به سطح توری جذب میشوند.

به صورت جایگزین نمونه مخلوط شده با فیکساتور را میتوان قبل از رنگ آمیزی منفی بعدی به توری اضافه کرد.
- به مدت 30 تا 90 ثانیه آن را انکوبه کنید سپس مایع اضافی را با لبه پاره شده یک تکه کاغذ صافی خارج کنید.
- آن را در هوا خشک کنید و سپس در TEM بررسی کنید.
نتایج رنگ آمیزی منفی

همچنین بخوانید:
- رنگ آمیزی سودان بلک (Sudan Black B Staining): اصول، روش، نتایج و موارد استفاده
- رنگ آمیزی اورامین-رودامین (Auramine- Rhodamine Staining): تعریف، روش کار، کاربردها و تفسیر نتایج
- رنگ آمیزی آیرون هماتوکسیلین (Iron-Hematoxylin Staining): اصول، روش، کاربرد و نتایج
- رنگ آمیزی تریکروم ویتلی (Wheatley Trichrome Staining): تعریف، اصول، روش و تفسیر نتایج
مترجم: صادق حسینیکیا