اطلاعات عمومی,ویکی ژن
قانون بیر-لامبرت: تعریف، اشتقاق و محدودیت ها
قانون بیر-لامبرت که به نامهای قانون بیر، قانون لمبرت-بیر یا قانون بیر-لامبرت-بوگر نیز شناخته میشود، تضعیف نور را به خواص مادهای که نور از آن عبور میکند، مرتبط میکند.
قانون بیر-لامبرت چیست؟
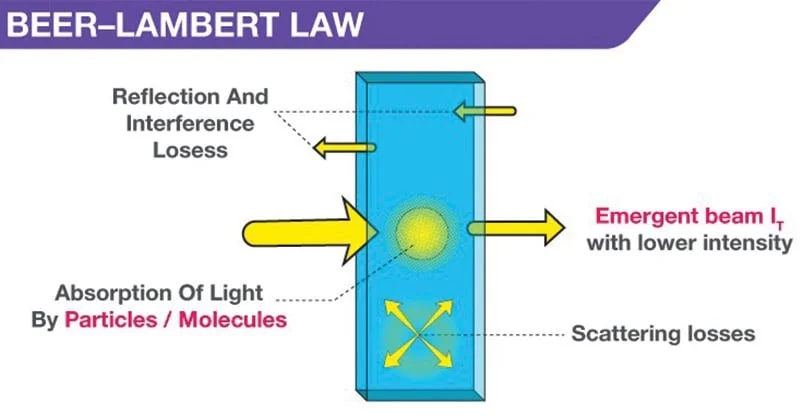
- هنگامی که یک نور تک رنگ با شدت اولیه Io از محلولی در ظرف شفاف عبور میکند، مقداری از نور جذب میشود به طوری که شدت نور عبوری I کمتر از Io است.
- شدت نور ناشی از پراکندگی توسط ذرات در محلول و انعکاس در سطح مشترک، اما عمدتاً از جذب توسط محلول، کاهش مییابد.
- رابطه بین I و Io به طول مسیر محیط جاذب، l، و غلظت محلول جاذب، c بستگی دارد. این عوامل در قوانین لمبرت و بیر مرتبط هستند.
اشتقاق قانون بیر-لامبرت
- اگر اجسام مادی در معرض تابش قرار گیرند، بخشی از تابش فرودی جذب میشود، بخشی پراکنده میشود و بخشی منتقل میشود.
- در نتیجه جذب، شدت نور عبوری از اجسام مادی، یعنی شدت نور عبوری کاهش مییابد.
- کسر نور فرودی جذب شده به ضخامت محیط جذب کننده بستگی دارد
- با استفاده از لمبرت، رابطه کمی بین کاهش شدت نور تک رنگ به دلیل عبور از یک محیط همگن با ضخامت dx و شدت نور I بدست آورد. این قانون به عنوان قانون لمبرتس شناخته میشود و ممکن است به این صورت بیان شود
- کاهش شدت نور با ضخامت محیط جذب کننده در هر نقطه با شدت نور نسبت مستقیم دارد.

از نظر ریاضی می توان آن را به این صورت بیان کرد
– 𝑑𝐼 / 𝑑𝑥 ∝ 𝐼 — — — — — — (1)
که در آن dI کاهش اندکی در شدت نور هنگام عبور از یک فاصله کوچک dx و I شدت نور تک رنگ درست قبل از ورود به محیط است.
معادله (1) ممکن است به این صورت نوشته شود
– 𝑑𝐼 / 𝑑𝑥 = 𝑎𝐼 — — — — — — (2)
که در آن – 𝑑𝐼/ 𝑑𝑥 میزان کاهش شدت با ضخامت dx است، a را ضریب جذب میگویند.
ادغام معادله (2) پس از نتظیم دوباره، میدهد:
– ln I = ax+C — — — — — — (3)
که در آن C ثابت یکپارچگی است. در x=0، I=Io. بنابراین، C = – ln Io. با معرفی این در معادله (3) دریافت میکنیم،
ln I/ Io = – ax — — — — — — (4)
معادله (4) را میتوان به صورت زیر نیز نوشت:
I = Io 𝑒−𝑎𝑥 — — — — — — (5)
معادله (5) را میتوان به این صورت هم نوشت:
log I/ Io = − a/ 2.303 x — — — — — (6)
یا, log I/ Io = -a x — — — — — (7)
که در آن a (= a /2.303) ضریب خاموشی و -ln I/Io را جذب محیط مینامند. جذب با A نشان داده شده است.
وقتی نور از محلولی با ضخامت معین عبور میکند، کسری از نور فرودی جذب شده نه تنها به شدت نور I بلکه به غلظت c محلول نیز بستگی دارد.
این عمل به عنوان قانون بیر شناخته میشود.
– 𝑑𝐼 /𝑑𝑥 ∝ 𝑐 — — — — — — (8)
این دو قانون ممکن است برای نوشتن ترکیب شوند.
– 𝑑𝐼 /𝑑𝑥 ∝ 𝐼 × 𝑐
یا , – (𝑑𝐼 /𝑑𝑥 = 𝑏 × 𝐼 × 𝑐 — — — — — (9
وقتی غلظت c بر حسب mol/l بیان شود، b را ضریب جذب مولی مینامند.
همانطور که در مورد قانون لمبرت، معادله (9) ممکن است که
log I/ Io = − 𝑏 /2.303 × 𝑐 × 𝑥 — — — — — (10)
log I/ Io = – ∈× 𝑐 × 𝑥 — — — — — (11)
که در آن ∈ (= 𝑏 / 2.303) ضریب خاموشی مولی نامیده میشود که بر حسب L/mol/cm بیان میشود.
ضریب خاموشی مولی ∈ به ماهیت املاح جذب کننده و همچنین به طول موج نور فرودی مورد استفاده بستگی دارد. عبارت (معادله 11) معمولاً به عنوان قانون بیر-لامبرت شناخته میشود.
محدودیت های قانون بیر-لامبرت
خطی بودن قانون بیر-لامبرت توسط عوامل شیمیایی و ابزاری محدود شده است.
علل غیر خطی بودن قانون در شرایط زیر رخ میدهد:
- انحراف در ضرایب جذب در غلظتهای بالا (> 0.01) به دلیل برهمکنشهای الکترواستاتیکی بین مولکولها در مجاورت نزدیک
- پراکندگی نور به دلیل ذرات موجود در نمونه
- فلورسانس یا فسفرسانس نمونه
- تغییر در ضریب شکست در غلظت آنالیت بالا
- تغییر در تعادلهای شیمیایی به عنوان تابعی از غلظت
- تابش غیر تک رنگ، انحرافات را میتوان با استفاده از قسمت نسبتاً مسطح از طیف جذب مانند حداکثر باند جذب به حداقل رساند.
- نور سرگردان
محدودیتهای دیگر عبارتند از:
- تابش الکترومغناطیسی باید تک رنگ باشد.
- پرتو نور نباید پراکنده شود.
- محلول باید رقیق شود.
همچنین بخوانید:
مترجم: حنانه بریمانی