دوره مهارت آموزی طراحی واکسن: ایمونوانفورماتیک
آزمایشگاه ژنیران دوره کارآموزی طراحی واکسن: ایمونوانفورماتیک (کارگاه طراحی واکسن: ایمونوانفورماتیک) را برگزار میکند.
۴۰ ساعت آموزش ، ۲۰ جلسه (یک جلسه آخر امتحان)
کلاس های این دوره به صورت نیمه خصوصی و حداکثر ۶ نفره برگزار میگردد.
با اعطای مدرک از آزمایشگاه ژنیران-انجمن زیستشناسی ایران و ITE لندن (در صورت درخواست)
شروع دوره بصورت حضوری-آنلاین:
- ۲۴ بهمن
- هزینه دوره: ۷ میلیون و ۵۰۰ هزار تومان
برای ثبت نام کافیست فقط ۲۵ درصد هزینه کل را بپردازید. ۷۵ درصد باقی مانده را می توانید در اقساط ۳ ماهه با چک صیادی پرداخت کنید. اطلاعات بیشتر
سرفصل های دوره کارآموزی طراحی واکسن: ایمونوانفورماتیک
- مبانی سیستم ایمنی و علم ایمونولوژی
- علم ایمونولوژی محاسباتی
- کاربرد های ایمونوانفورماتیک
- بخش های کلیدی سرورها و نحوه انتخاب تارگت مناسب برای طراحی واکسن
- بررسی case study های متعدد جهت تعمیق یادگیری و درک کاربردهای ابزارهای یادگرفته شده در طول دوره
- نحوه سنجش اعتبار و افزایش راندمان واکسن
- یادگیری پروتوکل های طراحی واکسن های MULTIEPITOPE-DNA Based- RNA Based
- یادگیری داکینگ و دینامیک مولکولی در طراحی واکسن با استفاده از سرورها و نرم افزارهای GROMACS-AUTO DOCK VINA-MOLEGRO – PYRX
- تکنیک های مدلسازی پروتئین با سرورها و نرم افزارهای مرتبط با همولوژی مدلینگ مثل :pymol و SWISS MODEL- ROBBETA-I TASSER-ALPHA FOLD
- یادگیری تکنیک کلونینگ و طراحی وکتور با نرم افزار SNAPGENE
The course entitled “Immunoinformatics and Vaccine Design” at Geniran laboratory covers following topics
- Fundamentals of the Immune System and Immunology
- Computational Immunology
- Applications of Immunoinformatics
- Key Components of Servers and How to Select Appropriate Targets for Vaccine Design
- Review of Multiple Case Studies to Deepen Understanding and Application of Tools Learned During the Course
- Methods for Validating and Enhancing Vaccine Efficiency
- Learning Protocols for Designing Multi-Epitope, DNA-Based, and RNA-Based Vaccines
- Learning Molecular Docking and Dynamics in Vaccine Design Using Servers and Software: GROMACS, AutoDock Vina, Molegro, and Pyrx
- Protein Modeling Techniques Using Servers and Software Related to Homology Modeling: PyMOL, SWISS-MODEL, Robetta, I-TASSER, and AlphaFold
- Learning Cloning Techniques and Vector Design Using SnapGene Software

واکسن از جمله دستاوردهای شگرف دانش پزشکی بشر است که آثار ارزشمندی بر بهداشت انسان و حیوانات از گذشته ها تا به امروز به جای گذاشته است و سبب کاهش مرگ و میر به واسطه ی بیماری های عفونی شده است.
چالش های پزشکی و دامپزشکی در دنیای امروزی سبب نگرش های تازه ای به علوم پایه ی بالینی گردیده است و همگام با آن راهکارهای سنجیده تری جهت مبارزه و شناخت بیماری هایی عفونی و غیر عفونی خطرناک طراحی دارو و مواد بیولوژیک و واکسن ها و کیت ها و طراحی ادجوانت توسعه یافته است.
کارآموزی طراحی واکسن
ایمونوانفورماتیک یکی از علوم رو به رشد و مترقی می باشد که به نوعی با حال و آینده پزشکی و دامپزشکی گره خورده است.
بیوانفورماتیک طبقه بندی داده های بیولوژیک و طراحی پیشرفته و آنالیز کمی و کیفی بر مبنای اطلاعات مرتبط با ماکرومولکول های زیستی نظیر DNA- RNA – PROTEIN با رهیافت های محاسباتی است و در گام پیشرفته تر به علومی نظیر ایمونوانفورماتیک و کموانفورماتیک ختم شود. Immunity از کلمه لاتین immunitase گرفته شده است.
یکی از نوپاترین دانش ها در ایمونولوژی که به نوعی با آینده این علم گره خورده ایمونوانفورماتیک است که به موازات تکمیل پروژه ژنوم انسان و جانداران پیشرفت های شگرفی را تجربه کرده است. دوره ی پیشرو دربرگرفته از تازه های فن آوری طراحی واکسن و علم بیوانفورماتیک است.
ایمونوانفورماتیک یا ایمونولوژی محاسباتی اخیراً بهعنوان زمینهای مهم و نوین، نقش چشمگیری در علوم آنالیز، مدلسازی و پیشگویی عملکرد سیستم ایمنی، طراحی واکسنهای جدید، تحقیقات آلرژیزایی و اکتشافات دارویی داشته است.
این علم نه تنها سبب تسریع تحقیقات علمی شده بلکه به علت تعامل آن با پروژه ژنوم انسان و سایر ارگانیسمها منجر به دستیابی به اطلاعات بسیار زیادی در ارتباط با ایمنیشناسی گردیده است.
درواقع ایمونوانفورماتیک همانند پلی میان آزمایشها تجربی و روشهای محاسباتی است.
ازاینرو سبب کاهش زمان و هزینهها در فرآیند تحقیقات علمی میشود. موفقیتهای گسترده این شاخه از علم به سبب ارتباط مستقیم آن با سلامت جهانی، واجد اهمیت استراتژیک در جهت پیشگیری و مبارزه با بیماریها دارد.
حوزههای تحقیقاتی ایمونوژنومیکس، ایمونوپرتئومیکس، پیشگویی اپی توپ ها و واکسیناسیون in silico ، شناسایی ژنهای بیماریزا، پروتئینهایی مستقر در سطوح، آلرژیها، ساخت پایگاه داده ایمنیشناسی و مدلسازی پاسخ سیستم ایمنی و شبیهسازی آزمایشها، قلمروهای متفاوت علم ایمونوانفورماتیک میباشند.
اخیراً نیز از علم سیستم بیولوژی بهمنظور بررسی خصوصیات رفتار پویای شبکه سیستم ایمنی مورداستفاده قرار میگیرد.
سیستم ایمنی انسان شامل انواع متنوعی از سلول ها و مولکول ها می باشد که در ارتباط تنگاتنگ با سایر سیستم های بدن می باشند. مقادیر افزاینده ی داده های تولید شده در دوره ی پساژنومیک بررسی این سیستم را پیچیده تر گردانده است.
بنابراین نیاز به استفاده از رویکردهای محاسباتی و کامپیوتری جهت پردازش و تفسیر داده ها محسوس تر می باشد. ایمونوانفورماتیک به عنوان زیرمجموعه ای از بیوانفورماتیک رویکردی جدید با ابزارها و پایگاه های اطلاعاتی مختلف می باشد که بررسی داده های ایمونولوژیک حاصل از تحقیقات آزمایشگاهی را تسهیل می گرداند.
ایمونوانفورماتیک می تواند محققین را در طراحی فرضیات جدید یاری نموده و دید لازم برای انتخاب آزمایشات را فراهم آورد. با در نظر داشتن این ویژگی ها می توان ایمونوانفورماتیک را حوزه ی جدیدی دانست که پیشرفت تحقیقات ایمنی شناسی را میسر می گرداند.
واکسنها بیخطر و مؤثر هستند. بهعلت اینکه میلیونها نفر از افراد سالم ازجمله کودکان برای پیشگیری از بیماریهای جدی این واکسنها را دریافت میکنند، آنها باید از استانداردهای ایمنی بسیار بالایی برخوردار باشند.
قبل از توصیهی یک واکسن، این واکسن در آزمایشگاههای مختلفی مورد آزمایش قرار میگیرد. این فرایند ممکن است سالها طول بکشد.
سازمان غذا و دارو از اطلاعات حاصل از این آزمایشها برای تصمیمگیری درمورد اینکه آیا واکسنها روی انسان آزمایش شود یا نه، استفاده میکند.
در جریان یک آزمایش بالینی، واکسن روی افرادی که داوطلب دریافت واکسن شدهاند، مورد آزمایش قرار میگیرد. آزمایشهای بالینی با ۲۰ تا ۱۰۰ شرکتکننده آغاز میشوند ولی درنهایت شامل هزاران فرد داوطلب خواهند شد.
مقدمه ای بر ایمونولوژی و آسیب شناسی ایمنی
به طور اساسی، سیستم ایمنی دارای دو خط دفاعی است: ایمنی ذاتی و ایمنی تطبیقی. ایمنی ذاتی اولین مکانیسم ایمونولوژیک و غیر اختصاصی مستقل از آنتی ژن برای مبارزه با یک پاتوژن مزاحم است. این یک پاسخ ایمنی سریع است که در عرض چند دقیقه یا چند ساعت پس از پرخاشگری رخ می دهد و هیچ حافظه ایمونولوژیک ندارد.
از سوی دیگر، ایمنی تطبیقی وابسته به آنتی ژن و آنتی ژن خاص است. دارای ظرفیت حافظه است که میزبان را قادر می سازد تا پس از مواجهه بعدی با آنتی ژن، پاسخ ایمنی سریعتر و کارآمدتری را ایجاد کند. هم افزایی زیادی بین سیستم ایمنی سازگار و همتای ذاتی آن وجود دارد و نقص در هر یک از این سیستم ها می تواند باعث ایجاد بیماری مانند بیماری های خود ایمنی، اختلالات نقص ایمنی و واکنش های حساسیت مفرط شود. در این مطلب، یک نمای کلی عملی از ایمنی ذاتی و تطبیقی ارائه میکنیم و چگونگی نقش این مکانیسمهای دفاعی میزبان در سلامت و بیماری را توضیح میدهیم.
معرفی
در طول دهه گذشته، پیشرفتهای زیادی در درک فعلی ما از سیستم ایمنی و نحوه عملکرد آن برای محافظت از بدن در برابر عفونت صورت گرفته است. با توجه به ماهیت پیچیده این موضوع، در اینجا مقدماتی در مورد اجزای اصلی و عملکرد سیستم ایمنی و نقش آن در سلامت و بیماری ارائه خواهیم داد. موضوعات مطرح شده در این مبحث مقدماتی عبارتند از:
- ایمنی ذاتی و اکتسابی
- ایمن سازی غیرفعال و فعال
- آسیب شناسی ایمنی مانند واکنش های حساسیت مفرط، خودایمنی و نقص ایمنی.
سیستم ایمنی: ایمنی ذاتی و سازگار
سیستم ایمنی به مجموعه ای از سلول ها و پروتئین ها اطلاق می شود که برای محافظت از پوست، مجاری تنفسی، مجرای روده و سایر نواحی در برابر آنتی ژن های خارجی مانند میکروب ها (ارگانیسم ها مانند باکتری ها، قارچ ها و انگل ها)، ویروس ها و سلول های سرطانی عمل می کنند و سموم سیستم ایمنی را می توان به طور ساده دارای دو خط دفاعی در نظر گرفت: ایمنی ذاتی و ایمنی تطبیقی. ایمنی ذاتی نشان دهنده اولین خط دفاعی در برابر یک پاتوژن مزاحم است.
این یک مکانیسم دفاعی مستقل از آنتی ژن (غیر اختصاصی) است که بلافاصله یا ظرف چند ساعت پس از برخورد با آنتی ژن توسط میزبان استفاده می شود. پاسخ ایمنی ذاتی حافظه ایمونولوژیک ندارد و بنابراین، اگر بدن در آینده در معرض آن قرار گیرد، قادر به تشخیص یا به خاطر سپردن همان پاتوژن نیست.
از سوی دیگر، ایمنی تطبیقی وابسته به آنتی ژن و آنتی ژن خاص است و بنابراین، شامل یک زمان تاخیر بین قرار گرفتن در معرض آنتی ژن و حداکثر پاسخ است. ویژگی بارز ایمنی تطبیقی ظرفیت حافظه است که میزبان را قادر میسازد تا پس از مواجهه بعدی با آنتی ژن، پاسخ ایمنی سریعتر و کارآمدتری را ایجاد کند. مصونیت ذاتی و انطباقی مکانیسمهای انحصاری متقابل دفاع میزبان نیستند، بلکه مکمل هم هستند و نقص در هر دو سیستم منجر به آسیبپذیری میزبان میشود.
مصونیت ذاتی (Innate immunity)
عملکرد اولیه ایمنی ذاتی، جذب سلول های ایمنی به محل های عفونت و التهاب از طریق تولید سیتوکین ها است که پروتئین های کوچک درگیر در ارتباط سلولی هستند. تولید سیتوکین منجر به آزاد شدن آنتیبادیها و سایر پروتئینها و گلیکوپروتئینها میشود که سیستم کمپلمان را فعال میکنند، یک آبشار بیوشیمیایی که برای شناسایی و پوشش آنتیژنهای خارجی عمل میکند و آنها را مستعد فاگوسیتوز میکند.
فاگوسیتوز، فرآیندی که طی آن سلولها میکروبها را میبلعند و بقایای سلولی را حذف میکنند. پاسخ ایمنی ذاتی همچنین باعث پاکسازی سلول های مرده یا کمپلکس های آنتی بادی و حذف مواد خارجی موجود در اندام ها، بافت ها، خون و لنف می شود. همچنین می تواند پاسخ ایمنی تطبیقی را از طریق فرآیندی به نام ارائه آنتی ژن فعال کند.
سلول های متعددی در پاسخ ایمنی ذاتی مانند فاگوسیت ها (ماکروفاژها و نوتروفیل ها)، سلول های دندریتیک، ماست سل ها، بازوفیل ها، ائوزینوفیل ها، سلول های کشنده طبیعی (NK) و لنفوسیت ها (سلول های T) نقش دارند. فاگوسیت ها به دو نوع سلول اصلی تقسیم می شوند: نوتروفیل ها و ماکروفاژها.
هر دوی این سلول ها عملکرد مشابهی دارند که شامل بلعیدن میکروب ها (فاگوسیتوز) می شود. نوتروفیلها علاوه بر خاصیت فاگوسیتیک، حاوی گرانولهایی هستند که در صورت آزاد شدن، به از بین بردن میکروبهای بیماریزا کمک میکنند. برخلاف نوتروفیل ها که سلول های کوتاه مدت هستند، ماکروفاژها سلول هایی با عمر طولانی هستند که نه تنها در فاگوسیتوز نقش دارند، بلکه در ارائه آنتی ژن به سلول های T نیز نقش دارند.
ماکروفاژها با توجه به بافتی که در آن زندگی می کنند نامگذاری می شوند. به عنوان مثال، ماکروفاژهای موجود در کبد، سلول های کوپفر نامیده می شوند در حالی که ماکروفاژهای موجود در بافت همبند هیستوسیت نامیده می شوند.
سلول های دندریتیک نیز فاگوسیتوز می کنند و به عنوان سلول های ارائه دهنده آنتی ژن (APCs) عمل می کنند و به عنوان پیام رسان های مهم بین ایمنی ذاتی و تطبیقی عمل می کنند. ماست سل ها و بازوفیل ها دارای ویژگی های برجسته بسیاری با یکدیگر هستند و هر دو در شروع پاسخ های التهابی حاد، مانند آنچه در آلرژی و آسم دیده می شود، نقش دارند. بر خلاف ماست سل ها که عموما در بافت همبند اطراف رگ های خونی قرار دارند، بازوفیل ها در گردش خون قرار دارند.
ائوزینوفیلها گرانولوسیتهایی هستند که دارای خواص فاگوسیتی هستند و نقش مهمی در تخریب انگلهایی دارند که بزرگتر از آن هستند که فاگوسیتوز شوند. همراه با ماست سل ها و بازوفیل ها، مکانیسم های مرتبط با آلرژی و آسم را نیز کنترل می کنند.
سلولهای NK که همچنین به عنوان لنفوسیتهای دانهدار بزرگ (LGLs) شناخته می شوند، نقش عمدهای در رد تومورها و تخریب سلولهای آلوده به ویروس دارند. تخریب سلولهای آلوده از طریق آزادسازی پرفورینها و گرانزیمها از گرانولهای سلول NK که باعث القای آپوپتوز (مرگ برنامهریزیشده سلولی) میشوند، حاصل میشود.
ایمنی ذاتی را می توان شامل چهار نوع مانع دفاعی دید: آناتومیک (پوست و غشای مخاطی)، فیزیولوژیک (دما، pH پایین و واسطه های شیمیایی)، اندوسیتیک و فاگوسیتیک و التهابی.
مصونیت تطبیقی (Adaptive immunity)
ایمنی تطبیقی زمانی ایجاد می شود که ایمنی ذاتی در از بین بردن عوامل عفونی بی اثر باشد و عفونت ایجاد شود. کارکردهای اولیه پاسخ ایمنی تطبیقی، شناسایی آنتی ژن های غیر خودی خاص در حضور آنتی ژن های خودی است. تولید مسیرهای موثر ایمونولوژیک خاص پاتوژن که پاتوژن های خاص یا سلول های آلوده به پاتوژن را از بین می برد و توسعه یک حافظه ایمونولوژیک که می تواند به سرعت یک پاتوژن خاص را در صورت بروز عفونت های بعدی از بین ببرد. سلول های سیستم ایمنی تطبیقی عبارتند از: سلول های T که از طریق عملکرد سلول های ارائه دهنده آنتی ژن (APCs) فعال می شوند و سلول های B.
سلول های T و APC ها
سلول های T از سلول های بنیادی خونساز در مغز استخوان مشتق می شوند و پس از مهاجرت در تیموس بالغ می شوند. این سلول ها یک گیرنده منحصر به فرد متصل شونده به آنتی ژن را بر روی غشای خود بیان می کنند که به عنوان گیرنده سلول T(TCR) شناخته می شود و همانطور که قبلا ذکر شد، برای تشخیص یک آنتی ژن خاص، به عمل APC ها (معمولا سلول های دندریتیک، ماکروفاژها، سلول های B، فیبروبلاست ها و سلول های اپیتلیال) نیز نیاز دارند.
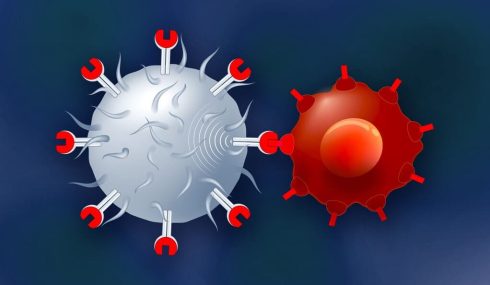
سطوح APC ها پروتئین های سطح سلولی را که به عنوان مجتمع اصلی سازگاری بافتی (MHC) شناخته می شوند، بیان می کنند. MHC ها به دو دسته MHC کلاس I و MHC کلاس II تقسیم می شوند. MHC کلاس I همچنین با عنوان آنتی ژن لکوسیت انسانی (HLA) A، B و C نیز شناخته می شوند که در تمام سلول های هسته دار یافت می شوند.
MHC کلاس II با عنوان HLA، DP، DQ و DR نیز شناخته می شوند که فقط در موارد خاصی یافت می شوند که شامل سلول های سیستم ایمنی، از جمله ماکروفاژها، سلول های دندریتیک و سلول های B می باشند. مولکول های کلاس MHC I پپتیدهای درون زا یا داخل سلولی دارند در حالی که مولکول های کلاس II پپتیدهای بیرونی یا برون سلولی دارند.
سلول های T زمانی فعال می شوند که با APC مواجه می شوند که آنتی ژنی را هضم کرده و قطعات آنتی ژن متصل به مولکول های MHC خود را نشان می دهد. کمپلکس آنتی ژن – MHC، TCR را فعال می کند و سلول T سیتوکین هایی ترشح می کند که بیشتر پاسخ ایمنی را کنترل می کند. این فرآیند ارائه آنتی ژن سلول های T را تحریک می کند تا به سلول های سیتوتوکسیک T (سلول های CD8+) یا سلول های T-helper (سلول های CD4+) تمایز پیدا کنند.
سلول های T سیتوتوکسیک در درجه اول در تخریب سلول های آلوده به عوامل خارجی نقش دارند. آنها با تعامل TCR خود با مولکول های MHC متصل به پپتید فعال می شوند. گسترش کلونال سلولهای T سیتوتوکسیک سلولهای مؤثری را تولید میکند که پرفورین و گرانزیم (پروتئینهایی که باعث لیز سلولهای هدف میشوند) و گرانولیزین (مادهای که آپوپتوز سلولهای هدف را القا میکند) آزاد میکنند.
پس از برطرف شدن عفونت، اکثر سلول های موثر می میرند و توسط فاگوسیت ها پاک می شوند. با این حال، تعداد کمی از این سلولها بهعنوان سلولهای حافظه حفظ میشوند که میتوانند به سرعت به سلولهای مؤثر در مواجهه بعدی با همان آنتیژن تمایز پیدا کنند.
سلول های T helper (Th) نقش مهمی در ایجاد و به حداکثر رساندن پاسخ ایمنی دارند. این سلول ها هیچ فعالیت سیتوتوکسیک یا فاگوسیتی ندارند و نمی توانند سلول های آلوده را بکشند یا پاتوژن ها را پاک کنند. با این حال، آنها با هدایت سلول های دیگر برای انجام این وظایف، پاسخ ایمنی را واسطه می کنند. سلول های Th از طریق تشخیص TCR آنتی ژن متصل به مولکول های کلاس MHC II فعال می شوند. سلولهای Th پس از فعال شدن، سیتوکینهایی را آزاد میکنند که بر فعالیت بسیاری از انواع سلول، از جمله APCهایی که آنها را فعال میکنند، تأثیر میگذارند.
دو نوع پاسخ سلول Th را می توان توسط APC القا کرد که شامل Th1 و Th2 می باشند. پاسخ Th1 با تولید اینترفرون گاما (IFN-γ) مشخص میشود که فعالیتهای باکتریکشی ماکروفاژها را فعال میکند و سایر سیتوکینهایی که سلولهای B را وادار به ساختن آنتیبادیهای پوشش دهنده و خنثیکننده میکنند.
پاسخ Th2 با آزادسازی سیتوکین ها (اینترلوکین ۴، ۵ و ۱۳) مشخص می شود که در فعال سازی و یا استخدام سلول های B، ماست سل ها و ائوزینوفیل های تولید کننده آنتی بادی ایمونوگلوبولین E (IgE) نقش دارند. همانطور که قبلا ذکر شد، ماست سل ها و ائوزینوفیل ها در شروع پاسخ های التهابی حاد، مانند آنچه در آلرژی و آسم دیده می شود، نقش مهمی دارند.
آنتی بادی های IgE نیز با واکنش های آلرژیک همراه هستند. بنابراین، عدم تعادل تولید سیتوکین Th2 با ایجاد شرایط آتوپیک (آلرژیک) همراه است. مانند سلولهای T سیتوتوکسیک، اکثر سلولهای Th با رفع عفونت میمیرند و تعداد کمی به عنوان سلولهای حافظه Th باقی میمانند.
نوع سوم سلول T، که به عنوان سلول T تنظیمی (T reg) شناخته می شود، نیز در پاسخ ایمنی نقش دارد. سلول های T reg سیستم ایمنی را محدود و سرکوب می کنند و در نتیجه ممکن است برای کنترل پاسخ های ایمنی ناهنجار به آنتی ژن های خودی و ایجاد بیماری خود ایمنی عمل کنند.
سلول های B
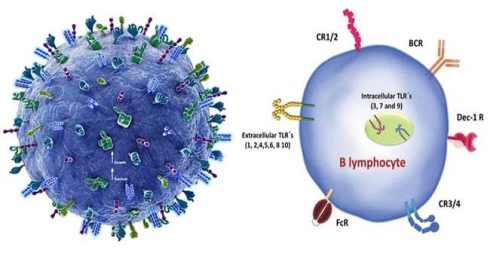
سلولهای B از سلولهای بنیادی خونساز در مغز استخوان به وجود میآیند و پس از بلوغ، مغز استخوان را ترک میکنند و گیرندهای منحصر به فرد متصل شونده به آنتیژن را روی غشای خود بیان میکنند. برخلاف سلولهای T، سلولهای B میتوانند مستقیما آنتی ژن آزاد را بدون نیاز به APC شناسایی کنند. عملکرد اصلی سلول های B تولید آنتی بادی علیه آنتی ژن های خارجی است.
هنگامی که سلول های B توسط آنتی ژن های خارجی فعال می شوند، تکثیر می شوند و به سلول های پلاسمایی ترشح کننده آنتی بادی یا سلول های B حافظه تمایز می یابند.
سلول های B حافظه با عمر طولانی از عفونت گذشته هستند و به بیان گیرنده های اتصال دهنده آنتی ژن ادامه می دهند. این سلول ها می توانند به سرعت پاسخ دهند و پس از قرار گرفتن مجدد در معرض یک آنتی ژن از بین بروند. از طرف دیگر سلول های پلاسما گیرنده های اتصال دهنده آنتی ژن را بیان نمی کنند. اینها سلولهای کوتاه مدتی هستند که با حذف عامل تحریک کننده که پاسخ ایمنی را القا می کند، دچار آپوپتوز می شوند.
سلول های B با توجه به عملکردشان در تولید آنتی بادی، برخلاف پاسخ ایمنی با واسطه سلول که عمدتا توسط سلول های T کنترل می شوند، نقش اصلی را در پاسخ ایمنی هومورال یا با واسطه آنتی بادی ایفا می کنند.
ایمنی با واسطه آنتی بادی در مقابل ایمنی سلولی
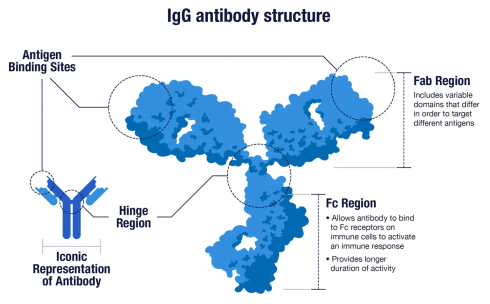
ایمنی با واسطه آنتی بادی شاخه ای از سیستم ایمنی اکتسابی است که با تولید آنتی بادی سلول B ایجاد می شود. مسیر تولید آنتیبادی زمانی آغاز میشود که گیرنده اتصالدهنده آنتیژن سلول B، آنتیژن را در شکل اصلی آن شناسایی کرده و به آن متصل میشود. این به نوبه خود، کمک سلولهای Th را جذب میکند که سیتوکینهایی ترشح میکنند که به تکثیر سلولهای B کمک میکند و به سلولهای پلاسمایی ترشحکننده آنتیبادی بالغ میشوند.
آنتی بادی های ترشح شده به آنتی ژن های روی سطح پاتوژن ها متصل می شوند و آنها را برای تخریب از طریق خنثی سازی پاتوژن و سم، فعال سازی کلاسیک مکمل، ترویج فاگوسیتوز اپسونین و حذف پاتوژن علامت گذاری می کنند. پس از حذف پاتوژن، کمپلکس های آنتی ژن-آنتی بادی توسط آبشار کمپلمان پاک می شوند.
پنج نوع آنتی بادی توسط سلول های B تولید می شود: ایمونوگلوبولین A (IgA)، IgD، IgE، IgG و IgM. هر یک از این آنتی بادی ها عملکردهای بیولوژیکی متفاوتی دارند و پاتوژن های خاص را شناسایی و خنثی می کنند.
آنتی بادی ها نقش مهمی در مهار تکثیر ویروس در مرحله حاد عفونت دارند. با این حال، آنها به طور کلی قادر به از بین بردن ویروس پس از وقوع عفونت نیستند. هنگامی که عفونت ایجاد شد، مکانیسم های ایمنی سلولی در دفاع میزبان مهم ترین هستند. ایمنی سلولی شامل آنتی بادی نمی شود.
فعالسازی سلولهای T سیتوتوکسیک اختصاصی آنتی ژن که باعث القای آپوپتوز سلولهایی میشود که اپیتوپهای نمایشدهنده (منطقه موضعی روی سطح آنتیژنی که قادر به برانگیختن پاسخ ایمنی است) آنتیژن خارجی روی سطح آنها، مانند سلولهای آلوده به ویروس، سلولهای دارای باکتری های داخل سلولی و سلول های سرطانی که آنتی ژن های تومور را نشان می دهند.
فعال شدن ماکروفاژها و سلول های NK که آنها را قادر می سازد پاتوژن های داخل سلولی را از بین ببرند و تحریک تولید سیتوکین که بیشتر واکنش ایمنی را واسطه می کند. ایمنی با واسطه سلولی عمدتا متوجه میکروب هایی است که در فاگوسیت ها زنده می مانند و همچنین میکروب هایی که سلول های غیر فاگوسیتی را آلوده می کنند. این نوع ایمنی در از بین بردن سلولهای آلوده به ویروس مؤثرتر است، اما میتواند در دفاع در برابر قارچها، تک یاختهها، سرطانها و باکتریهای داخل سلولی نیز مشارکت داشته باشد. ایمنی سلولی نیز نقش مهمی در رد پیوند دارد.
ایمن سازی غیرفعال در مقابل ایمن سازی فعال
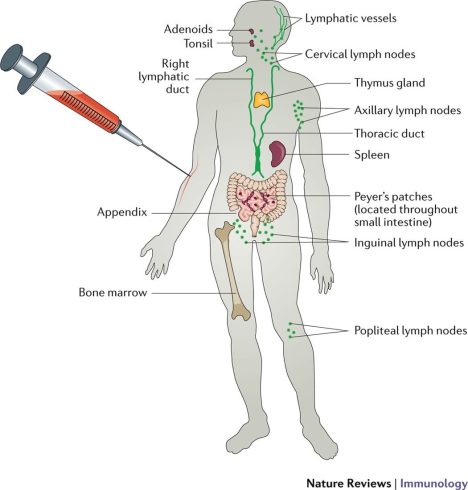
ایمنی اکتسابی از طریق ایمن سازی غیرفعال یا فعال حاصل می شود. ایمن سازی غیرفعال به انتقال ایمنی هومورال فعال، به شکل آنتی بادی های آماده از یک فرد به فرد دیگر اشاره دارد. این می تواند به طور طبیعی از طریق انتقال جفتی آنتی بادی های مادر به جنین در حال رشد رخ دهد، یا می توان آن را به طور مصنوعی با تزریق آنتی بادی های اگزوژن به گیرنده با هدف قرار دادن یک پاتوژن یا سم خاص، القا کرد. دومی زمانی استفاده می شود که خطر عفونت زیاد باشد و زمان کافی برای بدن برای ایجاد پاسخ ایمنی خود یا کاهش علائم بیماری های مزمن یا سرکوبگر سیستم ایمنی وجود ندارد.
ایمن سازی فعال به تولید آنتی بادی علیه یک عامل خاص پس از قرار گرفتن در معرض آنتی ژن اشاره دارد. می تواند از طریق عفونت طبیعی با یک میکروب یا از طریق تجویز واکسنی که می تواند شامل پاتوژن های ضعیف شده یا ارگانیسم های غیرفعال باشد، به دست آید.
آسیب شناسی ایمنی
همانطور که قبلا ذکر شد، نقص در پاسخ ایمنی ذاتی یا تطبیقی می تواند باعث ایجاد بیماری شود. چنین اختلالاتی عموما ناشی از یک پاسخ ایمنی بیش فعال (معروف به واکنش های حساسیت مفرط)، یک واکنش نامناسب به عوامل خودی (معروف به خود ایمنی) یا پاسخ های ایمنی غیر مؤثر (معروف به نقص ایمنی) است.
واکنش های حساسیت مفرط
واکنش های حساسیت بیش از حد به پاسخ های نامطلوب تولید شده توسط سیستم ایمنی طبیعی اشاره دارد. چهار نوع واکنش حساسیت مفرط وجود دارد که عبارتند از:
- نوع I: حساسیت مفرط فوری
- نوع II: حساسیت سیتوتوکسیک یا وابسته به آنتی بادی
- نوع III: بیماری کمپلکس ایمنی
- نوع IV: ازدیاد حساسیت نوع تاخیری
حساسیت نوع I شایع ترین نوع واکنش حساسیت مفرط است. این یک واکنش آلرژیک است که با قرار گرفتن مجدد در معرض نوع خاصی از آنتی ژن که به عنوان یک آلرژن شناخته می شود، تحریک می شود. بر خلاف پاسخ ایمنی طبیعی، پاسخ حساسیت مفرط نوع I با ترشح IgE توسط سلول های پلاسما مشخص می شود.
آنتی بادی های IgE به گیرنده های سطح ماست سل های بافتی و بازوفیل های خون متصل می شوند و باعث حساس شدن آنها می شوند. قرار گرفتن بعدی در معرض همان آلرژن، IgE محدود شده را به سلولهای حساس متصل میکند و منجر به دگرانولاسیون و ترشح واسطههای فعالی مانند هیستامین، لکوترین و پروستاگلاندین میشود که باعث اتساع عروق و انقباض عضلات صاف بافت اطراف میشوند.
آلرژن های محیطی متداول که باعث ایجاد آلرژی های IgE می شوند عبارتند از اپیتلیوم گربه، سگ و اسب، گرده، کنه های گرد و غبار خانگی و کپک ها. آلرژن های غذایی نیز یکی از علل شایع واکنش های حساسیت نوع I هستند. با این حال، این نوع واکنش ها در کودکان بیشتر از بزرگسالان دیده می شود. درمان واکنشهای نوع I عموما شامل اجتناب از محرکها و در مورد آلرژنهای استنشاقی، مداخله دارویی با گشادکنندههای برونش، آنتی هیستامینها و عوامل ضد التهابی است. موارد شدیدتر ممکن است با ایمونوتراپی درمان شوند.
واکنش های حساسیت نوع II نادر است و بین ۲ تا ۲۴ ساعت طول می کشد تا ایجاد شود. این نوع واکنشها زمانی رخ میدهند که آنتیبادیهای IgG و IgM به مولکولهای سطح سلولی خود بیمار متصل میشوند و کمپلکسهایی را تشکیل میدهند که سیستم کمپلمان را فعال میکنند. این به نوبه خود منجر به اپسونیزاسیون، آگلوتیناسیون گلبول های قرمز (فرآیند آگلوتیناسیون یا مجموعه شدن)، لیز سلولی و مرگ می شود. برخی از نمونههایی از واکنشهای حساسیت نوع II عبارتند از: اریتروبلاستوز جنینی، سندرم گودپاسچر و کمخونیهای خودایمنی.
واکنشهای حساسیت نوع III زمانی اتفاق میافتد که آنتیبادیهای IgG و IgM به پروتئینهای محلول (به جای مولکولهای سطح سلولی مانند واکنشهای حساسیت نوع II) متصل میشوند و کمپلکسهای ایمنی را تشکیل میدهند که میتوانند در بافتها رسوب کنند و منجر به فعال شدن مکمل، التهاب، هجوم نوتروفیل و دگرانولاسیون ماست سل میشوند.
ایجاد این نوع واکنش می تواند ساعت ها، روزها یا حتی هفته ها طول بکشد و درمان به طور کلی شامل عوامل ضد التهابی و کورتیکواستروئیدها است. نمونه هایی از واکنش های افزایش حساسیت نوع III شامل لوپوس اریتماتوز سیستمیک (SLE)، بیماری سرمی و آرتریت واکنشی است.
برخلاف سایر انواع واکنش های حساسیت مفرط، واکنش های نوع IV با واسطه سلولی و مستقل از آنتی بادی هستند. آنها دومین نوع شایع واکنش حساسیت مفرط هستند و معمولا ۲ روز یا بیشتر طول می کشد تا ایجاد شوند. این نوع واکنش ها در اثر تحریک بیش از حد سلول های T و مونوسیت ها – ماکروفاژها ایجاد می شود که منجر به آزاد شدن سیتوکین هایی می شود که باعث التهاب، مرگ سلولی و آسیب بافت می شود. به طور کلی، این واکنش ها به راحتی از طریق اجتناب از محرک و استفاده از کورتیکواستروئیدهای موضعی قابل حل هستند.
خودایمنی (Autoimmunity)
خودایمنی شامل از دست دادن هموستاز ایمنی طبیعی است به طوری که ارگانیسم پاسخ غیر طبیعی به بافت خود ایجاد می کند. مشخصه خودایمنی وجود سلول های T خود واکنشی، آنتی بادی های خودکار و التهاب است. نمونه های بارز بیماری های خودایمنی عبارتند از: بیماری سلیاک، دیابت نوع یک، بیماری آدیسون و بیماری گریوز.
نقص ایمنی (Immunodeficiency)
نقص ایمنی به حالتی اطلاق می شود که در آن توانایی سیستم ایمنی برای مبارزه با بیماری های عفونی به خطر افتاده یا به طور کامل وجود ندارد. اختلالات نقص ایمنی ممکن است ناشی از یک نقص مادرزادی اولیه (نقص ایمنی اولیه) یا ممکن است از یک علت ثانویه (نقص ایمنی ثانویه)، مانند عفونت های ویروسی یا باکتریایی، سوء تغذیه یا درمان با داروهایی که باعث سرکوب سیستم ایمنی می شوند، ایجاد شود.
برخی از بیماری ها نیز می توانند به طور مستقیم یا غیرمستقیم سیستم ایمنی را مختل کنند مانند لوسمی و مولتیپل میلوما. نقص ایمنی همچنین نشانه سندرم نقص ایمنی اکتسابی (ایدز) است که توسط ویروس نقص ایمنی انسانی (HIV) ایجاد می شود. HIV به طور مستقیم سلول های Th را آلوده می کند و همچنین سایر پاسخ های سیستم ایمنی را به طور غیر مستقیم مختل می کند.
نتیجه گیری
ایمنی ذاتی اولین مکانیسم ایمونولوژیک و غیر اختصاصی برای مبارزه با عفونت ها است. این پاسخ ایمنی سریع است، چند دقیقه یا چند ساعت پس از حمله رخ می دهد و توسط سلول های متعددی از جمله فاگوسیت ها، سلول های T، ماست سل ها، بازوفیل ها و ائوزینوفیل ها و همچنین سیستم کمپلمان واسطه می شود.
ایمنی تطبیقی در ارتباط با ایمنی ذاتی برای از بین بردن عوامل عفونی ایجاد می شود. این متکی بر تعامل محکم بین سلول های T، APCs و سلول های B است. یکی از ویژگیهای حیاتی ایمنی تطبیقی، توسعه حافظه ایمونولوژیک یا توانایی سیستم برای یادگیری یا ثبت تجربیات خود با پاتوژنهای مختلف است که منجر به پاسخهای ایمنی مؤثر و سریع در مواجهه بعدی با پاتوژنهای مشابه یا مشابه میشود.
هم افزایی زیادی بین سیستم ایمنی سازگار و همتای ذاتی آن وجود دارد و نقص در هر یک از این سیستم ها می تواند منجر به اختلالات ایمنی از جمله بیماری های خود ایمنی، نقص ایمنی و واکنش های حساسیت مفرط شود. بقیه این مکمل بر تشخیص، درمان و مدیریت مناسب برخی از این اختلالات برجسته تر، به ویژه آنهایی که با واکنش های حساسیت بیش از حد مرتبط هستند، تمرکز خواهد کرد.





کلاس ها چند ساعته هست ؟ آیا نیاز به پایه خاصی هست
قسمت پیش نیاز دوره را مطالعه کنید. زمان کلاس ها از ۲ تا ۴ ساعت متغیر است
دوره طراحی واکسن غیر حضوری هست؟ هزینه دوره چقدر هست؟
بله غیر حضوری است هزینه در همین صفحه نوشته شده
سلام . من برای پایان نامه ارشدم طراحی واکسن کار کردم . میخواستم بپرسم ملاک حساسیت زایی و سمیت سازه واکسن در طراحی بیوانفورماتیکی چیست؟
ممنون میشم پاسخ بدید
در طراحی واکسنها به روش بیوانفورماتیکی، چندین معیار کلیدی برای ارزیابی حساسیتزایی و سمیت سازههای واکسنی در نظر گرفته میشود. این فرایند معمولاً شامل تجزیه و تحلیل توالیهای پروتئینی و پپتیدی، مدلسازی ساختاری، و پیشبینی تعاملات مولکولی است. در اینجا به چند ملاک مهم در ارزیابی حساسیتزایی و سمیت اشاره میکنم:
حساسیتزایی (Immunogenicity)
حساسیتزایی یک واکسن به توانایی آن در تحریک پاسخ ایمنی مطلوب اشاره دارد. در طراحی بیوانفورماتیکی واکسنها، ارزیابی حساسیتزایی شامل موارد زیر است:
پیشبینی اپیتوپها: استفاده از نرمافزارهای تخصصی برای شناسایی قسمتهایی از پروتئینها که میتوانند به عنوان اپیتوپهای بیسلولی (B-cell epitopes) یا تیسلولی (T-cell epitopes) عمل کنند. این اپیتوپها باید قادر به القای پاسخ ایمنی قوی باشند.
مطالعه تنوع ژنتیکی: ارزیابی تنوع ژنتیکی در جمعیتهای مختلف برای تضمین اینکه واکسن برای گروههای گستردهای از جمعیت مؤثر است.
شبیهسازی پاسخ ایمنی: استفاده از مدلهای کامپیوتری برای شبیهسازی پاسخ ایمنی که واکسن میتواند در بدن ایجاد کند.
سمیت (Toxicity)
سمیت سازه واکسن به احتمال آسیب رساندن به سلولهای میزبان یا ایجاد اثرات جانبی غیرقابل قبول اشاره دارد. ارزیابی سمیت شامل:
پیشبینی سمیت: استفاده از برنامههای کامپیوتری برای پیشبینی سمیت محتمل پپتیدها و پروتئینها بر اساس ساختار و توالی آنها.
ارزیابی اثرات خودایمنی: تحلیل برای شناسایی اگر بخشی از واکسن ممکن است پاسخ خودایمنی در بدن میزبان را تحریک کند.
تجزیه و تحلیل ساختاری: مدلسازی ساختاری برای شناسایی هرگونه ویژگیهای ساختاری که ممکن است به سمیت منجر شوند.
تایید آزمایشگاهی
علاوه بر این تجزیه و تحلیلهای بیوانفورماتیکی، آزمایشهای آزمایشگاهی نیز برای تایید حساسیتزایی و سمیت انجام میشود. این میتواند شامل آزمایشات in vitro و in vivo برای تست ایمنی و اثربخشی واکسن باشد.
ارزیابی دقیق هر دوی این جنبهها ضروری است تا اطمینان حاصل شود که واکسنهای طراحی شده نه تنها مؤثر بلکه ایمن برای استفاده در انسانها هستند.
میخواهم شامل این کلاس شوم
میتوانید روی تصویر ثبت نام کلیک کنید
مشاوره در مورد دوره
جهت مشاوره رایگان با ما تماس بگیرید یا روی دکمه مشاوره رایگان بالای صفحه کلیک کنید
سلام وقتتون بخیر. گزینه غیرحضوری کلاس های بیوپایتون چرا فعال نیست؟
سلام، با توجه به بازدهی بیشتر کلاس حضوری، در حال حاضر کلاس آنلاین برگزار نمیشود
سلام وقت بخیر
امکانش هست دوره از اول تابستون شروع بشه
با سلام، تقویم آموزشی ما را دنبال کنید تا از تاریخ شروع دوره ها مطلع شوید