تومور نورواندوکرین پانکراس (Pancreatic Neuroendocrine Tumor) چیست؟
تومورهای نورواندوکرین پانکراس (NETs) یا تومورهای سلول جزایر (islet cell tumors)، نوعی سرطان هستند که از پانکراس شروع میشود. سرطان زمانی شروع میشود که سلولهای بدن شروع به رشد خارج از کنترل میکنند.
NETهای پانکراس نوع کمتر رایجی از سرطان پانکراس هستند. آنها کمتر از 2 درصد از سرطانهای پانکراس را تشکیل میدهند اما نسبت به نوع رایج تر، چشم انداز بهتری (پیش آگهی یا وضعیت پیش رو) دارند.
جایی که تومورهای نورواندوکرین پانکراس شروع میشوند:
تومورهای اعصاب غدد پانکراس در سلولهای عصبی غدد درون ریز، نوع خاصی از سلولهای موجود در پانکراس، شروع میشوند. سلولهای عصبی غدد درون ریز در سایر نواحی بدن نیز یافت میشوند اما تنها سرطانهایی که از سلولهای عصبی غدد درون ریز در لوزالمعده تشکیل میشوند، تومورهای نورواندوکرین پانکراس نامیده میشوند.
سیستم عصبی غدد درون ریز (neuroendocrine system)
سلولهای عصبی غدد درون ریز از برخی جهات مانند سلولهای عصبی و از جهاتی شبیه سلولهای غدد درون ریز هورمون ساز هستند. سلولهای این سیستم اندام واقعی را تشکیل نمیدهند. در عوض، آنها در سایر اندامها مانند مری، معده، پانکراس، رودهها و ریهها پراکنده میشوند.
سلولهای عصبی غدد درون ریز (Neuroendocrine cells، که گاهی اوقات سلولهای غدد درون ریز نامیده میشوند) در پانکراس در دستههای کوچکی به نام جزایر (یا جزایر لانگرهانس یا islets of Langerhans) یافت میشوند. این جزایر هورمونهای مهمی را مانند انسولین و گلوکاگون (که به کنترل سطح قند خون کمک میکنند) میسازند و مستقیماً در خون آزاد میکنند.
پانکراس (pancreas)
پانکراس عضوی است که پشت معده قرار دارد. شکل آن کمی شبیه ماهی است با سر پهن، بدنی باریک و دمی باریک و نوک تیز. در بزرگسالان حدود 6 اینچ (15 سانتی متر) طول اما کمتر از 2 اینچ (5 سانتی متر) عرض دارد.
- سر لوزالمعده در سمت راست شکم (belly)، پشت جایی که معده به دوازدهه (duodenum، اول قسمت روده کوچک) میرسد، قرار دارد.
- بدن پانکراس در پشت معده قرار دارد.
- دم پانکراس در سمت چپ شکم در کنار طحال قرار دارد.
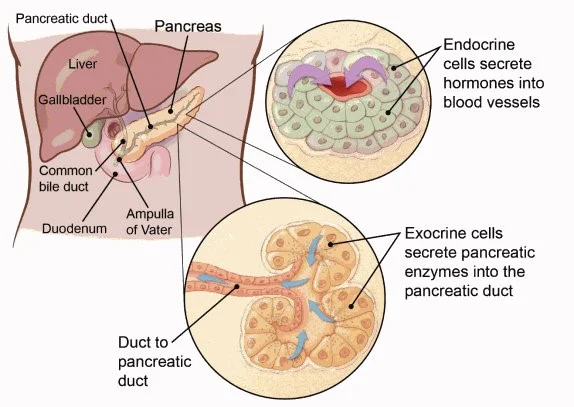
تومورهای نورواندوکرین در سلولهای غدد درون ریز پانکراس شروع میشوند. اما بیشتر پانکراس در واقع از نوع دیگری از سلولها به نام سلولهای برون ریز تشکیل شده است. این سلولها غدد و مجاری برون ریز را تشکیل میدهند. غدد برون ریز آنزیمهای لوزالمعده را میسازند که در رودهها آزاد میشوند تا به شما در هضم غذاها (به ویژه چربیها) کمک کنند. شایع ترین نوع سرطان پانکراس، آدنوکارسینوم پانکراس (adenocarcinoma of the pancreas)، از سلولهای برون ریز شروع میشود.
اگر سرطان لوزالمعده برای شما تشخیص داده شد، بسیار مهم است که بدانید این سرطان برون ریز یا سرطان غدد درون ریز (در اینجا بحث شده است) است. آنها عوامل خطرزازا و علل مشخصی دارند، علائم و نشانههای متفاوتی دارند، با آزمایشهای مختلفی تشخیص داده میشوند، به روشهای مختلف درمان میشوند و دیدگاههای متفاوتی نیز دارند.
انواع تومورهای نورواندوکرین پانکراس
درجه تومور
تومورهای اعصاب غدد پانکراس (Pancreatic neuroendocrine tumors یا NETs) بر اساس درجه تومور طبقه بندی میشوند که نشان میدهد سرطان با چه سرعتی احتمال رشد و گسترش را دارد.
- تومورهای عصبی غدد درون ریز درجه 1 (همچنین به آنها با درجه پایین یا با تمایز خوب یا well-differentiated نیز گفته میشود) سلولهایی دارند که بیشتر شبیه سلولهای طبیعی هستند و به سرعت تکثیر نمیشوند.
- تومورهای درجه 2 (همچنین به آنها با درجه متوسط یا با تمایز متوسط یا moderately differentiated نیز گفته میشود) ویژگیهایی بین تومورهای با درجه پایین و بالا را (به مطالب زیر مراجعه کنید) دارند.
- تومورهای نورواندوکرین درجه 3 (همچنین به آنها با درجه بالا یا با تمایز ضعیف یا poorly differentiated نیز گفته میشود) دارای سلولهایی هستند که بسیار غیر طبیعی به نظر میرسند و سریع تر تکثیر میشوند.
سرطانهایی که درجه 1 یا 2 هستند، تومورهای عصبی غدد پانکراس (pancreatic neuroendocrine tumors) نامیده میشوند. این سرطانها به کندی رشد میکنند و احتمالاً میتوانند به سایر قسمتهای بدن سرایت کنند.
سرطانهایی که درجه 3 دارند، کارسینومهای عصبی غدد پانکراس (pancreatic neuroendocrine carcinomas یا NECs) نامیده میشوند. این سرطانها تمایل به رشد و گسترش سریعی دارند و میتوانند به سایر قسمتهای بدن سرایت کنند.
بخش مهم دیگر درجه بندی، اندازه گیری تعداد سلولها در فرآیند تقسیم به سلولهای جدید است. این موضوع با جزئیات بیشتر در مراحل تومور نورواندوکرین پانکراس توضیح داده شده است.
عملکرد تومور
تومور نورواندوکرین پانکراس نیز بر اساس عملکرد آنها (ساخت هورمونهایی که باعث ایجاد علائم میشوند) یا ناکارآمدی (هورمون نمیسازند) نام گذاری میشوند.
NETهای عملکردی (Functioning NETs): حدود نیمی از NETهای پانکراس هورمونهایی میسازند که در خون ترشح میشوند و علائم ایجاد میکنند. به اینها NETهای کارآمد (functioning NETs) میگویند. هر کدام به دلیل نوع هورمونی که سلولهای تومور میسازند نامگذاری شده اند.
- انسولینومها (Insulinomas) از سلولهایی میآیند که انسولین (insulin) میسازند.
- گلوکاگونومها (Glucagonomas) از سلولهایی میآیند که گلوکاگون (glucagon) میسازند.
- گاسترینومها (Gastrinomas) از سلولهایی میآیند که گاسترین (gastrin) را میسازند.
- سوماتوستاتینومها (Somatostatinomas) از سلولهایی میآیند که سوماتوستاتین (somatostatin) را میسازند.
- VIPomaها از سلولهایی میآیند که پپتید وازواکتیو روده ای (vasoactive intestinal peptide یا VIP) میسازند.
- تومورهای ترشح کننده ACTH از سلولهایی میآیند که هورمون آدرنوکورتیکوتروپیک (adrenocorticotropic hormone یا ACTH) را میسازند.
بیشتر (تا 70 درصد) NETهای فعال انسولینوم هستند. انواع دیگر بسیار کمتر رایج هستند.
NETهای غیر کارآمد (Non-functioning NETs): این تومورها به اندازه کافی هورمون اضافی برای ایجاد علائم تولید نمیکنند. از آن جایی که آنها هورمونهای اضافی ایجاد نمیکنند که باعث علائم میشوند، اغلب میتوانند قبل از پیدا شدن بسیار بزرگ شوند.
علائمی که ممکن است هنگام بزرگ شدن آنها رخ دهد شامل درد شکم (belly)، بی اشتهایی و کاهش وزن است.
تومورهای کارسینوئید (Carcinoid tumors): این NETها در سایر قسمتهای دستگاه گوارش بسیار شایع تر هستند، اگرچه به ندرت میتوانند از پانکراس شروع شوند. این تومورها اغلب سروتونین (serotonin) میسازند.
روش درمان و چشم انداز تومور نورواندوکرین پانکراس به نوع خاص تومور و مرحله (وسعت) تومور بستگی دارد اما چشم انداز آن به طور کلی بهتر از سرطانهای برون ریز پانکراس است.
آمار کلیدی برای تومور نورواندوکرین پانکراس
تومورهای اعصاب غدد پانکراس (NETs) نادر هستند و حدود 7 درصد از کل سرطانهایی را تشکیل میدهند که در پانکراس رخ میدهند. تخمینهای انجمن سرطان آمریکا پیش بینی میکند که در سال 2022 حدود 4300 نفر در ایالات متحده مبتلا به NET پانکراس تشخیص داده میشوند.
به نظر میرسد که بروز NETهای پانکراس در طول سالها در حال افزایش است. تصور میشود که این تا حدودی به این دلیل است که آنها اغلب به طور تصادفی پیدا میشوند، زمانی که آزمایشهای تصویر برداری مانند اسکن سی تی یا ام آر آی به دلایل دیگری انجام میشود. همچنین، توانایی تشخیص این تومورها از انواع دیگر سرطانها در آزمایشگاه بهبود یافته است.
اکثر افراد مبتلا به NETهای پانکراس مسن تر هستند و میانگین سنی تشخیص آن 60 سال است. این بیماری در مردان کمی بیشتر از زنان رایج است.
افرادی که دارای NETهای پانکراس درجه 1 یا 2 هستند، نسبت به افرادی که دارای NETهای پانکراس درجه 3 هستند، بیشتر عمر میکنند. برای دریافت آمار بیشتر مربوط به بقا، به مبحث نرخ بقای تومور نورواندوکرین پانکراس بر اساس مرحله مراجعه کنید.
علائم و نشانههای تومور نورواندوکرین پانکراس
داشتن یک یا چند مورد از علائم زیر به معنای ابتلا به تومور نورواندوکرین پانکراس (NET) نیست. در واقع، بسیاری از این علائم بیشتر به دلیل وجود سایر شرایط ایجاد میشوند. با این حال، اگر هر یک از این علائم را دارید، مهم است که آنها را توسط پزشک بررسی کنید تا در صورت نیاز بتوان علت را پیدا کرده و آن را درمان کرد.
NETهای پانکراس اغلب هورمونهای اضافی را در جریان خون آزاد میکنند. انواع مختلف تومورها هورمونهای مختلفی را میسازند که میتواند منجر به بروز علائم متفاوتی شود.
گاسترینوم (Gastrinomas)
این تومورها گاسترین (gastrin) را میسازند، هورمونی که به معده میگوید اسید بیشتری بسازد. مصرف بیش از حد گاسترین باعث ایجاد وضعیتی به نام سندرم زولینگر-الیسون (Zollinger-Ellison syndrome) میشود که در آن معده بیش از حد اسید تولید میکند. این حالت منجر به زخم معده میشود که میتواند باعث درد، حالت تهوع و از دست دادن اشتها شود.
زخمهای شدید میتوانند خونریزی کنند. حتی اگر خونریزی خفیف باشد، میتواند منجر به کم خونی (گلبولهای قرمز بسیار کم) شود که میتواند علائمی مانند احساس خستگی و تنگی نفس را ایجاد کند. اگر خونریزی شدیدتر باشد، میتواند مدفوع را سیاه و قیری رنگ کند. خونریزی شدید خود میتواند تهدید کننده زندگی باشد.
اگر اسید معده به روده کوچک برسد، میتواند به سلولهای پوشش روده آسیب برساند و آنزیمهای گوارشی را قبل از اینکه فرصتی برای هضم غذا داشته باشند، تجزیه میکند. این حالت میتواند باعث اسهال و کاهش وزن شود.
گلوکاگونوم (Glucagonomas)
این تومورها گلوکاگون را میسازند، هورمونی که سطح گلوکز (قند) خون را افزایش میدهد. بیشتر علائمی که میتواند توسط گلوکاگونوم ایجاد شود خفیف هستند و اغلب به دلیل چیز دیگری ایجاد میشوند.
گلوکاگون بیش از حد میتواند قند خون را افزایش دهد و گاهی اوقات منجر به دیابت میشود. این عارضه میتواند علائمی مانند احساس تشنگی و گرسنگی و نیاز به دفع مکرر ادرار ایجاد کند.
افراد مبتلا به این تومورها همچنین ممکن است مشکلاتی با اسهال، کاهش وزن و سوء تغذیه داشته باشند. مشکلات تغذیه میتواند منجر به علائمی مانند تحریک زبان و گوشههای دهان شود.
علامتی که بیشتر افراد مبتلا به گلوکاگونوم را نزد پزشک میآورد، زوائد پوستی به نام اریتم مهاجرتی نکرولیتیک (necrolytic migratory erythema) است. این حالت یک ناحیه قرمز با تورم و تاول است که اغلب از جایی به جای دیگر روی پوست پخش میشود.
انسولینوم (Insulinomas)
این تومورها انسولین تولید میکنند که سطح گلوکز خون را کاهش میدهد. انسولین بیش از حد منجر به کاهش قند خون میشود که میتواند علائمی مانند ضعف، گیجی، تعریق و ضربان قلب سریع را ایجاد کند. وقتی قند خون بسیار پایین میآید، میتواند منجر به غش کردن فرد یا حتی رفتن به کما و تشنج شود.
سوماتوستاتینوما (Somatostatinomas)
این تومورها سوماتوستاتین را میسازند که به تنظیم هورمونهای دیگر کمک میکند. علائم این نوع تومور میتواند شامل درد شکم، حالت تهوع، کم اشتهایی، کاهش وزن، اسهال، علائم دیابت (احساس تشنگی و گرسنگی و نیاز به دفع مکرر ادرار) و زردی (زردی پوست و چشمها) باشد.
علائم اولیه سوماتوستاتینوما خفیف هستند و اغلب ناشی از موارد دیگر میباشند، بنابراین این تومورها در مراحل پیشرفته تشخیص داده میشوند. اغلب تا زمانی که به کبد سرایت نکنند و مشکلاتی مانند زردی و درد را ایجاد کنند، یافت نمیشوند.
VIPomas
این تومورها ماده ای به نام پپتید وازواکتیو روده ای (VIP) میسازند. VIP بیش از حد میتواند منجر به مشکلات اسهال شود. این عارضه ممکن است در ابتدا خفیف باشد اما با گذشت زمان بدتر میشود. تا زمانی که تشخیص داده شود، اکثر افراد اسهال شدید و آبکی دارند.
علائم دیگر میتواند شامل تهوع، استفراغ، گرفتگی عضلات، احساس ضعف یا خستگی و برافروختگی (قرمزی و گرمی در صورت یا گردن) باشد.
افراد مبتلا به این تومورها همچنین تمایل به سطوح پایین اسید در معده خود دارند که میتواند منجر به مشکلات هضم غذا شود.
تومورهای کارسینوئیدی (Carcinoid tumors)
این تومورها اغلب سروتونین یا پیش ساز آن یعنی 5-HTP را میسازند. تومورهای کارسینوئیدی اغلب تا زمانی که به خارج از پانکراس پخش نشوند علائمی ایجاد نمیکنند. هنگامی که این تومورها گسترش مییابند، اغلب به کبد میرسد. در آن جا سلولهای سرطانی میتوانند هورمونها را مستقیماً در خون آزاد کنند. این کار میتواند باعث بروز سندرم کارسینوئید شود، با علائمی مانند برافروختگی (قرمزی و گرمی در صورت یا گردن)، اسهال، خس خس سینه و ضربان قلب سریع. این علائم اغلب در دورههایی رخ میدهند که در بین آنها فرد ممکن است احساس خوبی داشته باشد.
در طول مدت طولانی، مواد هورمون مانندی که توسط این تومورها آزاد میشود میتواند به دریچههای قلب آسیب برساند و باعث تنگی نفس، ضعف و سوفل قلبی (صدای غیر طبیعی قلب یا heart murmur) شود.
تومورهای عصبی غدد درون ریز غیر عملکردی (Non-functioning neuroendocrine tumors)
این تومورها هورمون اضافی نمیسازند، بنابراین در مراحل اولیه علائمی ایجاد نمیکنند و اغلب قبل از پیدا شدن بسیار بزرگ میشوند. بیشتر اینها با بزرگتر شدن یا پخش شدن به خارج از پانکراس شروع به ایجاد مشکل میکنند. علائم میتواند مانند علائم سرطان پانکراس برون ریز باشد، از جمله زردی (زردی چشم و پوست)، درد شکم و کاهش وزن. گاهی اوقات، با رشد تومور نورواندوکرین پانکراس، میتواند از تولید خیلی کم هورمون (ناکارکرد) به تولید بیش از حد یک هورمون خاص (عملکرد) که باعث علائم میشود، تبدیل شود.
علائم ناشی از گسترش سرطان
هنگامی که تومور نورواندوکرین پانکراس پخش میشوند، اغلب به سمت کبد میروند. این اتفاق میتواند کبد را بزرگ کند که میتواند باعث درد و از دست دادن اشتها شود. همچنین میتواند بر عملکرد کبد تأثیر بگذارد و گاهی اوقات منجر به زردی (زردی پوست و چشم) و آزمایش خون غیر طبیعی میشود.
این سرطانها میتوانند به سایر اندامها و بافتها نیز سرایت کنند. علائم بستگی به محل رشد سرطان دارد. به عنوان مثال، گسترش سرطان به ریهها میتواند باعث تنگی نفس یا سرفه شود. انتشار به استخوانها میتواند باعث درد در آن نواحی شود.
علت ایجاد تومور نورواندوکرین پانکراس چیست؟
دانشمندان دقیقاً نمیدانند چه چیزی باعث ایجاد بیشتر تومورهای عصبی غدد پانکراس (NETs) میشود اما آنها چندین عامل خطرزا را یافته اند که میتواند احتمال ابتلای فرد به این بیماری را افزایش دهد. برخی از این عوامل خطرزا بر روی DNA سلولهای سیستم عصبی غدد درون ریز در پانکراس تأثیر میگذارند که میتواند منجر به رشد غیر طبیعی سلول شده و ممکن است باعث ایجاد سرطان شود.
DNA ماده شیمیایی موجود در سلولهای ما است که حامل ژنهای ما میباشد که عملکرد سلولهای ما را کنترل میکند. ما شبیه والدین خود هستیم زیرا آنها منبع DNA ما هستند. اما DNA چیزی بیش از ظاهر ما را تحت تأثیر قرار میدهد.
برخی از ژنها زمان رشد سلولهای ما، تقسیم به سلولهای جدید و مرگ را کنترل میکنند:
- ژنهایی که به رشد، تقسیم و زنده ماندن سلولها کمک میکنند، انکوژن (oncogene) نامیده میشوند.
- ژنهایی که به کنترل تقسیم سلولی، ترمیم اشتباهات در DNA یا مرگ سلولها در زمان مناسب کمک میکنند، ژنهای سرکوبگر تومور (tumor suppressor gene) نامیده میشوند.
سرطانها میتوانند در اثر تغییرات DNA (جهش) ایجاد شوند که انکوژنها را فعال میکنند یا ژنهای سرکوب کننده تومور را خاموش میکنند.
جهش ژنی ارثی (Inherited gene mutations)
اگرچه 90 درصد از PNETها پراکنده (تصادفی) هستند، برخی از افراد تغییرات ژنی را از والدین خود به ارث میبرند که خطر ابتلا به NET پانکراس را افزایش میدهد. گاهی اوقات این تغییرات ژنی بخشی از سندرمها هستند که خطر ابتلا به سایر مشکلات سلامتی را نیز افزایش میدهند.
سندرمهای مربوط به تغییرات در سه ژن سرکوبگر تومور مسئول بسیاری از موارد ارثی NETهای پانکراس هستند:
- سندرم نئوپلازی چند گانه غدد درون ریز نوع 1 (Multiple Endocrine Neoplasia یا MEN1): بیشتر موارد ارثی PNETها به دلیل تغییرات در ژن MEN1 است. این سندرم میتواند باعث سرطان در لوزالمعده، غدد پاراتیروئید و غده هیپوفیز شود. این تومورها معمولاً در سنین پایینتر اتفاق میافتند و معمولاً غیر فعال هستند. گاهی اوقات غربالگری افراد دارای ژن MEN1 یا اعضای خانواده آنها میتواند به یافتن NET پانکراس قبل از ظهور علائم کمک کند.
- سندرم Von Hippel-Lindau (VHL): تغییرات در ژن VHL باعث ایجاد تعداد کمی از NETهای پانکراس میشود که معمولاً در سنین پایین تر (گاهی در اوایل دهه 20 سالگی) ایجاد میشوند. این تومورها تمایل به عدم عملکرد و رشد آهسته دارند.
- سندرم نوروفیبروماتوز نوع 1 (Neurofibromatosis یا NF1): تعداد کمی از NETهای پانکراس (معمولا سوماتوستاتینوما) در اثر تغییرات در ژن NF1 ایجاد میشوند. سایر سرطانها نیز با این سندرم مرتبط هستند، از جمله تومورهای مغزی یا تومورهای خوش خیم که در اعصاب زیر پوست ایجاد میشوند (نوروفیبروم یا neurofibromas).
درمان تومور نورواندوکرین پانکراس که توسط یک سندرم ژنتیکی ایجاد میشود ممکن است در مقایسه با درمان NET پانکراس در فردی بدون جهش ژنی متفاوت باشد.
جهشهای ژنی اکتسابی (Acquired gene mutations)
اکثر جهشهای ژنی مربوط به تومورهای عصبی غدد درون ریز پانکراس در اثر تغییرات تصادفی ایجاد میشوند. این جهشهای تصادفی در صورتی اکتسابی نامیده میشوند که پس از تولد فرد اتفاق بیفتند، نه اینکه ارثی باشند. این جهشهای ژنی اکتسابی گاهی از قرار گرفتن در معرض مواد شیمیایی سرطانزا (مانند مواردی که در دود تنباکو یافت میشوند) ایجاد میشوند. اما اغلب علت این تغییرات مشخص نیست.
عوامل خطرزا تومور نورواندوکرین پانکراس
عامل خطرزا هر چیزی است که شانس ابتلا به بیماری مانند سرطان را افزایش دهد. سرطانهای مختلف عوامل خطرزای متفاوتی دارند. برخی از عوامل خطرزا مانند سیگار کشیدن را میتوان تغییر داد.
موارد دیگر، مانند سن یا سابقه خانوادگی فرد، قابل تغییر نیستند.
اما داشتن یک عامل خطرزا یا حتی بسیاری از عوامل خطرزا به این معنی نیست که شما به این بیماری مبتلا خواهید شد. برخی از افرادی که به این بیماری مبتلا میشوند ممکن است عوامل خطرزای شناخته شده کمی داشته باشند یا اصلاً چنین عواملی را نداشته باشند.
عوامل متعددی میتوانند بر شانس ابتلای فرد به تومور عصبی غدد درون ریز (NET) پانکراس تأثیر بگذارند.
عوامل خطرزا قابل تغییر
سیگار کشیدن
سیگار کشیدن یک عامل خطرزا برای تومور نورواندوکرین پانکراس است. اکثر تحقیقات نشان میدهند که سیگار کشیدن زیاد خطر را افزایش میدهد اما برخی از مطالعات نشان میدهد که هر گونه سابقه سیگار کشیدن میتواند شما را در معرض خطر قرار دهد.
الکل
برخی از مطالعات ارتباط بین مصرف زیاد الکل و NETهای پانکراس را نشان داده اند. به نظر میرسد که این پیوند بیشتر به تومور نورواندوکرین پانکراسی که کار میکنند و عملکردی هستند، مربوط میشود تا NETهای پانکراسی که کار نمیکنند. مصرف زیاد الکل همچنین میتواند منجر به بیماریهایی مانند پانکراتیت مزمن شود که ممکن است خطر خالص پانکراس را افزایش دهد.
عوامل خطرزایی که قابل تغییر نیستند
سابقه خانوادگی
به نظر میرسد که تومور نورواندوکرین پانکراس در برخی خانوادهها بروز داده میشوند. در برخی از این خانوادهها، خطر بالا به دلیل یک سندرم ارثی است (در زیر توضیح داده شده است). در خانوادههای دیگر، ژن ایجاد کننده این خطر شناخته نشده است. اگر سابقه خانوادگی یک عامل خطرزا باشد، معمولاً شامل یکی از بستگان درجه یک (والدین، خواهر و برادر، فرزند)، سابقه خانوادگی NET پانکراس یا سابقه خانوادگی سرطان میشود.
سندرمهای ژنتیکی ارثی (Inherited genetic syndromes)
تغییرات ژنی ارثی (جهش) میتواند از والدین به فرزند منتقل شود. گاهی اوقات این تغییرات منجر به سندرمهایی میشوند که شامل افزایش خطر بروز سایر سرطانها (یا سایر مشکلات سلامتی) میشود.
تومورها و سرطانهای عصبی غدد پانکراس نیز میتوانند توسط سندرمهای ژنتیکی ایجاد شوند، مانند:
- نوروفیبروماتوز نوع 1 که در اثر جهش در ژن NF1 ایجاد میشود. این سندرم منجر به افزایش خطر بروز بسیاری از تومورها از جمله سوماتوستاتینوما میشود.
- نئوپلازی غدد درون ریز متعدد، نوع I (MEN1)، ناشی از جهش در ژن MEN1: این سندرم منجر به افزایش خطر تومورهای غده پاراتیروئید، غده هیپوفیز و سلولهای جزایر پانکراس میشود.
- سندرم Von Hippel-Lindau (VHL) که در اثر جهش در ژن VHL ایجاد میشود. این سندرم منجر به افزایش خطر ابتلا به بسیاری از تومورها از جمله تومور نورواندوکرین پانکراس میشود.
تغییرات در ژنهایی که باعث ایجاد برخی از این سندرمها میشوند را میتوان با آزمایش ژنتیکی یافت.
دیابت
تومور نورواندوکرین پانکراس در افراد مبتلا به دیابت شایع تر است. دلیل این امر معلوم نیست بیشتر این خطر در افراد مبتلا به دیابت نوع 2 دیده میشود. این نوع دیابت اغلب در بزرگسالی شروع شده و اغلب به اضافه وزن یا چاقی مربوط میشود. مشخص نیست که افراد مبتلا به دیابت نوع 1 (نوجوانان) در معرض خطر بالاتری هستند یا خیر.
پانکراتیت مزمن (Chronic pancreatitis)
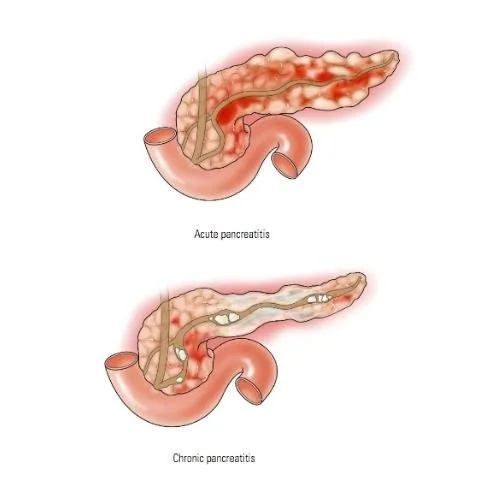
پانکراتیت مزمن، التهاب طولانی مدت لوزالمعده، با افزایش خطر ابتلا به NETهای پانکراس مرتبط است. اگر پانکراتیت مزمن به دلیل مصرف زیاد الکل باشد، قطع مصرف الکل ممکن است به کاهش خطر ابتلا به NETهای پانکراس کمک کند.
عوامل با تأثیر نامشخص بر خطر ابتلا
اضافه وزن یا چاق بودن
اضافه وزن یا چاقی میتواند یک عامل خطرزا برای تومور نورواندوکرین پانکراس باشد. مطالعات در این زمینه تا کنون بی نتیجه است.
قهوه
برخی از مطالعات قدیمی نشان داده اند که نوشیدن قهوه ممکن است خطر ابتلا به NET پانکراس را افزایش دهد اما مطالعات جدیدتر این موضوع را تایید نکرده اند.
آیا میتوان از تومور نورواندوکرین پانکراس پیشگیری کرد؟
هیچ راه مطمئنی برای جلوگیری از تومورهای نورواندوکرین پانکراس (NETs) وجود ندارد. برخی از عوامل خطرزا مانند سابقه خانوادگی قابل کنترل نیستند. اما کارهایی وجود دارد که میتوانید انجام دهید که ممکن است خطر ابتلای شما را کاهش دهد.
سیگار نکشید
سیگار یک عامل خطرزا قابل اجتناب برای NET پانکراس است. ترک سیگار ممکن است به کاهش خطر کمک کند. اگر سیگار میکشید و برای ترک آن کمک میخواهید، لطفاً با ارائهدهنده مراقبتهای بهداشتی و پزشکی خود صحبت کنید.
مصرف الکل را محدود کنید
مصرف زیاد الکل در برخی مطالعات با NETهای پانکراس مرتبط است اما در برخی دیگر نه. این ارتباط هنوز قطعی نیست اما مصرف زیاد الکل میتواند منجر به بیماریهایی مانند پانکراتیت مزمن شود که با افزایش خطر ابتلا به تومور نورواندوکرین پانکراس مرتبط است.
آیا میتوان تومور نورواندوکرین پانکراس را زود تشخیص داد؟
تومورهای اعصاب غدد پانکراس (NETs) به سختی در مراحل اولیه یافت میشوند. لوزالمعده در اعماق بدن قرار دارد، بنابراین تومورهای کوچک نمیتوانند توسط ارائه دهندگان مراقبتهای بهداشتی و پزشکی در طول معاینات فیزیکی معمول دیده یا احساس شوند. افراد معمولاً هیچ علامتی ندارند تا زمانی که سرطان از قبل به سایر اندامها سرایت کند.
در حال حاضر، هیچ گروه حرفه ای بزرگی غربالگری معمول برای تومور نورواندوکرین پانکراس را در افرادی که در معرض خطر متوسط هستند، توصیه نمیکند زیرا هیچ آزمایش غربالگری نشان داده نشده است که خطر مرگ ناشی از این سرطان را کاهش دهد. (غربالگری به معنای آزمایش وجود بیماری در افرادی است که هیچ علامت یا سابقه بیماری ندارند.)
آزمایش ژنتیک برای افرادی که ممکن است در معرض خطر بیشتری باشند:
برخی از افراد ممکن است به دلیل سابقه خانوادگی این بیماری (یا سابقه خانوادگی برخی سرطانهای دیگر) در معرض خطر ابتلا به NET پانکراس باشند. گاهی اوقات این افزایش خطر به دلیل یک سندرم ژنتیکی خاص است.
برخی از تغییرات ژنی که خطر تومور نورواندوکرین پانکراس را افزایش میدهند را میتوان آزمایش کرد. دانستن اینکه آیا در معرض افزایش خطر هستید میتواند به شما و پزشکتان کمک کند تا تصمیم بگیرید که آیا باید آزمایشاتی را برای جستجوی NET پانکراس در مراحل اولیه انجام دهید، زمانی که ممکن است درمان آن آسان تر باشد.
اما تعیین اینکه آیا ممکن است در معرض خطر بیشتر قرار داشته باشید، ساده نیست. صحبت با فردی با تجربه در سندرمهای سرطان ارثی مانند یک مشاور ژنتیک، متخصص ژنتیک، یا یک متخصص سرطان (پزشکی که افراد مبتلا به سرطان را درمان میکند) اغلب مفید است.
انجمن سرطان آمریکا قویاً توصیه میکند که هر کسی که به آزمایش ژنتیک فکر میکند با یک مشاور ژنتیک، پرستار یا دکتری که واجد شرایط تفسیر و توضیح نتایج آزمایش است، قبل از انجام آزمایش صحبت کند. قبل از تصمیم گیری برای آزمایش، مهم است که بدانید آزمایشها چه چیزی میتوانند – و نمیتوانند – به شما بگویند و چه نتایجی ممکن است چه معنی داشته باشند.
آزمایشهای ژنتیکی به دنبال جهشهایی در ژنهای شما هستند که باعث بیماریهای ارثی میشوند. این آزمایشها برای بررسی این شرایط ارثی استفاده میشود، نه خود سرطان. اگر یکی از این شرایط را داشته باشید، ممکن است خطر ابتلا شما افزایش یابد اما به این معنا نیست که شما پانکراس NET را دارید یا قطعا خواهید داشت.
آزمایش تومور نورواندوکرین پانکراس در افراد در معرض خطر
برای افرادی که در خانوادههایی در معرض خطر بالای تومور نورواندوکرین پانکراس هستند، مانند سندرم MEN1، آزمایشهای تشخیص زود هنگام سرطان ممکن است کمک کننده باشد. اگرچه دستور العملهای غربالگری قطعی برای افراد دارای ژن MEN1 یا اعضای خانواده آنها در دسترس نیست، پزشکان با این آزمایشها توانسته اند NETهای پانکراس زودرس و قابل درمان را در برخی از اعضای خانوادههای پرخطر پیدا کنند. برخی از تستهایی که ممکن است در نظر گرفته شوند، عبارتند از:
- سونوگرافی آندوسکوپی پانکراس هر چند سال یکبار.
- MRI پانکراس هر چند سال یکبار.
- بررسی سطوح خونی برخی هورمونها مانند انسولین، پرولاکتین، گاسترین و کلسیم هر چند سال یکبار. (گاهی اوقات، تغییرات در هورمونها ممکن است 10 سال قبل از پیدا شدن تومور توسط علائم بالینی رخ دهد.)
- Octreoscan به طور منظم.
آزمایشات تومور نورواندوکرین پانکراس
برخی علائم و نشانهها ممکن است نشان دهند که یک فرد ممکن است به تومور عصبی غدد پانکراس (NET) مبتلا باشد، اما آزمایشهایی برای تأیید تشخیص لازم است.
سابقه پزشکی و معاینه فیزیکی
در گرفتن سابقه پزشکی، پزشک از شما سوالاتی در مورد سلامت عمومی، عادات سبک زندگی، علائم و عوامل خطرزا میپرسد. پزشک همچنین احتمالاً در مورد علائم مربوط به تولید بیش از حد هورمون مانند اسهال، درد شکم (belly) یا زوائد پوستی سؤال خواهد کرد.
پزشک شما را نیز معاینه خواهد کرد تا علائم تومور نورواندوکرین پانکراس یا سایر مشکلات سلامتی را جستجو کند. امتحان احتمالا بیشتر بر روی شکم شما متمرکز خواهد بود. نتهای پانکراس گاهی اوقات میتوانند باعث تورم کبد یا کیسه صفرا شوند که ممکن است پزشک در طول معاینه آن را احساس کند.
اگر نتایج معاینه غیر طبیعی باشد، پزشک احتمالاً آزمایشاتی مانند تصویر برداری، آزمایشگاه یا سایر روشها را برای کمک به یافتن مشکل تجویز میکند. همچنین ممکن است برای آزمایشات و درمان بیشتر به یک متخصص گوارش (پزشکی که بیماریهای دستگاه گوارش را درمان میکند) ارجاع داده شوید.
تستهای تصویر برداری
اسکن توموگرافی کامپیوتری (Computed tomography یا CT)
سی تی اسکن از اشعه ایکس گرفته شده از زوایای مختلف استفاده میکند که توسط کامپیوتر برای ایجاد تصاویر دقیق از اندامها ترکیب میشود. این آزمایش اغلب برای مشاهده قفسه سینه و یا شکم (abdomen) برای دیدن واضح پانکراس و اگر تومور نورواندوکرین پانکراس به غدد لنفاوی مجاور یا سایر اندامها مانند کبد گسترش یافته است، استفاده میشود. همچنین میتوان از آن برای هدایت سوزن بیوپسی به ناحیه مورد نظر استفاده کرد.
تصویربرداری رزونانس مغناطیسی (Magnetic resonance imaging یا MRI)
مانند سی تی اسکن، اسکن ام آر آی تصاویر دقیقی از بافتهای نرم بدن نشان میدهد. اما در اسکن MRI به جای اشعه ایکس از امواج رادیویی و آهنرباهای قوی استفاده میشود. رنگی به نام گادولینیوم ممکن است قبل از اسکن به داخل ورید تزریق شود تا جزئیات بهتر دیده شود. اسکن MRI گاهی اوقات میتواند گسترش سرطان به کبد را بهتر از سی تی اسکن مشاهده کند.
کلانژیوپانکراتوگرافی MR (MRCP)، نوع خاصی از اسکن MRI است که میتواند برای مشاهده مجاری پانکراس و صفراوی استفاده شود و در زیر در بخش کلانژیوپانکراتوگرافی توضیح داده شده است.
سونوگرافی (Ultrasound)
آزمایشات اولتراسوند از امواج صوتی برای ایجاد تصاویری از اندامهایی مانند پانکراس استفاده میکنند.
سونوگرافی شکم: برای این آزمایش، یک پروب گرز شکل روی پوست شکم حرکت داده میشود. امواج صوتی منتشر میکند و پژواکها را هنگام بازگشت از اندامها تشخیص میدهد. اگر مشخص نیست که چه چیزی ممکن است باعث علائم شکمی فرد شود، این ممکن است اولین آزمایشی باشد که انجام میشود زیرا انجام آن آسان است و فرد را در معرض تشعشع قرار نمیدهد.
سونوگرافی آندوسکوپی (Endoscopic ultrasound یا EUS): این آزمایش از یک آندوسکوپ با یک پروب سونوگرافی کوچک در انتهای آن استفاده میکند. سپس اسکوپ از طریق دهان یا بینی، از طریق معده به پایین و به قسمت اول روده کوچک منتقل میشود. سپس به سمت لوزالمعده که در کنار روده کوچک قرار دارد متمرکز میشود. کاوشگر روی نوک آندوسکوپ میتواند بسیار به لوزالمعده نزدیک شود، بنابراین این یک راه بسیار خوب برای نگاه کردن به آن است. در صورت مشاهده تومور، میتوان یک سوزن کوچک و توخالی را از داخل آندوسکوپ عبور داد تا نمونههای بیوپسی (نمونه برداری) از آن گرفته شود.
کلانژیوپانکراتوگرافی (Cholangiopancreatography)
این یک آزمایش تصویر برداری است که مجاری پانکراس و مجاری صفراوی را بررسی میکند تا ببیند مسدود، باریک یا متسع شده اند. این آزمایشها میتوانند نشان دهند که آیا ممکن است فردی تومور عصبی غدد پانکراس داشته باشد که مجرای آن را مسدود میکند یا خیر. آنها همچنین میتوانند برای کمک به برنامه ریزی جراحی استفاده شوند. تست را میتوان به روشهای مختلفی انجام داد که هر کدام مزایا و معایبی دارند.
کلانژیوپانکراتوگرافی رتروگراد آندوسکوپی (Endoscopic retrograde cholangiopancreatography یا ERCP): برای این آزمایش، یک آندوسکوپ (لوله ای نازک و انعطاف پذیر با یک دوربین فیلم برداری کوچک در انتهای آن) از گلو، از طریق مری و معده و به قسمت اول روده کوچک عبور داده میشود. این کار معمولاً در حالی انجام میشود که تحت دریافت آرام بخش هستید (داروی خواب آلوده کننده به شما داده میشود).
پزشک میتواند از طریق آندوسکوپ ببیند تا آمپول Vater (جایی که مجرای صفراوی مشترک به روده کوچک تخلیه میشود) را پیدا کند. پزشک یک کاتتر (یک لوله بسیار کوچک) را از طریق نوک آندوسکوپ و به داخل مجرای صفراوی مشترک هدایت میکند. سپس مقدار کمی رنگ به مجرای صفراوی مشترک تزریق میشود و عکس برداری با اشعه ایکس انجام میشود.
این رنگ مجاری صفراوی و پانکراس را مشخص میکند. اشعه ایکس میتواند تنگی یا انسداد این مجاری را نشان دهد که ممکن است به دلیل تومور نورواندوکرین پانکراس باشد. دکتری که این آزمایش را انجام میدهد همچنین میتواند یک برس کوچک را در لوله قرار دهد تا سلولها را برای بیوپسی خارج کند (به مطالب زیر مراجعه کنید).
ERCP همچنین میتواند برای قرار دادن یک استنت (لوله کوچک یا stent) در مجرای صفراوی یا پانکراس استفاده شود تا در صورتی که تومور مجاور روی آن فشار میآورد باز بماند.
کلانژیوپانکراتوگرافی رزونانس مغناطیسی (Magnetic resonance cholangiopancreatography یا MRCP): این روشی غیر تهاجمی برای بررسی مجاری پانکراس و صفراوی با استفاده از همان نوع دستگاه مورد استفاده برای اسکنهای MRI استاندارد است. برخلاف ERCP، نیازی به تزریق رنگ نیست. از آن جایی که این آزمایش غیر تهاجمی است، پزشکان اغلب از MRCP استفاده میکنند، اگر هدف فقط بررسی مجاری پانکراس و صفراوی باشد. اما این آزمایش را نمیتوان برای نمونه برداری از تومورها یا قرار دادن استنت در مجاری استفاده کرد.
کلانژیوگرافی ترانس کبدی از راه پوست (Percutaneous transhepatic cholangiography یا PTC): در این روش، پزشک یک سوزن نازک و توخالی را از طریق پوست شکم وارد مجرای صفراوی داخل کبد میکند. سپس یک رنگ از طریق سوزن تزریق میشود و در حین عبور از مجاری صفراوی و پانکراس عکس برداری با اشعه ایکس انجام میشود.
همانند ERCP، این روش همچنین میتواند برای گرفتن نمونه مایع یا بافت یا قرار دادن استنت در مجرای باز ماندن آن استفاده شود. از آن جا که تهاجمی تر است (و ممکن است باعث درد بیشتر شود)، PTC معمولاً استفاده نمیشود مگر اینکه ERCP قبلاً آزمایش شده باشد یا به دلایلی نتوان آن را انجام داد.
اسکن رادیونوکلئید (Radionuclide scans)
اسکن با استفاده از مقادیر کم رادیو اکتیویته و دوربینهای خاص میتواند در جستجوی شبکههای پانکراس مفید باشد. اگر پزشکان مطمئن نباشند که سرطان در کجای بدن قرار دارد، آنها میتوانند به یافتن تومورها کمک کنند یا به دنبال مناطق گسترش یافته سرطان بگردند.
اسکن توموگرافی گسیل پوزیترون (Positron emission tomography یا PET): برای اکثر انواع سرطان، اسکن PET از نوعی گلوکز رادیو اکتیو (قند) برای یافتن تومورها استفاده میکند. این نوع اسکن PET در یافتن کارسینومهای عصبی غدد پانکراس (NECs) با تمایز ضعیف مفید است اما نوع جدیدتری از اسکن PET، به نام Gallium-68 PET/CT Dotatate scan برای تومور نورواندوکرین پانکراس استفاده میشود.
این روش از عامل رادیواکتیو گالیوم-68 dotatate استفاده میکند که به پروتئین سوماتوستاتین روی سلولهای تومور عصبی غدد درون ریز متصل میشود. یک دوربین مخصوص میتواند رادیواکتیویته را تشخیص دهد. این اسکن PET/CT گالیوم-68 از زمانی که در سال 2016 توسط FDA تأیید شد و قادر است تومورهای عصبی غدد درون ریز را بهتر از OctreoScan (در زیر توضیح داده شده) پیدا کند، به تدریج در دسترس قرار میگیرد.
سینتی گرافی گیرنده سوماتوستاتین (SRS یا Somatostatin receptor scintigraphy یا OctreoScan): این آزمایش میتواند در یافتن NETهای پانکراس بسیار مفید باشد. این روش از دارویی به نام octreotide استفاده میکند که به رادیواکتیو ایندیوم-111 متصل شده است. اکتروتید (Octreotide) یک ماده هورمون مانند است که به سلولهای NET پانکراس میچسبد.
مقدار کمی از ماده رادیواکتیو اکتروتید به داخل ورید تزریق میشود و از طریق خون حرکت میکند و در آن جا به انواع تومورهای بسیاری از سلولهای تومور نورواندوکرین پانکراس میپیوندد (اگرچه برای انسولینوما مفید نیست).
چند ساعت پس از تزریق، میتوان از یک دوربین مخصوص برای نشان دادن محل تجمع رادیواکتیویته در بدن استفاده کرد. اسکنهای بیشتری نیز ممکن است در چند روز آینده انجام شود. همراه با نشان دادن محل تومورها، این آزمایش همچنین میتواند نشان دهد که آیا درمان با داروهای خاصی مانند اکترئوتید و لانروتاید احتمالا مفید است یا خیر.
آزمایش خون و ادرار
چندین نوع آزمایش خون و ادرار را میتوان برای کمک به تشخیص تومور نورواندوکرین پانکراس یا برای کمک به تعیین گزینههای درمانی در صورت یافتن استفاده کرد.
- آزمایش خون با بررسی سطوح برخی از هورمونهای پانکراس اغلب میتواند به تشخیص NETهای پانکراس کمک کند. ممکن است آزمایشاتی برای بررسی سطوح خونی انجام شود:
- هورمونهای ساخته شده توسط انواع مختلف سلولهای تومور نورواندوکرین پانکراس، مانند انسولین، گاسترین، گلوکاگون، سوماتوستاتین، پلی پپتید پانکراس و VIP (پپتید وازواکتیو روده ای)
- کروموگرانین A (CgA)
- گلوکز و پپتید C (برای انسولینوم)
تومورهای کارسینوئیدی: برای کارسینوئیدها، ممکن است آزمایش خون برای بررسی سروتونین که توسط بسیاری از این تومورها ساخته میشود، انجام شود.
ادرار ممکن است برای سروتونین و مواد شیمیایی مرتبط مانند 5-HIAA و 5-HTP نیز آزمایش شود.
سایر آزمایشات رایج برای جستجوی کارسینوئیدها شامل آزمایش خون برای کروموگرانین A (CgA)، انولاز اختصاصی نورون (neuron-specific enolase یا NSE)، ماده P و گاسترین است.
بسته به محل قرارگیری تومور و علائم بیمار، پزشکان ممکن است آزمایشهای خون دیگری را نیز انجام دهند.
برخی از این آزمایشها همچنین میتوانند برای نشان دادن عملکرد خوب روند درمان استفاده شوند زیرا سطوح این مواد با کوچک شدن تومورها کاهش مییابد.
بیوپسی (Biopsy)
در بسیاری از موارد، تنها راه برای اطمینان از اینکه فرد دارای نوعی NET لوزالمعده است، برداشتن سلولها از تومور و مشاهده آنها در آزمایشگاه است. این روش بیوپسی (Biopsy یا نمونه برداری) نامیده میشود. بیوپسی را میتوان به روشهای مختلف انجام داد.
بیوپسی از راه پوست (از طریق پوست): برای این آزمایش، پزشک یک سوزن نازک و توخالی را از طریق پوست روی شکم و داخل لوزالمعده وارد میکند تا یک قطعه کوچک از تومور را خارج کند. این به عنوان آسپیراسیون با سوزن ظریف (fine needle aspiration یا FNA) شناخته میشود. پزشک با استفاده از تصاویر سونوگرافی یا سی تی اسکن، سوزن را در جای خود هدایت میکند.
بیوپسی آندوسکوپی (Endoscopic biopsy): پزشکان همچنین میتوانند تومور را در طول آندوسکوپی بیوپسی کنند. پزشک یک آندوسکوپ (لوله ای نازک، منعطف با یک دوربین فیلم برداری کوچک در انتهای آن) را به گلو، پایین مری و به روده کوچک نزدیک پانکراس میفرستد. در این مرحله، پزشک میتواند از سونوگرافی آندوسکوپی (EUS) برای عبور سوزن به داخل تومور یا کلانژیوپانکراتوگرافی رتروگراد آندوسکوپی (ERCP) برای برداشتن سلولها از مجاری صفراوی یا پانکراس استفاده کند. این تستها با جزئیات بیشتر در بالا توضیح داده شده است.
بیوپسی جراحی (Surgical biopsy): در موارد نادر، بیوپسی آندوسکوپی یا بیوپسی سوزنی با هدایت CT قادر به دریافت بافت کافی برای شناسایی نوع تومور نخواهد بود. در چنین مواردی ممکن است برای برداشتن نمونه بافت به جراحی نیاز باشد. بیوپسیهای جراحی در حال حاضر بسیار کمتر از گذشته انجام میشود زیرا PNETها بیشتر با استفاده از تصویر برداری (اسکن سی تی یا ام آر آی)، تصویر برداری مبتنی بر گیرنده سوماتوستاتین، بیوپسی EUS و بررسی سطوح بیش از حد هورمونها تشخیص داده میشوند.
برخی از افراد ممکن است نیازی به بیوپسی نداشته باشند
به ندرت، اگر آزمایشهای تصویر برداری، آزمایشهای خون و تصویر برداری مبتنی بر گیرنده سوماتوستاتین نشان دهند که تومور به احتمال زیاد سرطانی است و اگر به نظر میرسد که جراحی میتواند همه را از بین ببرد، به ندرت ممکن است پزشک بیوپسی را روی فردی که تومور عصبی غدد درون ریز در پانکراس دارد انجام ندهد.
در عوض، پزشک عمل جراحی را انجام میدهد و در آن زمان میتوان سلولهای تومور را در آزمایشگاه برای تایید تشخیص بررسی کرد. در حین جراحی، اگر پزشک متوجه شود که سرطان بیش از حد گسترش یافته است که به طور کامل برداشته شود، ممکن است تنها یک نمونه از سرطان برای تایید تشخیص برداشته شود و بقیه عملیات برنامه ریزی شده ممکن است متوقف شود.
مراحل تومور نورواندوکرین پانکراس
پس از اینکه فردی مبتلا به تومور عصبی غدد پانکراس (NET) تشخیص داده شد، پزشکان سعی میکنند بفهمند که آیا سرطان گسترش یافته است یا خیر و اگر چنین است، بیماری تا کجا گسترش یافته است. این فرآیند مرحله بندی (staging) نامیده میشود. مرحله سرطان، میزان سرطان در بدن را توصیف میکند. این کار به تعیین اینکه سرطان چقدر جدی است و بهترین روش درمان آن کمک میکند. پزشکان همچنین هنگام صحبت در مورد آمار بقا و زنده مانی از مرحله سرطان استفاده میکنند.
مراحل تومور نورواندوکرین پانکراس از I (1) تا IV (4) متغیر است. به عنوان یک قاعده، هر چه مرحله پایین تر باشد، سرطان کمتر گسترش یافته است. عدد بالاتر، مانند مرحله IV، به معنای گسترش بیشتر سرطان است. اگرچه تجربه سرطان هر فرد منحصر به فرد است اما سرطانهایی که مراحل مشابهی دارند، چشم انداز مشابهی دارند و اغلب به روشی مشابهی نیز درمان میشوند.
مرحله چگونه تعیین میشود؟
سیستم مرحله بندی که اغلب برای شبکههای پانکراس استفاده میشود، سیستم TNM کمیته مشترک آمریکایی سرطان (American Joint Committee on Cancer یا AJCC) است که بر اساس 3 اطلاعات کلیدی است:
- اندازه و وسعت تومور اصلی (T): اندازه تومور چقدر است؟ آیا به ساختارها یا اندامهای مجاور رشد کرده است؟
- گسترش به غدد لنفاوی مجاور (N): آیا سرطان به غدد لنفاوی مجاور سرایت کرده است؟
- گسترش (متاستاز) به نقاط دور دست (M): آیا سرطان به اندامهای دور گسترش یافته است؟ (شایع ترین محل انتشار کبد است.)
اعداد یا حروف بعد از T، N و M جزئیات بیشتری در مورد هر یک از این عوامل ارائه میدهند. اعداد بالاتر به معنای پیشرفته تر بودن سرطان است. هنگامی که دسته بندیهای T، N و M یک فرد مشخص شد، این اطلاعات در فرآیندی به نام گروه بندی مرحله ای (stage grouping) با یکدیگر ترکیب میشوند تا یک مرحله کلی را تعیین کنند. برای اطلاعات بیشتر به مرحله بندی سرطان مراجعه کنید.
سیستم توضیح داده شده در زیر جدید ترین نسخه سیستم AJCC است که از ژانویه 2018 قابل اجرا است. این سیستم برای مرحله بندی NETهای پانکراس با تمایز خوب استفاده میشود اما برای NETهای پانکراس با درجه بالا (معروف به سرطان غدد عصبی) یا سایر انواع سرطان پانکراس که سیستم مرحله بندی خاص خود را دارند، استفاده نمیشود.
NETهای پانکراس معمولاً یک مرحله بالینی (clinical stage) بر اساس نتایج یک معاینه فیزیکی، بیوپسی و تستهای تصویر برداری (همان طور که در مبحث تستهای تومور نورواندوکرین پانکراس توضیح داده شده است) داده میشود.
اگر جراحی انجام شود، مرحله پاتولوژیک (pathologic stage، که مرحله جراحی نیز نامیده میشود) با بررسی بافت برداشته شده در حین عمل تعیین میشود.
مرحله بندی برای تومور نورواندوکرین پانکراس میتواند پیچیده باشد. اگر در مورد مرحله سرطان یا معنی آن سؤالی دارید، لطفاً از پزشک خود بخواهید تا آن را به گونه ای که شما درک میکنید برایتان توضیح دهد.
سایر عوامل پیش بینی کننده وضعیت آتی بیمار (prognostic factors)
اگرچه به طور رسمی بخشی از سیستم TNM نیست، عوامل دیگری نیز میتوانند در تعیین پیش آگهی (چشم انداز) یک فرد مهم باشند.
درجه تومور
درجه نشان میدهد که سرطان با چه سرعتی احتمال رشد و گسترش دارد. برای تومور نورواندوکرین پانکراس، درجه بخش مهمی از درجه بندی، اندازه گیری تعداد سلولها در فرآیند تقسیم به سلولهای جدید است. درجه توسط موارد زیر تعیین میگردد:
- شمارش میتوز (mitotic count) که تعداد سلولهایی است که در زیر میکروسکوپ دیده میشوند و در حال تقسیم شدن به دو سلول جدید (میتوز) هستند.
- شاخص Ki-67، که اندازه گیری بخشی از سلولهایی است که تقریباً آماده شروع تقسیم هستند.
بر اساس این تستها، NETها به 2 گروه اصلی تقسیم میشوند:
- تومورهای خوب تمایز یافته (که شامل تومورهای درجه پایین [G1] و درجه متوسط [G2] میشوند) دارای 20 میتوز یا کمتر و شاخص Ki-67 بیست درصدی یا کمتر میباشند.
- تومورهای با تمایز ضعیف (تومورهای درجه بالا [G3]) بیش از 20 میتوز یا شاخص Ki-67 بیش از 20 درصد دارند. به این کارسینومهای عصبی غدد درون ریز (NECs) نیز گفته میشود و اغلب به سرعت رشد و گسترش مییابند.
عملکرد تومور
چشم انداز تومور نورواندوکرین پانکراس میتواند تحت تأثیر عملکرد تومور (ساخت هورمونها) یا عدم کارکرد آن باشد. برای تومورهای فعال، نوع هورمون نیز میتواند مهم باشد. به عنوان مثال، انسولینومها (NETهایی که انسولین میسازند) نسبت به سایر انواع NETها خطر انتشار کمتری دارند.
میزان بقا و زنده مانی برای تومور نورواندوکرین پانکراس
میزان بقا میتواند به شما این ایده را بدهد که چند درصد از افراد مبتلا به همان نوع و مرحله سرطان تا مدت معینی (معمولاً 5 سال) پس از تشخیص هنوز زنده هستند. این اعداد نمیتوانند به شما بگویند که چقدر زنده خواهید ماند اما ممکن است به شما کمک کنند تا درک بهتری از احتمال موفقیت روند درمانی خود داشته باشید.
به خاطر داشته باشید که میزان بقا تخمینی است و اغلب بر اساس نتایج قبلی تعداد زیادی از افرادی است که سرطان خاصی داشتند اما آنها نمیتوانند پیش بینی کنند که در مورد فرد خاصی چه اتفاقی خواهد افتاد. این آمار میتواند گیج کننده باشد و ممکن است شما را به پرسیدن سوالات بیشتری سوق دهد. پزشک شما با وضعیت شما آشناست. از وی بپرسید چگونه این اعداد ممکن است برای شما اعمال شوند.
نرخ بقای نسبی 5 ساله چیست؟
نرخ بقای نسبی، افراد مبتلا به همان نوع و مرحله تومور نورواندوکرین پانکراس (NET) را با افراد موجود در کل جمعیت مقایسه میکند. به عنوان مثال، اگر نرخ بقای نسبی 5 ساله برای نوع و مرحله خاصی از تومور نورواندوکرین پانکراس 90 درصد باشد، این عدد به این معنی است که احتمال زنده ماندن این افراد برای 5سال آینده پس از تشخیص نسبت به افراد سالم و غیر بیمار به طور متوسط حدود 90 درصد است.
این اعداد از کجا میآیند؟
انجمن سرطان آمریکا به اطلاعات پایگاه داده SEER* که توسط موسسه ملی سرطان (National Cancer Institute یا NCI) نگهداری میشود، برای ارائه آمار بقای انواع مختلف سرطان متکی است.
پایگاه داده SEER نرخ بقای نسبی 5 ساله پانکراس NET در ایالات متحده را بر اساس میزان گسترش سرطان دنبال میکند. با این حال، پایگاه داده SEER سرطانها را بر اساس مراحل AJCC TNM (مرحله 1، مرحله 2، مرحله 3 و غیره) گروه بندی نمیکند. در عوض، سرطانها را به مراحل موضعی، منطقه ای و دور دسته بندی میکند:
- موضعی (Localized): هیچ علامتی وجود ندارد که سرطان در خارج از پانکراس رشد کرده است.
- منطقه ای (Regional): سرطان در خارج از پانکراس به بافتهای مجاور رشد کرده یا به غدد لنفاوی مجاور گسترش یافته است.
- دور (Distant): سرطان به نقاط دورتر بدن مانند ریهها، کبد یا استخوانها گسترش یافته است.
نرخ بقای نسبی 5 ساله برای تومور نورواندوکرین پانکراس
(این اعداد بر اساس اطلاعات افرادی است که بین سالهای 2011 تا 2017 مبتلا به NET پانکراس تشخیص داده شده است.)
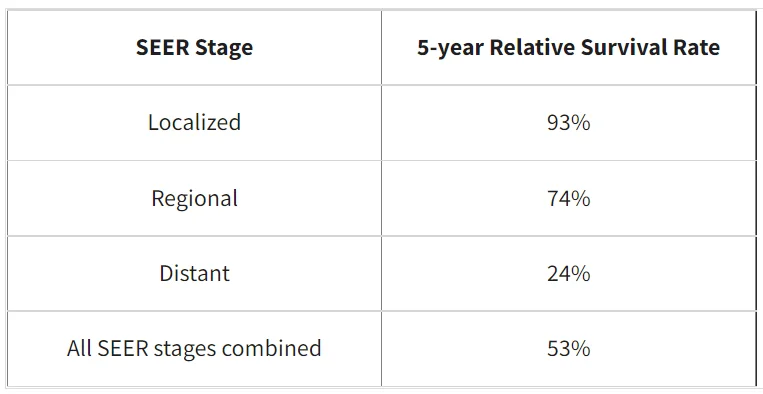
درک اعداد
- این اعداد فقط برای مرحله سرطان در هنگام اولین تشخیص صدق میکند. اگر سرطان رشد کند، گسترش یابد یا پس از درمان عود کند، بعداً اعمال نمیشوند.
- این اعداد همه چیز را در نظر نمیگیرند. میزان بقا بر اساس میزان گسترش سرطان گروه بندی میشود اما سن شما، سلامت کلی، میزان واکنش سرطان به درمان، درجه تومور، عملکرد تومور و سایر عوامل نیز میتوانند بر دیدگاه شما تأثیر بگذارند.
- افرادی که اکنون مبتلا به تومور نورواندوکرین پانکراس تشخیص داده میشوند، ممکن است چشم انداز بهتری نسبت به این اعداد داشته باشند. روشهای درمانی با گذشت زمان بهبود مییابند و این اعداد بر اساس افرادی است که حداقل پنج سال زودتر تشخیص داده شده و درمان شده اند.
*SEER= نظارت، اپیدمیولوژی و نتایج نهایی
جراحی (surgery) تومور نورواندوکرین پانکراس
دو نوع جراحی کلی را میتوان برای تومورهای عصبی غدد پانکراس (NETs) استفاده کرد:
- جراحی بالقوه درمانی (Potentially curative surgery) زمانی استفاده میشود که نتایج معاینات و آزمایشها حاکی از امکان حذف (رزکسیون یا resect) همه سرطان باشد.
- اگر آزمایشهای تصویر برداری نشان دهند که سرطان بسیار گسترده است و نمیتوان به طور کامل برداشته شود، ممکن است جراحی تسکینی (Palliative surgery) انجام شود. این جراحی برای کاهش اندازه تومور برای تسکین علائم ناشی از تولید بیش از حد هورمون یا جلوگیری از عوارض خاصی مانند مسدود شدن مجرای صفراوی یا روده انجام میشود. هدف، تلاش برای درمان سرطان نیست.
قبل از انجام هر عمل جراحی، درمان و کنترل علائم ناشی از تولید بیش از حد هورمون بسیار مهم است. این کار ممکن است با شروع داروهای آنالوگ سوماتوستاتین یا سایر داروها انجام شود.
لاپاراسکوپی (Laparoscopy) برای مرحله بندی سرطان
برای تعیین اینکه کدام نوع جراحی ممکن است بهترین باشد، دانستن مرحله (وسعت) سرطان مهم است. گاهی اوقات تنها با استفاده از تستهای تصویر برداری، مرحله بندی دقیق تومور نورواندوکرین پانکراس دشوار است. لاپاراسکوپی اکتشافی (Exploratory laparoscopy) ممکن است ابتدا برای کمک به تعیین وسعت سرطان و امکان برداشتن آن انجام شود.
برای این روش، جراح چند برش (cuts) کوچک در شکم (belly) ایجاد کرده و ابزار بلند و نازکی را وارد میکند. یکی از اینها یک دوربین فیلم برداری کوچک در انتهای آن دارد تا جراح بتواند داخل شکم را ببیند. جراح میتواند به لوزالمعده و سایر اندامهای تومور نگاه کند و از نواحی غیر طبیعی نمونه برداری کند تا بفهمد سرطان تا چه اندازه گسترش یافته است.
جراحی بالقوه درمانی (Potentially curative surgery)
NETهای پانکراس که در خارج از پانکراس پخش نشده اند، در صورت امکان باید به طور کامل برداشته شوند زیرا احتمال بهبودی این تومورها با جراحی بیشتر است. با این حال، گاهی اوقات، پس از شروع عمل جراحی، مشخص میشود که سرطان بیش از حد رشد کرده است تا به طور کامل خارج شود.
اگر این اتفاق بیفتد، ممکن است عمل متوقف شود یا جراح ممکن است با یک عمل کوچکتر برای کمک به پیشگیری یا تسکین علائم ادامه دهد. (به مبحث «جراحی تسکینی یا Palliative surgery» در زیر مراجعه کنید.) این به این دلیل است که عمل برنامه ریزی شده برای درمان سرطان بسیار بعید است و همچنان میتواند منجر به عوارض جانبی عمده شود. همچنین زمان بهبودی را طولانیتر میکند که میتواند سایر دورههای درمانی را به تأخیر بیندازد.
بسیاری از این نوع جراحیها پیچیده هستند و میتوانند برای بیماران بسیار سخت باشند. آنها میتوانند عوارضی را ایجاد کنند که ممکن است هفتهها یا ماهها طول بکشد تا بهبودی کامل پیدا کنند. اگر به انجام این نوع جراحی فکر میکنید، مهم است که مزایا و خطرات احتمالی را به دقت بسنجید.
انواع جراحی بالقوه درمانی عبارتند از انوکلئاسیون (فقط برداشتن تومور یا enucleation)، پانکراتکتومی مرکزی (central pancreatectomy)، پانکراتکتومی دیستال (distal pancreatectomy)، روش ویپل (پانکراتیکودئودنکتومی یا pancreaticoduodenectomy) و پانکراتکتومی کامل (total pancreatectomy). نوع جراحی مورد نیاز به عوامل مختلفی بستگی دارد، از جمله محل، اندازه و نوع خاص تومور نورواندوکرین پانکراس (عملکردی یا غیر عملکردی).
انوکلئولاسیون (فقط برداشتن تومور یا Enucleation)
گاهی اوقات اگر NET پانکراس کوچک باشد، فقط خود تومور برداشته میشود. به این هسته زدایی (enucleation) میگویند. این عمل ممکن است با استفاده از لاپاراسکوپ انجام شود، به طوری که تنها به چند بریدگی کوچک روی شکم نیاز است.
این عمل ممکن است تمام چیزی باشد که برای درمان انسولینوم لازم است. گاسترینومای کوچک و برخی دیگر از نتهای پانکراس نیز ممکن است با انوکلئاسیون درمان شوند اما گاهی اوقات اثنی عشر (اولین قسمت روده کوچک) نیز برداشته میشود.
غدد لنفاوی اطراف پانکراس نیز ممکن است برداشته شوند تا بتوان آنها را برای وجود سلولهای سرطانی بررسی کرد.
پانکراتکتومی مرکزی (Central pancreatectomy)
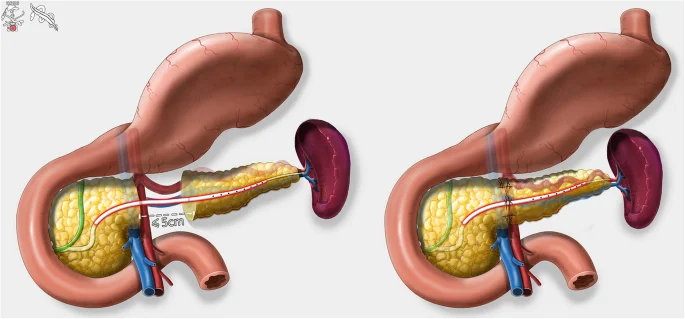
پانکراتکتومی مرکزی برای درمان تومورهای کوچک و درجه پایین استفاده میشود. برای این عمل جراحی تنها گردن و قسمتی از بدن پانکراس را برمیدارند و سر و دم را سالم نگه میدارند. این کار به حفظ بیشتر عملکرد پانکراس کمک میکند.
پانکراتکتومی دیستال (Distal pancreatectomy)
پانکراتکتومی دیستال برای درمان تومور نورواندوکرین پانکراس که در دم و بدن پانکراس یافت میشوند، استفاده میشود. در این عمل جراحی فقط دم پانکراس یا دم و قسمتی از بدن پانکراس را برمیدارند. معمولا طحال (spleen) نیز برداشته میشود.
طحال به بدن کمک میکند تا با عفونتها مبارزه کند، بنابراین اگر حذف شود، در معرض خطر عفونت با باکتریهای خاص قرار خواهید داشت. برای کمک به این امر، پزشکان توصیه میکنند که بیماران قبل از این جراحی واکسنهای خاصی را دریافت کنند.
روش ویپل (پانکراتیکودئودنکتومی یا pancreaticoduodenectomy)
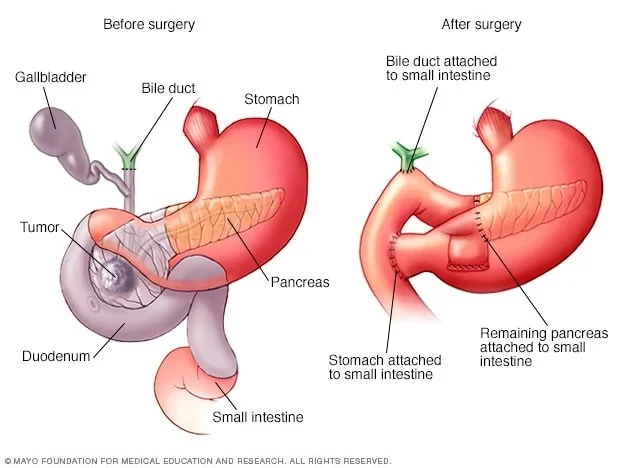
روش Whipple برای درمان تومور نورواندوکرین پانکراس که در سر لوزالمعده یافت میشوند، استفاده میشود. در این عمل جراح سر لوزالمعده و گاهی بدن پانکراس را نیز برمیدارد.
ساختارهای مجاور مانند بخشی از روده کوچک، بخشی از مجرای صفراوی، کیسه صفرا، غدد لنفاوی نزدیک پانکراس و گاهی بخشی از معده نیز برداشته میشوند. سپس مجرای صفراوی و لوزالمعده باقی مانده به روده کوچک متصل میشوند تا صفرا و آنزیمهای گوارشی همچنان بتوانند وارد روده کوچک شوند. سپس تکههای روده کوچک (یا معده و روده کوچک) دوباره به هم متصل میشوند تا غذا بتواند از دستگاه گوارش عبور کند.
اغلب این عمل از طریق یک برش بزرگ (incision) در وسط شکم انجام میشود. برخی از پزشکان در مراکز اصلی سرطان نیز این عمل را به روش لاپاروسکوپی انجام میدهند، که گاهی به عنوان جراحی سوراخ کلید (keyhole surgery) شناخته میشود.
این یک عمل بسیار پیچیده است که به جراح با مهارت و تجربه زیادی نیاز دارد. خطر نسبتاً بالایی از عوارض دارد که میتواند زندگی را تهدید کند. هنگامی که این عمل در بیمارستانهای کوچک یا توسط پزشکان با تجربه کمتر انجام میشود، ممکن است 15 درصد از بیماران در نتیجه عوارض جراحی فوت کنند. در مقابل، زمانی که عمل در مراکز سرطان توسط جراحان مجرب در این روش انجام میشود، کمتر از 5 درصد بیماران در نتیجه مستقیم جراحی جان خود را از دست میدهند.
برای داشتن بهترین نتیجه، درمان توسط جراحی که بسیاری از این عملها را انجام میدهد و انجام جراحی در بیمارستانی که بسیاری از آنها در آن جا انجام میشود، مهم است. به طور کلی، افرادی که این نوع جراحی را انجام میدهند، زمانی بهتر عمل میشوند که عمل جراحی در بیمارستانی انجام شود که در آن حداقل 15 تا 20 عمل ویپل در سال انجام میشود.
با این حال، حتی در بهترین شرایط، بسیاری از بیماران عوارض جراحی دارند. این موارد میتواند شامل موارد زیر باشد:
- نشت از اتصالات مختلف بین اندامهایی که جراح آنها را به هم وصل کرده است.
- عفونتها
- خون ریزی
- مشکل در تخلیه معده بعد از غذا خوردن
- مشکل در هضم برخی غذاها (که ممکن است فرد به مصرف آنزیمهای لوزالمعده به شکل قرص برای کمک به هضم نیاز داشته باشد)
- کاهش وزن
- تغییر در عادات روده
- دیابت
پانکراتکتومی کامل (Total pancreatectomy)
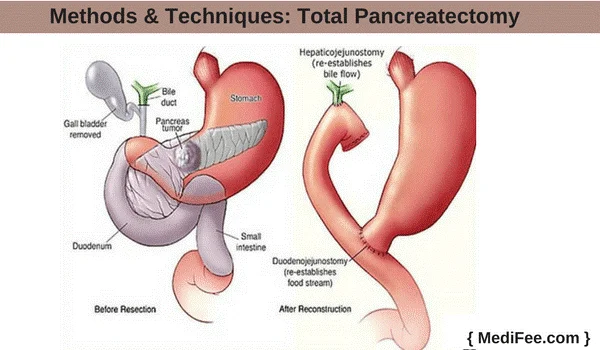
پانکراتکتومی کامل ممکن است یک گزینه باشد اگر سرطان در سراسر پانکراس پخش شده باشد اما هنوز بتوان آن را برداشت. این عمل کل لوزالمعده و همچنین کیسه صفرا، بخشی از معده و روده کوچک و طحال را از بین میبرد. اما این نوع جراحی کمتر از سایر عملها استفاده میشود زیرا به نظر میرسد مزیت عمدهای در برداشتن کل پانکراس وجود ندارد و میتواند عوارض جانبی بزرگی داشته باشد.
زندگی بدون پانکراس امکان پذیر است. اما وقتی کل لوزالمعده برداشته میشود، افراد بدون سلولهای سازنده انسولین و سایر هورمونهایی میمانند که به حفظ سطح ایمن قند خون کمک میکنند. این افراد به دیابت مبتلا میشوند که کنترل آن دشوار است زیرا کاملاً به تزریق انسولین وابسته هستند. افرادی که این جراحی را انجام داده اند نیز باید از قرصهای آنزیم پانکراس برای کمک به هضم برخی غذاها استفاده کنند.
قبل از انجام این عمل، پزشک توصیه میکند که واکسنهای خاصی را دریافت کنید زیرا طحال نیز برداشته میشود.
جراحی تسکینی (Palliative surgery)
اگر سرطان بیش از حد گسترش یافته باشد که به طور کامل برداشته شود، هر جراحی در نظر گرفته شده تسکینی خواهد بود (به منظور تسکین علائم). این نوع جراحی ممکن است در برخی از افراد مبتلا به تومور نورواندوکرین پانکراس که تومور آنها عود کرده و مشکلات موضعی ایجاد میکند یا هورمونهای زیادی ایجاد میکند که باعث ایجاد علائم میشوند در نظر گرفته شود.
گاهی اوقات ممکن است جراحی با این امید شروع شود که بیمار را درمان کند اما پس از شروع، جراح متوجه میشود که این هدف امکان پذیر نیست. در این مورد، جراح ممکن است یک عمل تسکینی کم وسعتتر را انجام دهد که به عنوان جراحی بای پس (bypass surgery) شناخته میشود تا به پیشگیری یا تسکین علائم کمک کند.
سرطانهایی که در سر لوزالمعده رشد میکنند میتوانند مجرای صفراوی مشترک را هنگام عبور از این قسمت از پانکراس مسدود کنند. این امر میتواند باعث درد و مشکلات گوارشی شود زیرا صفرا نمیتواند وارد روده شود. مواد شیمیایی صفرا نیز در بدن تجمع مییابند که میتواند باعث زردی، حالت تهوع، استفراغ و سایر مشکلات شود.
2 گزینه اصلی برای رفع انسداد مجرای صفراوی وجود دارد: استنت گذاری و جراحی بای پس.
استنت گذاری (Stent placement)
متداول ترین روش برای تسکین مجرای صفراوی مسدود شده شامل جراحی واقعی نیست. در عوض، یک استنت (لوله کوچک، معمولاً از جنس فلز) در داخل مجرا قرار داده میشود تا آن را باز نگه دارد. این کار معمولاً از طریق یک آندوسکوپ (لوله بلند و انعطاف پذیر) در حالی که تحت دریافت آرام بخش هستید انجام میشود. اغلب این کار بخشی از کلانژیوپانکراتوگرافی رتروگراد آندوسکوپی (ERCP) است.
پزشک آندوسکوپ را از گلو و تا انتهای روده کوچک عبور میدهد. سپس پزشک میتواند استنت را از طریق آندوسکوپ وارد مجرای صفراوی کند. استنت همچنین میتواند از طریق پوست در طول کلانژیوگرافی از راه کبد (PTC) در محل قرار گیرد.
استنت به باز نگه داشتن مجرای صفراوی کمک میکند حتی اگر سرطان اطراف آن را تحت فشار قرار دهد. اما پس از چند ماه، ممکن است استنت مسدود شود و ممکن است نیاز به پاکسازی یا تعویض داشته باشد. همچنین میتوان از استنتهای بزرگتر برای باز نگه داشتن قسمتهایی از روده کوچک در صورت خطر انسداد توسط سرطان استفاده کرد.
استنت مجرای صفراوی را نیز میتوان برای کمک به تسکین زردی قبل از انجام جراحی درمانی (که معمولاً چند هفته بعد انجام میشود) قرار داد. این کار میتواند به کاهش خطر عوارض ناشی از جراحی کمک کند.
عمل جراحی بای پس (Bypass surgery)
در افرادی که به اندازه کافی سالم هستند، گزینه دیگری برای تسکین مجرای صفراوی مسدود شده، جراحی برای تغییر مسیر جریان صفرا از مجرای صفراوی مشترک به طور مستقیم به روده کوچک و دور زدن پانکراس است. این کار به طور معمول نیاز به یک برش (cut) بزرگ در شکم دارد و ممکن است هفتهها طول بکشد تا بهبودی حاصل شود. گاهی اوقات میتوان جراحی را از طریق چندین بریدگی کوچک در شکم با استفاده از ابزارهای جراحی بلند خاص انجام داد. (این روش به عنوان جراحی لاپاراسکوپی یا سوراخ کلید شناخته میشود.)
قرار دادن استنت اغلب آسانتر و بهبودی بسیار کوتاهتر است، به همین دلیل است که این کار بیشتر از جراحی بای پس انجام میشود. اما این جراحی میتواند مزایایی داشته باشد:
- اغلب میتواند دوره تسکین طولانی تری نسبت به استنت داشته باشد که ممکن است نیاز به تمیز کردن یا تعویض داشته باشد.
- اگر بنا به دلایلی نتوان استنت گذاشت، ممکن است یک گزینه باشد.
- در طول جراحی، جراح ممکن است بتواند برخی از اعصاب اطراف پانکراس را قطع کند یا الکل به آنها تزریق کند. این کار ممکن است درد ناشی از سرطان را کاهش داده یا شما را از شر آن خلاص کند.
گاهی اوقات انتهای معده از اثنی عشر (نخستین قسمت روده باریک) جدا میشود و در طول این عمل جراحی در نواحی دورتر به پایین روده کوچک متصل میشود. (این روش به عنوان بای پس معده یا gastric bypass شناخته میشود.) این کار به این دلیل انجام میشود که با گذشت زمان سرطان ممکن است به اندازه ای بزرگ شود که دوازدهه را مسدود کند که میتواند باعث درد و استفراغ شود و اغلب به جراحی فوری نیاز دارد. دور زدن دوازدهه قبل از این اتفاق گاهی اوقات میتواند به جلوگیری از بروز آن کمک کند.
جراحی بای پس هنوز هم میتواند یک عمل بزرگ باشد، بنابراین مهم است که به اندازه کافی سالم باشید تا در مقابل آن مقاومت کنید و قبل از انجام جراحی با پزشک خود در مورد مزایا و خطرات احتمالی صحبت کنید.
جراحی برای سرطانی که گسترش یافته است:
اگر NET پانکراس به کبد (شایع ترین محل انتشار) یا ریهها گسترش یافته باشد، ممکن است برای حذف متاستازها از جراحی استفاده شود. از بین بردن متاستازها با جراحی میتواند علائم را بهبود بخشد و به بیماران مبتلا به NETهای پانکراس کمک کند تا عمر طولانی تری داشته باشند. در موارد نادر، پیوند کبد ممکن است برای درمان NETهای پانکراس که به کبد گسترش یافته اند، استفاده شود.
روشهای درمانی ابلیشن (Ablation) یا آمبولیزاسیون (Embolization) برای تومور نورواندوکرین پانکراس
درمانهای ابلیشن و آمبولیزاسیون روشهای مختلفی برای از بین بردن تومورها هستند، نه از بین بردن آنها با جراحی.
چه زمانی ممکن است یکی از این روشهای درمانی استفاده شوند؟
گاهی اوقات میتوان از ابلیشن یا آمبولیزاسیون برای کمک به درمان تومور نورواندوکرین پانکراس (NET) که به سایر اندامها، به ویژه کبد گسترش یافته است، استفاده کرد. هنگامی که تومور نورواندوکرین پانکراس به سایر نقاط گسترش یافته اند، این درمانها اغلب میتوانند اندازه تومور را کاهش داده و علائم را بهبود بخشند. اما بعید است که این درمانها به تنهایی سرطانها را معالجه کنند. آنها بیشتر برای کمک به پیشگیری یا تسکین علائم استفاده میشوند و اغلب همراه با انواع دیگر روشهای درمانی استفاده میشوند.
درمانهای ابلیشنی یا فرسایش (Ablative treatments یا ablation)
فرسایش (Ablation) به درمانهایی گفته میشود که تومورها را معمولاً با گرما یا سرمای شدید از بین میبرند. آنها به طور کلی برای تومورهایی با عرض بیش از 2 سانتی متر (کمی کمتر از یک اینچ) بهترین هستند. انواع مختلفی از درمانهای فرسایشی وجود دارد:
- فرسایش با فرکانس رادیویی (Radiofrequency ablation یا RFA) از امواج رادیویی با انرژی بالا استفاده میکند. یک کاوشگر نازک سوزن مانند از طریق پوست وارد و داخل تومور قرار میگیرد. قرار دادن پروب توسط سونوگرافی یا سی تی اسکن هدایت میشود. نوک پروب یک جریان الکتریکی با فرکانس بالا آزاد میکند که تومور را گرم میکند و سلولهای سرطانی را از بین میبرد.
- حرارت درمانی با مایکروویو (Microwave thermotherapy) مشابه RFA است با این تفاوت که از امواج مایکروویو برای گرم کردن و از بین بردن سلولهای سرطانی استفاده میکند.
- فرسایش اتانولی (الکلی یا Ethanol ablation) (همچنین به عنوان تزریق اتانول از راه پوست یا percutaneous ethanol injection شناخته میشود) سلولهای سرطانی را با الکل غلیظی که مستقیماً به تومور تزریق میشود، از بین میبرد. این کار معمولاً با استفاده از یک سوزن از طریق پوست انجام میشود که توسط سونوگرافی یا سی تی اسکن هدایت میشود.
- کرایوسرجری (Cryosurgery، همچنین به عنوان کرایوتراپی یا کرایوآبلیشن یا cryoablation نیز شناخته میشود) تومور را با انجماد آن با یک پروب فلزی نازک از بین میبرد. پروب با استفاده از سونوگرافی از طریق پوست وارد و به داخل تومور هدایت میشود. سپس گازهای بسیار سردی از طریق پروب عبور داده میشود تا تومور منجمد شود و سلولهای سرطانی از بین بروند. این روش ممکن است برای درمان تومورهای بزرگتر از سایر تکنیکهای فرسایش استفاده شود اما گاهی اوقات نیاز به بیهوشی عمومی (حالتی که شما در خواب هستید) دارد.

عوارض جانبی درمانهای فرسایشی
عوارض جانبی احتمالی پس از درمان فرسایشی شامل درد شکمی، عفونت و خونریزی در داخل بدن است. عوارض جدی غیر معمول هستند اما ممکن است رخ دهند.
آمبولیزاسیون (Embolization)
در طول آمبولیزاسیون، موادی به داخل شریان تزریق میشوند تا جریان خون را به سلولهای سرطانی مسدود کنند و باعث مرگ آنها شوند. این روش ممکن است برای تومورهای بزرگتر (تا عرض 5 سانتی متر یا 2 اینچ) در کبد استفاده شود.
3 نوع اصلی آمبولیزاسیون وجود دارد:
- آمبولیزاسیون شریانی (Arterial embolization، همچنین به عنوان آمبولیزاسیون ترانس شریانی یا trans-arterial embolization یا TAE شناخته میشود) شامل قرار دادن یک کاتتر (catheter، یک لوله نازک و انعطاف پذیر) در یک شریان از طریق یک بریدگی کوچک در قسمت داخلی ران و کشیدن آن به داخل شریان کبدی تغذیه کننده تومور است. جریان خون با تزریق مواد برای مسدود کردن آن شریان مسدود میشود (یا کاهش مییابد). بیشتر سلولهای سالم کبد تحت تأثیر قرار نمیگیرند زیرا خون خود را از یک رگ خونی متفاوت، یعنی سیاهرگ باب (portal vein)، تامین میکنند.
- آمبولیزاسیون شیمیایی (Chemoembolization، همچنین به عنوان کموامبولیزاسیون ترانس شریانی یا trans-arterial chemoembolization یا TACE نیز شناخته میشود) آمبولیزاسیون را با شیمی درمانی ترکیب میکند. بیشتر اوقات، این کار با استفاده از دانههای ریزی انجام میشود که داروی شیمی درمانی را در طول آمبولیزاسیون ترشح میکنند. TACE همچنین میتواند با شیمی درمانی از طریق کاتتر به طور مستقیم در شریان انجام شود و سپس شریان را مسدود کند.
- رادیوامبولیزاسیون (Radioembolization)، آمبولیزاسیون را با پرتو درمانی ترکیب میکند. در ایالات متحده، این کار با تزریق دانههای کوچک رادیو اکتیو (به نام میکروسفرها یا microsphere) به شریان کبدی انجام میشود. دانهها در رگهای خونی نزدیک تومور قرار میگیرند، جایی که مقدار کمی تابش را به مدت چند روز به محل تومور میتابند. از آن جایی که تابش مسافت بسیار کوتاهی را طی میکند، اثرات آن عمدتاً به تومور محدود میشود.
عوارض آمبولیزاسیون
عوارض احتمالی پس از آمبولیزاسیون شامل درد شکمی، تب، حالت تهوع، عفونت و لخته شدن خون در رگهای خونی مجاور است. عوارض جدی شایع نیستند اما ممکن است، رخ دهند.
پرتو درمانی (Radiation therapy) برای تومور نورواندوکرین پانکراس
پرتو درمانی از پرتوهای پر انرژی (مانند اشعه ایکس) یا ذرات رادیو اکتیو برای از بین بردن سلولهای سرطانی استفاده میکند.
جراحی روش درمانی اصلی برای اکثر تومورهای عصبی غدد پانکراس (NETs) است، اما پرتو درمانی ممکن است گزینه مناسبی برای کسانی باشد که به دلایلی نمیتوانند جراحی کنند.
همچنین ممکن است این دوره در برخی موارد پس از عمل جراحی داده شود، اگر این احتمال وجود داشته باشد که برخی از تومورها برداشته نشده اند و ممکن است مشکلاتی را ایجاد کنند. گاهی اوقات از پرتو درمانی برای درمان تومورهای پانکراس که به استخوان گسترش یافته و باعث درد میشوند، استفاده میشود. همچنین ممکن است به شکل رادیوامبولیزاسیون برای درمان NETهایی که به کبد گسترش یافته اند، استفاده شود. (به مبحث روشهای درمانی ابلیشن یا آمبولیزاسیون برای تومور نورواندوکرین پانکراس مراجعه کنید.)
پرتو درمانی خارجی (External beam radiation therapy)
پرتو درمانی خارجی از دستگاهی استفاده میکند که پرتو را به قسمت خاصی از بدن میرساند.
قبل از شروع روند درمان، تیم پرتو درمانی زوایای صحیح برای هدف گیری پرتوهای تشعشعی و دوز مناسب تابش را تعیین میکنند. روند درمان بسیار شبیه به عکس برداری با اشعه ایکس است اما تابش قوی تر است.
این روش به خودی خود بدون درد است. هر جلسه درمانی فقط چند دقیقه طول میکشد، اگرچه زمان تنظیم – قرار دادن شما در محل و موقعیت مناسب برای روند درمانی – معمولاً بیشتر طول میکشد. اغلب، پرتو درمانی 5 روز در هفته و به مدت چند هفته انجام میشود اما این موضوع ممکن است بر اساس دلیلی که انجام میشود، متفاوت باشد.
برخی از عوارض جانبی رایج پرتو درمانی عبارتند از:
- تغییرات پوستی در نواحی تحت تابش، از قرمزی گرفته تا تاول و پوسته پوسته شدن
- تهوع و استفراغ
- اسهال
- خستگی
- از دست دادن اشتها
- کاهش وزن
- شمارش خون پایین که میتواند خطر عفونت جدی را افزایش دهد.
معمولاً این عوارض در عرض چند هفته پس از اتمام روند درمان از بین میروند. از پزشک خود بپرسید که چه عوارض جانبی را باید انتظار داشت و چگونه میتوان از آنها پیشگیری کرد یا آنها را تسکین داد.
داروهای رادیو اکتیو
رادیوامبولیزاسیون (Radioembolization)
رادیوامبولیزاسیون آمبولیزاسیون را با پرتو درمانی ترکیب میکند و میتواند برای درمان متاستازهای کبدی استفاده شود. دانههای کوچکی به نام میکروسفر به یک عنصر رادیواکتیو به نام ایتریوم-90 (یا 90Y) متصل شده و سپس به شریان نزدیک به کبد تزریق میشوند. مهرهها در رگهای خونی کبد حرکت میکنند تا زمانی که در رگهای خونی کوچک نزدیک تومور گیر کنند. در آن جا برای مدت کوتاهی رادیواکتیویته منتشر میکنند و سلولهای توموری مجاور را میکشند. تابش مسافت بسیار کوتاهی را طی میکند، بنابراین اثرات آن عمدتاً به تومور محدود میشود.
درمان با رادیونوکلئید گیرنده پپتیدی (Peptide receptor radionuclide therapy یا PRRT)
افراد مبتلا به تومورهای عصبی غدد درون ریز با گیرنده سوماتوستاتین ممکن است کاندیدای PRRT باشند. در PRRT، یک عنصر رادیواکتیو به بخش کوچکی (پپتید) آنالوگ سوماتوستاتین متصل شده و به ورید بازو تزریق میشود. این دارو در سراسر بدن حرکت میکند، به گیرنده سوماتواستاتین (پروتئینی) روی سلول سرطانی متصل میشود و برای از بین بردن آن پرتو میدهد. تابش مستقیماً به تومور میرسد، بنابراین تأثیر کمتری بر بافت سالم دارد. چندین دارو وجود دارد که ممکن است مورد استفاده قرار گیرد:
- عنصر رادیواکتیو ایتریوم-90
- عنصر رادیواکتیو Lutathera (لوتسیم یا Lu-177 dotatate)
اگر در حال حاضر اکترئوتید (octreotide) یا لانروتاید (lanreotide) مصرف میکنید، به احتمال زیاد باید قبل از درمان با PRRT، مصرف این داروها را برای مدت معینی متوقف کنید.
عوارض جانبی رایج PRRT شامل سطوح پایین گلبولهای سفید خون، آزمایشات غیر طبیعی کبد، حالت تهوع و استفراغ، سطح بالای قند خون و درد است.
عوارض جانبی جدی شامل سطوح پایین سلولهای خونی، ایجاد برخی سرطانهای خون یا مغز استخوان، آسیب کلیه، آسیب کبد، سطوح غیر طبیعی هورمونها در بدن و ناباروری است. اگر باردار هستید یا ممکن است باردار شوید، به تیم مراقبت از سرطان خود بگویید زیرا Lu-177 dotatate میتواند به نوزاد آسیب برساند. اطلاعات کافی در مورد ایتریوم 90 در زنان باردار وجود ندارد، بنابراین باید این موضوع را با پزشک خود در میان بگذارید.
از آن جایی که این داروها شما را در معرض تشعشع قرار میدهند، افرادی که ممکن است با شما در تماس باشند باید از برخی از روشهای ایمنی در برابر پرتو درمانی پیروی کنند تا قرار گرفتن در معرض آنها را محدود کنند.
شیمی درمانی (Chemotherapy) برای تومور نورواندوکرین پانکراس
شیمی درمانی (chemo) از داروهای ضد سرطانی استفاده میکند که به داخل رگ تزریق میشوند یا از طریق دهان و به شکل خوراکی مصرف میشوند تا سلولهای سرطانی را از بین ببرند. این داروها وارد جریان خون میشوند و تقریباً به تمام نقاط بدن میرسند و همین موضوع، این روش درمانی را برای برخی از انواع سرطانهایی که گسترش یافته اند مفید میکند.
شیمی درمانی اغلب برای درمان تومورهای عصبی غدد پانکراس (NETs) استفاده میشود اگر:
- به سایر داروها (مانند داروهای سوماتوستاتین یا درمان هدفمند) پاسخ نداده اند.
- به اندامهای دیگر سرایت کرده اند.
- بزرگ هستند یا به سرعت در حال رشد هستند.
- اگر علائم شدیدی ایجاد میکنند.
- درجه بالایی دارند (درجه 3).
رایج ترین داروهای مورد استفاده برای NETهای پانکراس عبارتند از:
- دوکسوروبیسین (Adriamycin)
- استرپتوزوسین (Streptozocin)
- فلوئورواوراسیل (5-FU)
- داکاربازین (DTIC)
- تموزولوماید (Temodar)
- کاپسیتابین (Xeloda)
- اگزالیپلاتین (Eloxatin)
برخی از تومورها ممکن است با بیش از یک دارو درمان شوند. ترکیبات دارویی ممکن عبارتند از:
- دوکسوروبیسین به اضافه استرپتوزوسین
- 5-FU به علاوه دوکسوروبیسین به علاوه استرپتوزوسین
- تموزولوماید به علاوه کپسیتابین
- 5-FU به علاوه استرپتوزوسین
شیمی درمانی چگونه انجام میشود؟
داروهای شیمی درمانی معمولاً در داخل ورید (IV)، یا به صورت تزریق در چند دقیقه یا به صورت انفوزیون (تزریقی) در مدت زمان طولانیتر داده میشوند. این کار را میتوان در مطب پزشک، کلینیک شیمی درمانی یا در یک محیط بیمارستان انجام داد.
پزشکان دورههای شیمی درمانی را انجام میدهند و در هر دوره از درمان، یک دوره استراحت دنبال میشود تا به شما فرصتی برای بهبودی از اثرات داروها بدهد. چرخهها اغلب 2 یا 3 هفته هستند. برنامه درمانی بسته به داروهای مورد استفاده متفاوت است. به عنوان مثال، برای برخی داروها، شیمی درمانی فقط در روز اول چرخه انجام میشود. برای دیگر داروها، دارو چند روز متوالی یا هفته ای یکبار داده میشود. سپس، در پایان چرخه، برنامه شیمی درمانی برای شروع چرخه بعدی تکرار میشود.
طول روند درمان برای تومور نورواندوکرین پانکراس پیشرفته بر اساس میزان کارکرد آن و عوارض جانبی شما است.
عوارض جانبی احتمالی شیمی درمانی
داروهای شیمی درمانی به سلولهایی که به سرعت در حال تقسیم هستند حمله میکنند، به همین دلیل است که آنها علیه سلولهای سرطانی عمل میکنند. اما سایر سلولهای بدن، مانند سلولهای مغز استخوان (جایی که سلولهای خونی جدید ساخته میشوند)، پوشش داخلی دهان و روده و فولیکولهای مو نیز به سرعت تقسیم میشوند. این سلولها احتمالاً تحت تأثیر شیمی درمانی قرار میگیرند که میتواند منجر به بروز عوارض جانبی شود.
عوارض جانبی شیمی درمانی به نوع و دوز داروهای داده شده و مدت زمان مصرف آنها بستگی دارد. عوارض جانبی رایج میتواند شامل موارد زیر باشند:
- تهوع و استفراغ
- از دست دادن اشتها
- ریزش مو
- زخمهای دهانی
- اسهال یا یبوست
- افزایش احتمال عفونت (به دلیل داشتن گلبولهای سفید بسیار کم)
- کبودی یا خونریزی آسان (به دلیل داشتن تعداد بسیار کم پلاکت خون)
- خستگی (به دلیل داشتن گلبولهای قرمز بسیار کم)
اکثر عوارض جانبی پس از پایان دوره درمان از بین میروند. به تیم مراقبت از سرطان خود در مورد هر گونه از عوارض جانبی یا تغییری که در حین شیمی درمانی متوجه میشوید، اطلاع دهید تا به سرعت درمان شوید. اغلب داروها میتوانند به پیشگیری یا به حداقل رساندن بسیاری از عوارض جانبی کمک کنند. به عنوان مثال، پزشک شما میتواند داروهایی را برای کمک به پیشگیری یا کاهش تهوع و استفراغ تجویز کند. در برخی موارد، ممکن است نیاز به کاهش دوز داروهای شیمی درمانی یا به تعویق انداختن یا توقف روند درمان برای جلوگیری از بدتر شدن اثرات باشد.
درمان دارویی هدفمند (Targeted Drug Therapy) برای تومور نورواندوکرین پانکراس
داروهای هدفمند متفاوت از داروهای استاندارد شیمی درمانی (chemo) عمل میکنند. این داروها قسمتهای خاصی از سلولهای سرطانی را هدف قرار میدهند. آنها گاهی اوقات زمانی که شیمی درمانی کارایی ندارد، مفید هستند و اغلب عوارض جانبی متفاوتی نسبت به شیمی درمانی دارند.
داروهای هدفمند مورد استفاده برای درمان تومورهای عصبی غدد پانکراس (NETs) با مسدود کردن رگ زایی (رشد رگهای خونی جدید که سرطانها را تغذیه میکنند) یا پروتئینهای مهم (به نام تیروزین کیناز یا tyrosine kinases) در سلولهای سرطانی که به رشد و بقای آنها کمک میکند، کار میکنند.
سونیتینیب (Sutent)
Sunitinib چندین تیروزین کیناز را مسدود میکند و به رشد عروق خونی جدید حمله میکند. نشان داده شده است که این دارو به کند کردن رشد تومور کمک میکند. این دارو به صورت یک قرص در روز مصرف میشود.
شایع ترین عوارض جانبی عبارتند از تهوع، اسهال، تغییر در رنگ پوست یا مو، زخمهای دهانی، ضعف و تعداد کم سلولهای خونی. سایر عوارض احتمالی شامل خستگی، فشار خون بالا، مشکلات قلبی، خونریزی، سندرم دست و پا (قرمزی، درد و پوسته پوسته شدن پوست کف دست و کف پا) و سطوح پایین هورمون تیروئید است.
Everolimus (Afinitor)
اورولیموس پروتئینی به نام mTOR را مسدود میکند که به طور معمول به رشد و تقسیم سلولها کمک میکند. نشان داده شده است که این دارو به درمان NETهای پیشرفته پانکراس کمک میکند. Everolimus قرصی است که یک بار در روز مصرف میشود.
عوارض جانبی رایج این دارو شامل زخمهای دهانی، عفونت، حالت تهوع، بی اشتهایی، اسهال، زوائد پوستی، احساس خستگی یا ضعف، تجمع مایعات (معمولاً در پاها) و افزایش سطح قند و کلسترول خون است. یک عارضه جانبی کمتر شایع اما جدی آسیب به ریهها است که میتواند باعث تنگی نفس یا مشکلات دیگر شود.
بلزوتیفان (Welireg)
بلزوتیفان نوعی دارو است که به عنوان مهار کننده HIF شناخته میشود. این دارو پروتئینی به نام فاکتور 2 آلفای القا کننده هیپوکسی (HIF-2a یا hypoxia-inducible factor 2 alpha) را مسدود میکند که هم در رشد سلولهای سرطانی و هم در تشکیل رگهای خونی جدید در تومورها نقش دارد. این دارو معمولاً یک بار در روز به صورت قرص مصرف میشود.
بلزوتیفان را میتوان در افراد مبتلا به بیماری فون هیپل-لینداو (von Hippel-Lindau یا VHL) که دارای NET پانکراس هستند و نیازی به جراحی فوری ندارند، استفاده کرد.
عوارض جانبی رایج این دارو شامل تعداد کم گلبولهای قرمز خون (کم خونی)، احساس خستگی و یا سرگیجه، حالت تهوع، سردرد، افزایش سطح قند خون و تغییرات در آزمایشات آزمایشگاهی است که نشان میدهد دارو ممکن است بر کلیهها تأثیر بگذارد. عوارض جانبی کمتر شایع اما جدیتر میتواند شامل تعداد بسیار کم گلبولهای قرمز خون (کم خونی شدید) باشد که ممکن است نیاز به تزریق خون داشته باشد و سطوح پایین اکسیژن در بدن که برای آن ممکن است نیاز به اکسیژن درمانی یا حتی بستری شدن در بیمارستان داشته باشید.
سایر داروها برای تومورهای نورواندوکرین پانکراس
برای افراد مبتلا به تومورهای پیشرفته عصبی غدد پانکراس (NETs)، چندین دارو میتوانند به کنترل علائم و رشد تومور کمک کنند. این داروها عمدتاً زمانی استفاده میشوند که تومور را نتوان با جراحی برداشت.
آنالوگهای سوماتواستاتین (Somatostatin analogs)
آنالوگهای سوماتواستاتین با سوماتوستاتین، هورمون طبیعی در بدن مرتبط هستند. آنها میتوانند به کند کردن رشد سلولهای تومور عصبی غدد درون ریز کمک کنند. آنها میتوانند برای برخی از بیماران مبتلا به NETهای پانکراس بسیار مفید باشند، زیرا این داروها مانع از ترشح هورمونهای تومور در جریان خون میشوند که اغلب میتواند علائم را تسکین دهد و به بیماران کمک کند تا احساس بهتری داشته باشند. همچنین به نظر میرسد که آنها به کاهش رشد برخی از تومورها کمک میکنند اما نمیتوانند آنها را درمان کنند.
این داروها میتوانند به کاهش اسهال در بیماران مبتلا به VIPomas، گلوکاگونوما و سوماتوستاتینوما، کمک به زوائد گلوکاگونوم و کاهش سطح انسولین در انسولینوما کمک کنند. آنها در افرادی که سندرم کارسینوئید دارند (گر گرفتگی صورت، اسهال، خس خس سینه، ضربان قلب سریع) بسیار مفید هستند، اگرچه این سندروم با NETs در پانکراس به اندازه NETهایی که در جاهای دیگر یافت میشود، رایج نیست. این داروها همچنین برای افرادی که تومورهایشان در اسکن گیرنده سوماتوستاتین (SRS) یا اسکن Dotatate گالیوم 68 نشان داده میشود، مفید هستند.
- اکترئوتید (Sandostatin): یکی از نسخههای اکتروتید کوتاه اثر است و 2 تا 4 بار در روز زیر پوست تزریق میشود. همچنین یک نوع طولانی اثر از دارو (به نام Sandostatin LAR Depot) وجود دارد که فقط یک بار در ماه باید تزریق شود. بسته به شدت علائم، به برخی از افراد در شروع اولین روند درمان هر روز تزریق میشود. پس از کنترل علائم، میتوان از تزریق ماهانه با اثر طولانی تر استفاده کرد. در موارد دیگر، داروی طولانی اثر ممکن است از ابتدا شروع شود.
- Lanreotide (Somatuline Depot): این آنالوگ سوماتواستاتین حدود یک بار در ماه به زیر پوست تزریق میشود. ممکن است دارو توسط پزشک یا پرستار شما تجویز شود یا ممکن است نحوه تزریق را در خانه یاد بگیرید.
عوارض جانبی احتمالی
عوارض اصلی این داروها درد در محل تزریق و به ندرت گرفتگی معده، تهوع، استفراغ، سردرد، سرگیجه و خستگی است. این داروها همچنین میتوانند باعث ایجاد تودههایی لخته مانند در کیسه صفرا شوند که میتواند منجر به سنگ کیسه صفرا شود. آنها همچنین میتوانند بدن را در برابر عملکرد انسولین مقاوم کنند که میتواند سطح قند خون را افزایش دهد و کنترل دیابت از قبل موجود را سخت تر کند. در نتیجه، این داروها فقط برای درمان انسولینوما استفاده میشوند که تومور دارای گیرندههای سوماتوستاتین باشد که توسط سینتیگرافی گیرنده سوماتوستاتین مثبت (positive somatostatin receptor scintigraphy یا SRS) یا اسکن Dotatate گالیم-68 مشاهده میشود.
سایر داروهای مورد استفاده برای NETهای پانکراس خاص
آنالوگهای سوماتواستاتین را میتوان برای درمان بیشتر NETهای پانکراس استفاده کرد. اما ممکن است داروهای دیگری برای درمان علائم یا مشکلات خاصی که در اثر هورمون اضافی تولید شده توسط توده سرطان ایجاد میشوند، اضافه شوند.
گاسترینوما بیش از حد گاسترین میسازد که سطح اسید معده را افزایش میدهد و میتواند منجر به زخم معده شود. مهار کنندههای پمپ پروتون، به عنوان مثال امپرازول (Prilosec)، اسموپرازول (Nexium)، یا لانزوپرازول (Prevacid)، تولید اسید معده را مسدود میکنند و ممکن است برای کاهش احتمال تشکیل زخم تجویز شوند.
انسولینومها انسولین زیادی تولید میکنند که باعث پایین آمدن سطح گلوکز (قند) خون میشود. اگر اسکن گیرنده سوماتوستاتین (SRS) یا اسکن Dotatate گالیم-68 منفی باشد که نشان میدهد فرد سرطان پروتئین سوماتوستاتین را ندارد، آنگاه درمانهای دیگری به جز آنالوگهای سوماتوستاتین برای یکنواخت کردن سطح گلوکز در نظر گرفته میشود. دیازوکساید، دارویی که از ترشح انسولین در جریان خون جلوگیری میکند یا تغییرات رژیم غذایی (مصرف کربوهیدرات بیشتر یا وعدههای غذایی مکرر) ممکن است برای افزایش سطح گلوکز شروع شوند.
گلوکاگونوما مقدار زیادی گلوکاگون تولید میکند، هورمونی که سطح گلوکز (قند) خون را افزایش میدهد. این هورمون برخلاف انسولین عمل میکند. اگر آنالوگهای سوماتوستاتین به تنهایی برای کنترل سطوح بالای گلوکز کافی نباشد، این سرطانها ممکن است با داروهای دیابت درمان شوند.
VIPomaها مقدار زیادی پپتید وازواکتیو روده ای (much vasoactive intestinal peptide یا VIP) تولید میکنند، هورمونی که سطح آب و مواد معدنی (مانند پتاسیم و منیزیم) را در روده تنظیم میکند. روند درمان ممکن است شامل دادن مایعات داخل وریدی (IV) برای درمان کم آبی ناشی از اسهال و همچنین برخی مواد معدنی کم باشد.
درمان تومور نورواندوکرین پانکراس، بر اساس وسعت تومور
درمان تومورهای نورواندوکرین پانکراس (NETs) تا حد زیادی به این بستگی دارد که آیا میتوان آنها را به طور کامل برداشت (حذف کرد) یا خیر. اما عوامل دیگری مانند سلامت کلی شما نیز میتواند بر گزینههای درمانی تأثیر بگذارد.
اگر در مورد برنامه درمانی که برای شما توصیه شده است سوالی دارید، با پزشک خود صحبت کنید.
گاهی اوقات تشخیص اینکه آیا سرطان قابل برداشت است یا خیر – یعنی اینکه آیا میتوان آن را به طور کامل برداشت – فقط با استفاده از آزمایشهای تصویر برداری دشوار است. ممکن است قبل از عمل جراحی لاپاراسکوپی انجام شود تا مشخص شود که آیا میتوان تومور را برداشت. اما حتی در آن زمان هم، گاهی اوقات معلوم میشود که سرطانها فراتر از آن چه در ابتدا تصور میشد، گسترش یافته اند.
NETهای پانکراس نسبت به سرطانهای برون ریز پانکراس (شایع ترین نوع سرطان لوزالمعده) احتمال بیشتری برای برداشته شدن دارند. اکثر NETهایی که به قسمتهای دور بدن گسترش نیافته اند، قابل برداشتن هستند. حتی برخی از NETهایی که گسترش یافته اند، در صورتی که بیش از حد گسترش نیافته باشند (مانند رسیدن تنها به چند نقطه در کبد) ممکن است قابل برداشتن باشند.
درمان تومورهای قابل برداشت (Treating resectable tumors)
اگر تومور قابل برداشتن باشد، جراحی توصیه میشود. روش مورد استفاده بستگی به نوع تومور، اندازه و محل آن در لوزالمعده دارد. جراحی میتواند از کوچک ترین روش انوکلئوناسیون (فقط برداشتن تومور یا enucleation) تا روش ویپل (پانکراتیکودئودنکتومی یا pancreaticoduodenectomy) متفاوت باشد. غدد لنفاوی اغلب برای بررسی گسترش تومور برداشته میشوند.
قبل از هر عمل جراحی، اغلب داروهایی برای کنترل علائم ناشی از تومور تجویز میشود. به عنوان مثال، داروهایی برای مسدود کردن اسید معده (مانند مهار کنندههای پمپ پروتون) برای گاسترینوم استفاده میشود. اغلب، افراد مبتلا به انسولینوم با دیازوکسید درمان میشوند تا قند خون بیش از حد پایین نیاید. اگر تومور در سینتی گرافی گیرنده سوماتوستاتین قابل مشاهده بود، میتوان از آنالوگ سوماتوستاتین مانند اکترئوتید برای کنترل علائم استفاده کرد.
جراحی به تنهایی تمام چیزی است که برای بسیاری از NETهای پانکراس مورد نیاز است اما پس از جراحی، نظارت دقیق برای بررسی علائمی که نشان دهد سرطان ممکن است عود کرده یا گسترش یافته باشد، مهم است.
درمان تومورهای غیر قابل برداشت (Treating unresectable tumors)
تومورهای غیر قابل برداشت را نمیتوان به طور کامل با جراحی برداشت. NETهای پانکراس اغلب آهسته رشد میکنند، بنابراین از آزمایشهای آزمایشگاهی و تصویر برداری برای نظارت بر تومور(ها) و جستجوی علائم رشد استفاده میشود.
افراد مبتلا به NET که در خارج از پانکراس منتشر شده اند، اغلب علائمی مانند اسهال یا مشکلات هورمونی دارند. اینها اغلب میتوانند با داروهایی مانند اکتروتید، لانروتید، دیازوکساید و مهار کنندههای پمپ پروتون بهتر شوند. برخی از این داروها همچنین ممکن است رشد تومور را کاهش دهند.
در صورت نیاز به دوره درمانی بیشتر، شیمی درمانی یا داروهای هدفمند (مانند سونیتینیب یا اورولیموس) ممکن است مورد استفاده قرار گیرد اما این کار معمولاً تا زمانی به تعویق میافتد که فرد علائمی داشته باشد که با داروهای دیگر قابل کنترل نباشد یا علائم رشد تومور در اسکن مشاهده شود. همچنین ممکن است از جراحی یا تکنیکهای فرسایشی برای درمان سرطان گسترش یافته به کبد استفاده شود.
برای افراد مبتلا به تومورهای ضعیف (کارسینومهای عصبی غدد درون ریز)، شیمی درمانی معمولا اولین دوره درمانی است.
برای بزرگسالان مبتلا به تومورهای عصبی غدد لوزالمعده با گیرنده سوماتواستاتین (نوعی هورمون)، یک رادیودارو به نام لوتاترا (لوتسیم لو 177 دوتاتات یا lutetium Lu 177 dotatate) نیز گزینه ای برای درمان است.
اگر دوره درمان در مقطعی دیگر جواب نمیدهد، ممکن است بخواهید در مورد شرکت در کار آزمایی بالینی برای آزمایش یک روش درمانی جدیدتر فکر کنید. اگرچه این کار همیشه بهترین گزینه برای هر فردی نیست اما ممکن است برای شما و همچنین بیماران آینده مفید باشد.
همچنین بخوانید:
- تومور کارسینوئید دستگاه گوارش چیست؟ علائم، پیشگیری و درمان
- مزوتلیومای بدخیم چیست؟ تعریف، علائم، پیشگیری و درمان
- تومورهای کارسینوئید ریه چیست؟ انواع، علائم و درمان
- تومور ویلمز چیست؟ انواع، علائم، درمان
- سارکوم رحم (Uterine Sarcoma) چیست؟
مترجم: فاطمه فریادرس





سلام درمان دارویی این تومورها راهنمایی میخواستم اگر درمان دارویی خوراکی باشد
درمان دارویی خوراکی تومورهای نورواندوکرین (NET):
اورولیموس (Everolimus) → شایعترین داروی خوراکی
سونیتینیب (Sunitinib) → در بعضی NETها (بهویژه پانکراس)
کپسولهای شیمیدرمانی خوراکی مثل تموزولوماید (در موارد انتخابی)
نکته مهم:
انتخاب دارو به محل تومور، درجه (Grade)، Ki-67 و متاستاز بستگی دارد.
حتماً باید زیر نظر انکولوژیست تجویز شود.
تومور اندوکرین درکبد چه پیش آگهی دارد
اگر تومور نورواندوکرین محدود به کبد باشد و امکان جراحی کامل وجود داشته باشد، پیشآگهی بسیار خوب است.
تومورهای متاستاتیک کبدی (از روده یا پانکراس) معمولاً پیشآگهی متوسطی دارند اما با درمان هدفمند، PRRT و SSA بقا بهبود مییابد.
کارسینوم نورواندوکرین G3 (NEC) پیشآگهی ضعیفی دارد و درمان اصلی آن شیمیدرمانی است.
درمانهای جدید مانند رادیوتراپی مولکولی (Lutetium-177) و داروهای هدفمند نقش مهمی در افزایش طول عمر بیماران دارند.