اطلاعات عمومی,ویکی ژن
آنتی بادیهای دو میزبانه چیست؟
مقدمهای بر آنتی بادیهای دو میزبانه یا Bispecific Antibodies
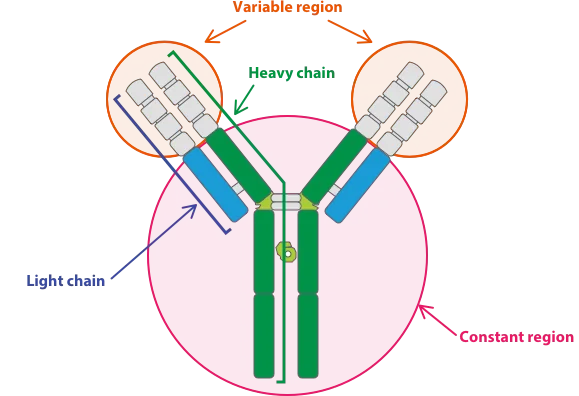
در حالی که آنتی بادیهای مونوکلونال پیشین (mAbs) تنها به یک نوع آنتی ژن متصل میشوند، آنتی بادیهای مونوکلونال دو میزبانه (BsMAbs) میتوانند دو نوع آنتی ژن منحصر به فرد را متصل کنند.
آنتی بادیهای دومیزبانه را میتوان بر اساس ساختار به دو دسته اصلی تقسیم کرد:
- آنتی بادیهای دومیزبانه مبتنی بر قطعه
- آنتی بادیهای دومیزبانه مبتنی بر Fc
آنتی بادیهای دومیزبانه مبتنی بر Fc مشابه mAbهای معمولی هستند، با یک ناحیه Fc و دو ناحیه Fab. با این حال، نواحی Fab آنتی بادیهای دومیزبانه، از نظر ساختاری متفاوت هستند و به آنتی بادی اجازه میدهند تا دو نوع آنتی ژن مجزا را به هم متصل کند.
آنتی بادیهای دومیزبانه مبتنی بر قطعه، منطقه Fc ندارند. آنها از دو یا چند قطعه آنتی بادی مختلف تشکیل شدهاند که توسط یک پیوند دهنده پپتیدی به هم متصل شدهاند. این امر آنها را بسیار کوچکتر از آنتی بادیهای دومیزبانه مبتنی بر Fc میکند و به آنها اجازه میدهد راحتتر به بافتها نفوذ کنند.
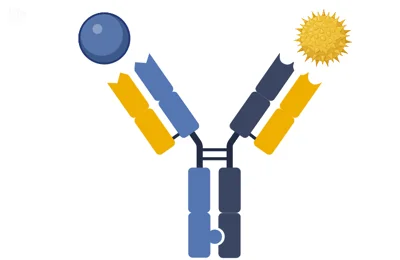
آنتی بادیهای دومیزبانه Fragment-Based
در حالی که آنتی بادیهای دومیزبانه مبتنی بر Fc به آنتی بادی اجازه میدهند تا دو آنتی ژن را متصل کند، سلولهای ایمنی را نیز متصل و پاسخ ایمنی را آغاز میکند. آنتی بادیهای دومیزبانه مبتنی بر قطعه اغلب مشابه mAbs اما با اندازه کاهش یافته عمل میکنند. یک قطعه آنتی بادی به یک آنتی ژن (به سلول خارجی یا سلولی با عملکرد نادرست) متصل میشود، در حالی که دیگری پاسخ ایمنی را آغاز میکند.
اندازه کوچک آنتی بادیهای دومیزبانه مبتنی بر قطعه، فاصله بین سلول هدف و سلول موثر را کاهش میدهد و میتواند کشتن موثرتر سلول هدف را در مقایسه با mAb های معمولی امکان پذیر کند.
اندازه کوچکتر همچنین باعث نیمه عمر کوتاهتر و سرعت پاکسازی سریعتر در بدن میشود که میتواند برای داروهای خاصی که آنتی بادی اثرات سمی قابل توجهی دارد، مانند برخی از داروهای سرطان، مفید باشد.
به عنوان مثال، آنتی بادیهای دومیزبانه Blinatumomab به CD3ε در سلولهای T و CD19 در سلولهای B متصل میشوند و باعث از بین رفتن سلول B میشوند. CD19 بیشتر در سلولهای B بدخیم در لوسمی و لنفوم بیان میشود، بنابراین این آنتی بادی یک داروی ضد سرطان موثر است.
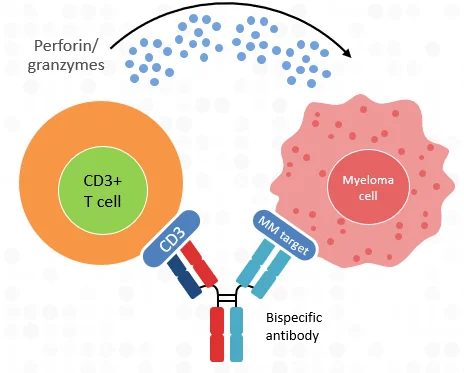
Blinatumomab برای استفاده در سال 2014 تایید شد و سمیت سلولی بالایی در غلظتهای بسیار پایین نشان داده بود. در آزمایشهای اولیه نشان داده شد که این دارو در غلظتهای pg/mL100-10 اثربخشی قابلتوجهی دارد و در مقایسه با سایر روشهای ایمنی درمانی آن زمان، بسیار مؤثر است.
آنتی بادیهای دومیزبانه مبتنی بر Fc
در جایی که نیازی به اندازه کوچک و نیمه عمر کوتاه نیست، یک ناحیه Fc اضافه میشود زیرا به دارو اجازه میدهد تا پاسخ ایمنی قویتری ایجاد کند و ثبات را بهبود بخشد.
این امر به ویژه در حمل و نقل و تجویز دارو نیز مفید است زیرا بسیاری از آنتی بادیهای دومیزبانه مبتنی بر قطعه پس از حدود 48 ساعت در دمای اتاق فعالیت خود را از دست میدهند بنابراین، به این طریق میتوان نیاز به یخچال را کاهش دهد.
علاوه بر مزایای لجستیکی آنتی بادیهای دومیزبانه مبتنی بر Fc، آنها همچنین دارای مزیت پزشکی جذب سلولهای متعدد به محل هدف هستند یعنی حضور یک منطقه Fc که امکان پاسخ ایمنی قوی را فراهم میکند که احتمال از بین بردن هر سلول آسیب دیده یا خارجی را افزایش میدهد.
تولید آنتی بادیهای دومیزبانه مبتنی بر Fc نسبتا ناکارآمد است. هیبریدومهای موش آنتی بادیهایی را بیان میکند که یکی از دو آنتی ژن را هدف قرار میدهند. پس از تولید و ادغام دو هیبریدوم، یک سلول کوادروما تشکیل میشود و مونتاژ ایمونوگلوبولین (Ig) زنجیره سبک و سنگین از سلولهای مادر، آنتی بادیهای والدین و هیبریدی تولید میکند.
این فرآیند منجر به 10 ساختار مختلف Ig میشود که تنها یکی از آنها دو میزبانه است و استخراج آنتی بادیهای دومیزبانه میتواند یک فرآیند دشوار و زمانبر باشد. توسعه کوادرومای موش، تصادفی بودن مونتاژ را کاهش داده است و امکان خالص سازی آسانتر را فراهم میکند.
Catumaxomab اولین آنتی بادیهای دومیزبانه تولید شده توسط این فناوری بود که برای استفاده در اروپا تایید شد. آنتی ژنهای EpCAM را روی سلولهای سرطانی متاستاز و CD3 را روی سلولهای T متصل میکند، در حالی که ناحیه Fc سلولهای ایمنی جانبی مثبت I-، IIa- یا III را فعال میکند که باعث جذب چندین سلول ایمنی مختلف به محل تومور میشود که منجر به پاسخ ایمنی پیچیده و کشتن سلول سرطانی با سلول T میشود.
معایب
هنوز تعداد بسیار کمی از آنتی بادیهای دومیزبانه در حال استفاده هستند. یکی از دلایل این امر این است که ناحیه Fc میتواند باعث پاسخهای ایمنی ناخواسته شود. گیرندههای Fc اغلب میتوانند به پروتئینهای سطحی روی انواع سلولهای ایمنی مختلف متصل شوند که منجر به پاسخ پیچیدهای میشود که پیشبینی آن دشوار است.
آنتی بادیهای دومیزبانه نیز اغلب با هزینه بالایی همراه هستند. در حالی که آزمایشهای بالینی گسترده به این امر کمک میکند، این آنتیبادیها عمدتاً در درمان سرطانهای نادر استفاده میشوند، بنابراین تعداد بیماران بسیار محدودی دارند.
نرخ پاکسازی بالای آنتی بادیهای دومیزبانه مبتنی بر قطعه میتواند به هزینه درمان اضافه کند. در حالی که آنها در غلظت های پایین بسیار موثر هستند، اندازه کوچک آنها میتواند منجر به پاکسازی سریع آنها از بافت ها شود، بنابراین اغلب دوزهای متعدد مورد نیاز است. بنابراین، تحقیقات بیشتر ضروری است. افزایش کارایی تولید ممکن است به کاهش هزینه کمک کند، در حالی که آنتی بادیهای دومیزبانه جدید میتوانند در درمان سایر سرطانها کمک کنند. تحقیقات در زمینههای خارج از ایمونوتراپی سرطان میتواند کاربردهای دیگری را نیز شناسایی کند.
آزمایشهای بالینی برای درمانهای جدید مبتنی بر آنتی بادیهای دومیزبانه در حال انجام است. نتیجه این کارآزماییها به ایمنی دارو بستگی دارد، بهویژه در ایجاد یک پاسخ ایمنی ناخواسته که در مقابل مزایای سلامتی هر بیمار سنجیده میشود.
همچنین بخوانید:
- آنتی بادی (Antibody) چیست؟
- تیتر آنتی بادی چیست؟ هدف، روش انجام، تفسیر
- آنتیبادی مونوکلونال: تعریف، انواع، تولید، کاربردها
مترجم: معصومه قریبی ششده