اطلاعات عمومی, تکنیک ها, ویکی ژن
پروتئومیکس (Proteomics): انواع، روشها، مراحل و کاربردها
پروتئومیکس چیست؟
پروتئومیکس علم مطالعه پروتئوم (Proteome) که مجموعه کامل از پروتئینهایی است که در یک سیستم بیولوژیکی تولید میشود، میباشد.
پروتئومیکس بینش مستقیمی را در مورد عملکردهای سلولی ارائه میدهد زیرا پروتئینها اکثر کارکردهای ژن را در سلولها انجام میدهند. پروتئومیکس بر مطالعه پروتئینها، ساختارها، برهمکنشها و کارکرد آنها تمرکز دارد.
میتوان از پروتئومیکس برای مطالعه بیان پروتئینها استفاده کرد. علاوه بر این، پروتئومیکس میتواند نحوه اصلاح پروتئینها را نشان دهد، مانند پیرایش پساترجمهای (Post-translational modification). پروتئومیکس همچنین میتواند اطلاعاتی در مورد حرکت پروتئینها بین بخشهای مختلف درون سلولی و همچنین درگیری آنها در مسیرهای متابولیک (Metabolic) و برهمکنش با پروتئینهای دیگر ارائه دهد.
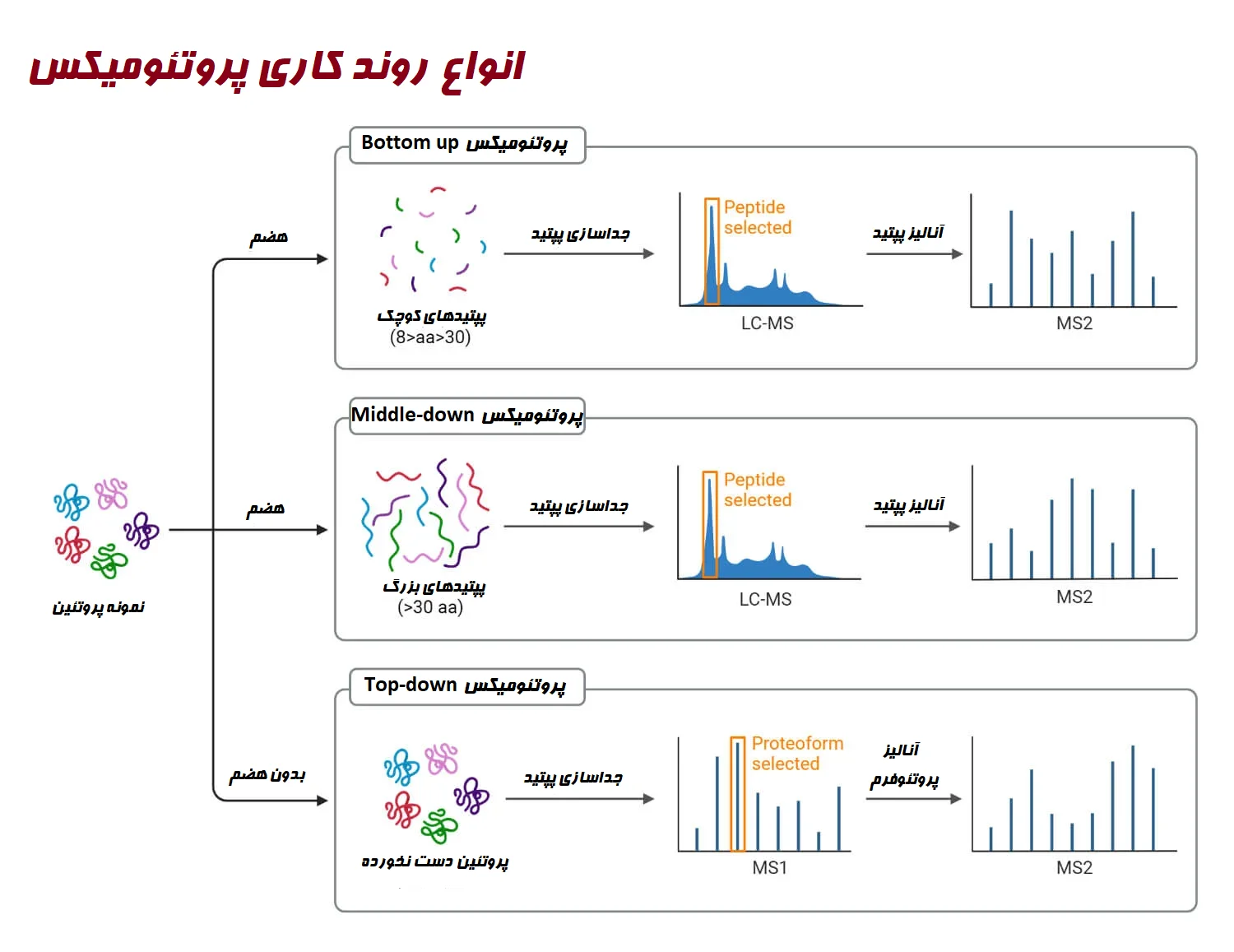
انواع پروتئومیکس
پروتئومیکس را میتوان به سه دسته طبقهبندی کرد: پروتئومیکس بیانی (Expression proteomics)، پروتئومیکس ساختاری (Structural proteomics) و پروتئومیکس عملکردی (Functional proteomics).
- پروتئومیکس بیانی رشتهای است که تغییرات بیان پروتئین را هم به صورت کیفی و هم به صورت کمی تحت شرایط مختلف مطالعه میکند. این نوع پروتئومیکس تغییرات بیان پروتئین را در سلولهای مختلف مانند بافت تومور در مقایسه با بافت طبیعی شناسایی میکند. آزمایشهای پروتئومیکس بیانی اغلب از تکنیکهایی مانند الکتروفورز ژل دو بعدی (2D gel electrophoresis) و طیفسنجی جرمی (Mass spectrometry) برای شناسایی و تعیین کمیت پروتئینها استفاده میکنند.
- پروتئومیکس ساختاری به تعیین ساختار سه بعدی پروتئینها میپردازد. این پروتئومیکس از تکنیکهایی مانند کریستالوگرافی اشعه ایکس (X-ray crystallography) و طیفسنجی رزونانس مغناطیسی هسته (Nuclear magnetic resonance spectroscopy (NMR)) برای تعیین آرایش دقیق اتمها در یک پروتئین استفاده میکند. پروتئومیکس ساختاری همچنین میتواند برای بررسی برهمکنشهای پروتئین-پروتئین و برهمکنش بین پروتئینها و سایر مولکولهای زیستی (Biomolecule) مانند DNA یا RNA استفاده شود.
- پروتئومیکس عملکردی بر درک کارکرد پروتئینها و برهمکنش آنها با مولکولهای دیگر در سلول متمرکز است. این نوع از پروتئومیکس شامل شناسایی کمپلکسهای پروتئینی و فعل و انفعالاتی است که در فرآیندهای بیولوژیکی خاص دخیل هستند و همچنین شامل نقش پروتئینهای منفرد در این کمپلکسها میباشد.
روشها و مراحل پروتئومیکس
پروتئومیکس از چندین فناوری با توان عملیاتی بالا برای بررسی و آنالیز پروتئومها استفاده میکند. پروسه پروتئومیک شامل مراحل مختلفی از جمله آمادهسازی نمونه، جداسازی پروتئینها، شناسایی پروتئین و اعتبارسنجی است.
-
آمادهسازی نمونه
- آمادهسازی نمونه یک مرحله حیاتی در آزمایشهای پروتئومیکس است که شامل استخراج و خالصسازی پروتئینها از نمونههای بیولوژیکی برای آنالیز بیشتر است.
- به طور کلی، استخراج پروتئینها از یک مخلوط شامل ترکیبی از روشهای شیمیایی و فیزیکی است.
- حلالهای آلی و شویندهها معمولاً در آمادهسازی نمونه برای افزایش حلالیت پروتئین و شکستن غشاهای سلولی جهت آزادسازی پروتئینهای درون سلولی استفاده میشوند.
- تکنیکهای شکستن بافت مانند هموژنیزاسیون مکانیکی (Mechanical homogenization) یا سونیکاسیون (Sonication)، اغلب در آمادهسازی نمونه برای تجزیه بافتها و آزادسازی پروتئینها استفاده میشود.
-
جداسازی و ایزوله کردن پروتئینها
عمدتاً دو رویکرد برای جداسازی پروتئینها استفاده میشود: رویکرد مبتنی بر ژل (Gel-based) و رویکرد مبتنی بر کروماتوگرافی (Chromatography-based).
رویکرد مبتنی بر ژل
1-DE
- الکتروفورز ژل تک بعدی (1-DE) که با نام SDS-PAGE (الکتروفورز ژل سدیم دودسیل سولفات-پلیآکریلآمید (Sodium dodecyl sulfate-polyacrylamide)) نیز شناخته میشود، یک روش متداول برای جداسازی پروتئینها بر اساس وزن مولکولی آنها است.
- SDS یک ماده شوینده است که برای دناتوره کردن (Denature) پروتئینها و ایجاد بار منفی یکنواخت متناسب با جرم آنها، استفاده میشود. این بار منفی یکنواخت اجازه میدهد تا پروتئینها بر اساس اندازه در طول فرایند الکتروفورز جدا شوند.
- سپس پروتئینهایی که SDS بر روی آنها اعمال شده در یک ماتریکس ژل پلیآکریلآمید با استفاده از یک میدان الکتریکی جدا میشوند. پروتئینهای کوچکتر با سرعت بیشتری در ژل حرکت میکنند، در حالی که پروتئینهای بزرگتر با سرعت کمتری حرکت میکنند.
2-DE
- الکتروفورز ژل دو بعدی (2-DE) تکنیکی است که برای جداسازی پروتئینها بر اساس دو پارامتر استفاده میشود: نقطه ایزوالکتریک (Isoelectric point) و وزن مولکولی.
- در مرحله اول جداسازی که ایزوالکترو فوکوسینگ (Isoelectric focusing (IEF)) نامیده میشود، پروتئینها بر اساس نقطه ایزوالکتریک (pI) خود، یعنی مقدار pH که در آن پروتئین بار خالص ندارد، جدا میشوند.
- مرحله دوم جداسازی SDS-PAGE است که در آن پروتئینها بر اساس وزن مولکولی خود جدا میشوند.
- این جداسازی توسط دو پارامتر مختلف امکان افتراق بهتر پروتئینها را فراهم میکند و همچنین میتواند پیرایش پساترجمهای و اشکال مختلف پروتئینهایی را که با 1-DE قابل حل نیستند، شناسایی کند.
- با این حال، 2-DE دارای محدودیتهایی است، زیرا نمیتواند پروتئینهایی با وزن مولکولی کم یا آنهایی که خیلی بزرگ هستند را شناسایی کند.
رویکرد مبتنی بر کروماتوگرافی
- IEC (کروماتوگرافی تبادل یونی (Ion Exchange Chromatography) یک تکنیک کروماتوگرافی است که برای خالصسازی پروتئینها بر اساس بارشان استفاده میشود. این رویکرد با استفاده از یک فاز ساکن (Stationary phase) باردار که با پروتئینهای دارای بار مخالف موجود در نمونه برهمکنش میکند، کار خود را انجام میدهد.
- SEC (کروماتوگرافی حذف اندازهای (Size exclusion chromatography)) مولکولها را بر اساس اندازه آنها جدا میکند. SEC از یک رزین متخلخل (Porous resin) استفاده میکند زیرا از ورود فاز ساکن و مولکولهایی که از نظر اندازه بزرگتر هستند به منافذ جلوگیری میکند، در حالی که مولکولهای کوچکتر میتوانند به منافذ نفوذ کنند و زمان بیشتری برای شستشو بگیرند.
- کروماتوگرافی بر اساس میل ترکیبی (Affinity chromatography)، پروتئینها را بر اساس برهمکنش آنها با لیگاند (Ligand) تثبیت شده جدا میکند. این روش در کاهش پیچیدگی پروتئینها در آزمایشات 2-DE و non-2-DE مفید است.
- LC (کروماتوگرافی مایع (Liquid chromatography)) یکی از پرکاربردترین روشها در پروتئومیکس برای جداسازی پروتئینها از مخلوطهای پیچیده است. این روش یک ابزار ارزشمند در تحقیقات پروتئومیکس است که میتواند برای آنالیز مولکولهای زیستی بزرگ و شکننده استفاده شود.
-
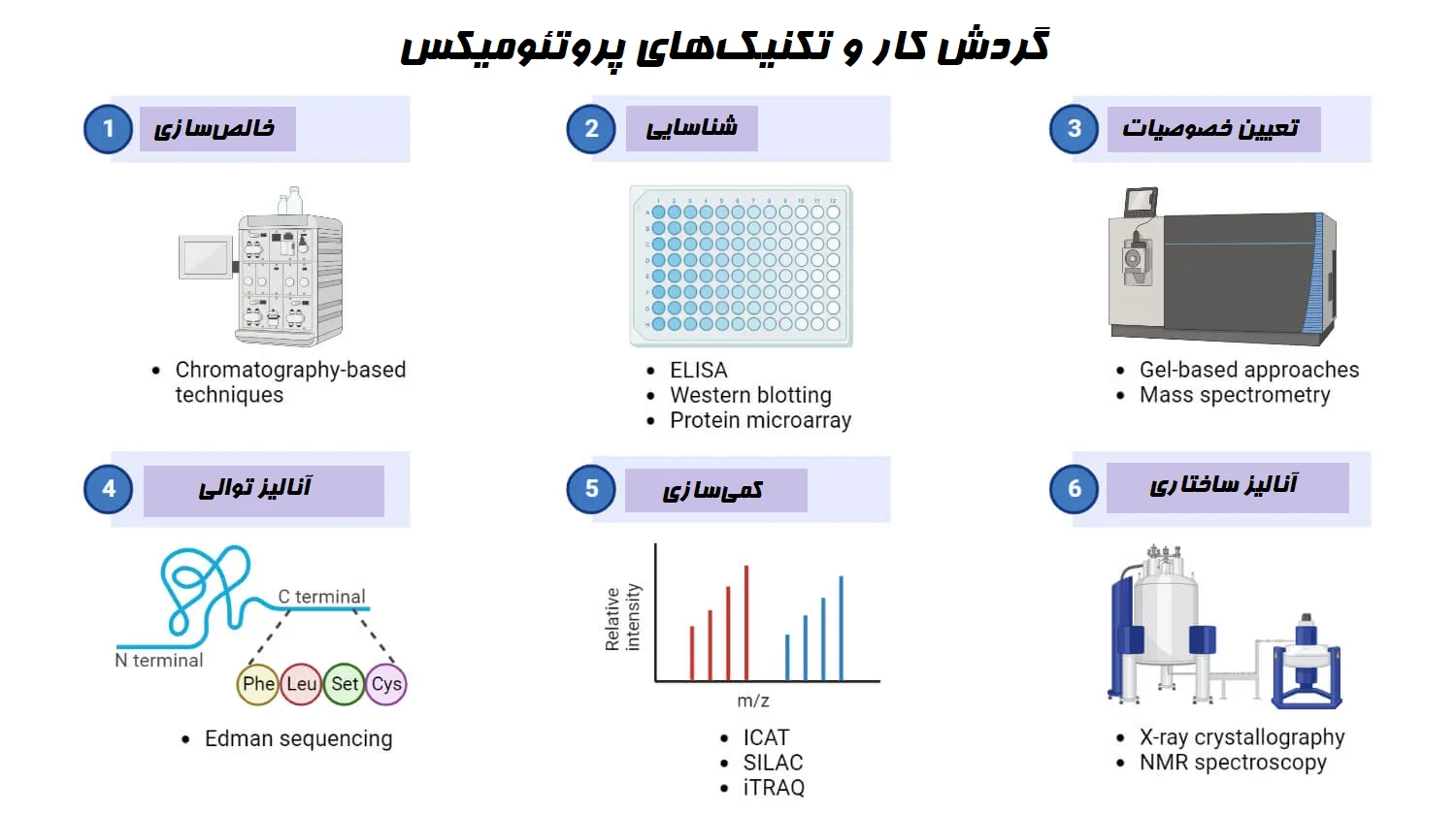
شناسایی و تعیین خصوصیات پروتئین
طیفسنجی جرمی
- طیفسنجی جرمی (MS) ابزار قدرتمندی است که میتواند به سرعت پروتئینها را توالییابی و وزن مولکولی آنها را تعیین کند.
- این روش با یونیزه کردن مولکولهای پروتئین و سپس محاسبه جرم آنها بر اساس نسبت جرم به بار کار میکند.
- دو روش مورد استفاده برای یونیزاسیون در MS عبارتند از ESI (یونیزاسیون الکترواسپری (Electrospray Ionization)) و MALDI (واجذب-یونش لیزری به کمک ماتریس (Matrix-Assisted Laser Desorption Ionization)).
- در ESI، نمونه پروتئین برای ایجاد ذرات باردار فعال میشود که این امر تولید یون گازی را افزایش میدهد. سپس یونها با یک آنالایزر جرمی آنالیز میشوند.
- در MALDI، یک ماتریکس شیمیایی با پپتیدها (peptide) مخلوط شده و روی یک پلیت (Plate) فلزی به صورت نقطه نقطه قرار داده میشود تا یک شبکه کریستالی ایجاد شود. سپس ماتریکس انرژی را جذب کرده و به نمونه منتقل میکند. سپس یونهای پپتید توسط یک آنالایزر جرمی شناسایی میشوند.
جستجو در پایگاه داده
- هنگامی که پپتیدها توالییابی شدند، میتوان از برنامههای بیوانفورماتیک برای جستجوی هویت یک پروتئین در پایگاه داده پروتئینهای شناخته شده استفاده کرد.
- هدف از این جستجو، یافتن تطابق دقیق یا تقریباً دقیق است. کاربر باید تا آنجا که ممکن است اطلاعاتی مانند جرمهای مولکولی پپتید، توالی پپتید، وزن مولکولی و نقطه ایزوالکتریک پروتئین دست نخورده را برای رسیدن به شناسایی منحصر به فرد یک پروتئین خاص ارائه دهد.
- این روش محدود به ارگانیسمهای مدلی است که ژنومهای کاملاً توالیبندی شده و دارای حاشیهنویسی (Annotated) خوبی دارند.
الکتروفورز افتراقی درون ژلی (Differential In-Gel Electrophoresis (DIGE))
- DIGE روشی است که برای تشخیص تفاوت در الگوهای بیان پروتئین بین دو نمونه استفاده میشود.
- این روش شامل برچسب زدن پروتئینها از دو نمونه مختلف با رنگهای فلورسنت مختلف و مخلوط کردن آنها با یکدیگر قبل از جداسازی توسط الکتروفورز روی یک ژل دو بعدی است.
- سپس پروتئینهای بیان شده به صورت افتراقی در هر دو نمونه را میتوان روی همان ژل مشاهده و مقایسه کرد.
- با این حال محدودیتهایی برای این رویکرد وجود دارد، از جمله: پروتئینهای مختلف ممکن است برچسبهای فلورسنت را به اندازههای مختلف جذب کنند و برخی از پروتئینهای برچسبگذاری شده با فلوروفورها (Fluorophore) ممکن است کمتر قابل حل شوند و قبل از الکتروفورز رسوب کنند.
ریزآرایههای پروتئینی (Protein microarray)
- ریزآرایههای پروتئینی دستگاههایی با کارایی بالا هستند که حاوی شبکههایی با تراکم بالا به همراه پروتئینهای تثبیت شده هستند.
- ریزآرایههای پروتئینی ابتدا بهعنوان ایمونواسیها (Immunoassay) یا آرایههای آنتیبادی (Antibody array) توسعه یافتند که نوعی ریزآرایه است که شامل گرفتن پروتئینها روی یک بستر میکروآرایه آنتیبادی و شناسایی آنها با استفاده از آنتیبادیها میشود.
- یک تکنیک جدید از داربستهای پروتئینی (Protein scaffold) که نسبت به آنتیبادیها کوچکتر، پایدارتر و اختصاصیتر هستند برای جذب پروتئینهای هدف استفاده میکند.
- فناوری دیگری که در حال توسعه است، Protein-Print نام دارد که از قالب مولکولی (molecular imprinting) برای گرفتن مولکولهایی با اختصاصیت بالا استفاده میکند.
کاربردها
پروتئومیکس کاربردهای گستردهای در زمینههای مختلف دارد. برخی از این کاربردها عبارتند از:
- پروتئومیکس را میتوان در کشف نشانگرهای زیستی جهت شناسایی نشانگرهای پروتئینی برای تشخیص و پیشبینی روند بیماریهای مختلف استفاده کرد.
- پروتئومیکس همچنین میتواند جهت شناسایی اهداف دارویی بالقوه و توسعه درمانهای موثرتر با مطالعه برهمکنش پروتئین-پروتئین در سلولهای بیمار مورد استفاده قرار گیرد.
- پروتئومیکس در کشاورزی برای مطالعه برهمکنشهای گیاه و عامل بیماریزا و توسعه محصولاتی که در برابر تنشهای محیطی مقاومتر هستند، استفاده میشود.
- پروتئومیکس همچنین در زمینه علوم غذایی برای بهبود ارزش غذایی و ایمنی غذاها و شناسایی آلرژنها (Allergen) استفاده میشود.
- پروتئومیکس میتواند برای شناسایی پروتئینهایی استفاده شود که با سمیت دارویی مرتبط هستند و در نتیجه میتواند منجر به تولید داروهای ایمنتر شود.
- پروتئومیکس همچنین به توسعه پزشکی شخصی (Personalized medicine) کمک میکند، یعنی جایی که پروتئوم تک تک بیماران را میتوان آنالیز کرد تا درمانها را بر اساس ساختار ژنتیکی خاص آنها انجام داد.
همچنین بخوانید:
مترجم: صادق حسینیکیا





سلام .پروتئومیکس غیر هدفمند رو میخواستم در موردش بدونم . مرسی
پروتئومیکس غیر هدفمند یک روش جامع و گسترده برای مطالعه پروتئومها، یعنی کلیه پروتئینهایی که در یک سلول، بافت یا سازماندهی زیستی خاص بیان میشوند، است. این روش در مقابل پروتئومیکس هدفمند قرار دارد که در آن تمرکز بر روی پروتئینهای خاصی با ویژگیهای معین است. پروتئومیکس غیر هدفمند به دنبال درک و تجزیه و تحلیل کلیه پروتئینهای موجود در نمونه است تا تصویری کامل از وضعیت پروتئومیک در شرایط خاص فراهم آورد.
تکنیکهای کلیدی در پروتئومیکس غیر هدفمند
طیفسنجی جرمی: این تکنولوژی مهمترین ابزار در پروتئومیکس غیر هدفمند است و برای شناسایی، کمیسازی و تعیین ساختار پروتئینها استفاده میشود. نمونهها ابتدا توسط کروماتوگرافی مایع تفکیک میشوند و سپس پروتئینها یا پپتیدهای حاصل توسط طیفسنج جرمی تجزیه و تحلیل میشوند.
الکتروفورز دوبعدی: این روش برای جداسازی پروتئینها بر اساس بار الکتریکی و وزن مولکولی آنها در دو بعد مختلف استفاده میشود و میتواند تصویری وسیع از پروتئوم سلولی ارائه دهد.
کاربردها
تحقیقات بیماریها: شناسایی بیومارکرها و مسیرهای بیماریزا در بیماریهای مختلف، از جمله سرطان و بیماریهای متابولیک.
بیولوژی سیستمها: درک چگونگی تعامل پروتئینها در یک سیستم زیستی و تأثیر شرایط محیطی یا تغییرات ژنتیکی بر پروتئوم.
بهبود فرآیندهای بیوتکنولوژی: بهینهسازی تولید پروتئینها و دیگر ترکیبات در صنایع دارویی و کشاورزی.