مطالب
هیستون (Histone)
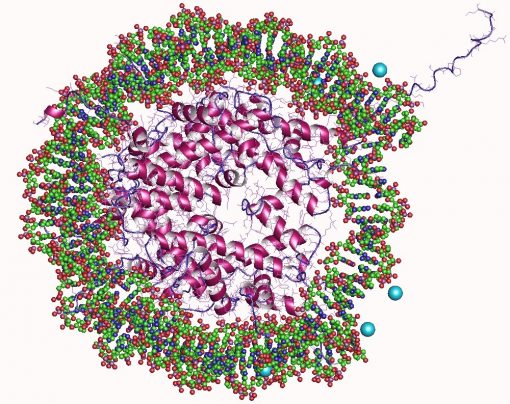
در زیست شناسی، هیستونها پروتئینهای بسیار پایهای هستند که در هستههای سلولهای یوکاریوتی در بقایای لیزین و آرژنین به طور فراوان یافت میشوند. آنها بهعنوان قرقرههایی عمل میکنند که DNA در اطراف آن میپیچد تا واحدهای ساختاری به نام نوکلئوزوم (nucleosome) را ایجاد کند. نوکلئوزومها به نوبه خود در الیاف 30 نانومتری پیچیده میشوند که کروماتین (chromatin) محکم بسته بندی شده را تشکیل میدهند. هیستونها از گره خوردن DNA جلوگیری کرده و از آسیب DNAرا محافظت میکنند. علاوه بر این، هیستونها نقش مهمی در تنظیم ژن و همانند سازی DNA دارند. بدون هیستون،DNA بدون پیچش در کروموزومها بسیار بلند و طولانی خواهد بود. به عنوان مثال، هر سلول انسان در صورت کشیده شدن کامل، حدود 1.8 متر DNA دارد. با این حال، هنگامی که این ماده در اطراف هیستونها پیچیده میشود، این طول به حدود 90 میکرومتر (0.09 میلی متر) از الیاف کروماتین با قطر 30 نانومتر کاهش مییابد.
پنج خانواده از هیستونها وجود دارد که H1/H5(هیستونهای پیوند دهنده یا لینکر)، H2، H3 و H4 (هیستونهای هستهای) نامیده میشوند. هسته نوکلئوزوم از دو دایمر H2A-H2Bو یک تترامر H3-H4 تشکیل شده است. بسته شدن محکم DNA در اطراف هیستونها تا حد زیادی نتیجه جاذبه الکترواستاتیکی بین هیستونهای با بار مثبت و ستون فقرات فسفات با بار منفی DNA است.
هیستونها ممکن است به واسطه عمل آنزیمها برای تنظیم رونویسی ژن، از نظر شیمیایی اصلاح شوند. رایجترین تغییر، متیلاسیون آرژنین (arginine) یا باقی ماندههای لیزین (lysine) یا استیلاسیون لیزین است. متیلاسیون (Methylation) میتواند بر نحوه تعامل پروتئینهای دیگر مانند فاکتورهای رونویسی با نوکلئوزومها تأثیر بگذارد. استیلاسیون (acetylation) لیزین بار مثبت روی لیزین را از بین میبرد و در نتیجه جاذبه الکترواستاتیکی بین هیستون و DNA را تضعیف میکند که منجر به باز شدن جزئی DNA میشود و آن را برای بیان ژن در دسترس تر میکند.
کلاسها و انواع (واریانتها)
پنج خانواده اصلی هیستون وجود دارد: H1/H5، H2A، H2B، H3 و H4. هیستونهای H2A، H2B،H3 و H4 به عنوان هیستونهای هستهای شناخته میشوند، در حالی که هیستونهای H1/H5 به عنوان هیستونهای پیوندی (linker histone) شناخته میشوند.
هیستونهای هستهای همگی به صورت دایمر وجود دارند که از این نظر مشابه هستند که همگی دارای یک تاخوردگی خاص در دومین (domain) های هیستونی هستند: سه مارپیچ آلفا که توسط دو حلقه به هم متصل شدهاند. این ساختار مارپیچی است که امکان تعامل بین دایمرهای متمایز را فراهم میکند، به ویژه به شکل دم سر (head-tail که به آن موتیفِ دست دادن (handshake motif) نیز گفته میشود). سپس چهار دایمر متمایز به دست آمده با هم تجمع پیدا میکنند تا یک هسته نوکلئوزومی اکتامری با قطر تقریباً 63 آنگستروم (ذرهای DNA مانند سلونوئیدی) تشکیل دهند. حدود 146 جفت باز (bp) DNA 1.65 بار در یک چرخش فوق مارپیچ به سمت چپ به دور این ذره هستهای میپیچد تا ذرهای با عرض حدود 100 آنگستروم ایجاد کند. هیستون پیوند دهنده H1 در محلهای ورودی و خروجی DNA به نوکلئوزوم متصل میشود، بنابراین DNA را در جای خود قفل میکند و امکان تشکیل ساختار مرتبه بالاتر را میدهد. اساسی ترین مرحله این شکل گیری، قرار گیری فیبر یا مهرههای 10 نانومتری روی یک رشته در حال تشکیل است. این مرحله شامل پیچیده شدن DNA در اطراف نوکلئوزومها با تقریباً 50 جفت باز DNA است که هر جفت نوکلئوزوم را از هم جدا میکند (همچنین به عنوان DNA پیوند دهنده یا لینکر نیز نامیده میشود). ساختارهای مرتبه بالاتر شامل ایجاد فیبر 30 نانومتری (که یک زیگزاگ نامنظم را تشکیل میدهد) و فیبر 100 نانومتری هستند. اینها ساختارهایی هستند که در سلولهای طبیعی یافت میشوند. در طی میتوز و میوز، کروموزومهای متراکم از طریق برهمکنش بین نوکلئوزومها و سایر پروتئینهای تنظیم کننده به قطبین سلول کشیده میشوند.
هیستونها به هیستونهای وابسته به همانند سازی متعارف (canonical replication-dependent histones) تقسیم میشوند که در طول فاز S چرخه سلولی از انواع هیستونهای مستقل از همانند سازی (replication-independent histone) که در طول کل چرخه سلولی بیان میشوند، بوجود میآیند. در حیوانات، ژنهای کد کننده هیستونهای متعارف معمولاً در امتداد کروموزوم قرار میگیرند، فاقد اینترون هستند و به جای دم polyA از ساختار حلقه ساقه (stem loop structure) در انتهای 3′ استفاده میکنند. ژنهای کد کننده انواع هیستونها معمولاً خوشهای (در کنار یکدیگر) نیستند، اینترون دارند و mRNAهای آنها با دمهای polyA تنظیم میشود. موجودات چند سلولی پیچیده معمولاً دارای تعداد بیشتری از انواع هیستون هستند که عملکردهای متفاوتی را ارائه میدهند. دادههای اخیری که در مورد نقش انواع هیستونهای مختلف جمع آوری شده است، پیوندهای عملکردی بین انواع این پروتئینها و تنظیم ظریف رشد ارگانیسم را برجسته میکند.
ساختار
هسته نوکلئوزوم از دو دایمر H2A-H2B و یک تترامر H3-H4 تشکیل شده است که دو نیمه تقریباً متقارن را با ساختار سوم تشکیل میدهد (تقارن C2؛ یک ماکرومولکول تصویر آینهای ماکرومولکول دیگر است.) دایمرهای H2A-H2B و تترامر H3-H4 نیز تقارن کاذب (pseudodyad symmetry) را نشان میدهند. 4 هیستون هستهای (H2A, H2B, H3 و H4) از نظر ساختار نسبتاً مشابه هستند و در طول تکامل بسیار حفظ شدهاند. همه این هیستونها دارای یک موتیف «مارپیچ چرخشی مارپیچ چرخشی یا helix turn helix turn helix» هستند – موتیف پروتئینی متصل شونده به DNAکه توالی خاصی از DNA را تشخیص میدهد. آنها همچنین دارای مشخصه “دم” بلند در یک انتهای ساختار اسید آمینهای هستند – این منطقه، محل اصلاح پس از ترجمه (post-translational modification) است.
هیستون آرکئال (Archaeal histone) یا باستانی فقط حاوی ساختار دیمری H3-H4 است که از همان پروتئین ساخته شده است. چنین ساختارهای دیمری میتوانند در یک ابر مارپیچ بلند (هیپرنوکلئوزوم یا hypernucleosome) قرار بگیرند که DNA به روشی شبیه به قرقرههای نوکلئوزومی روی آن میپیچد. فقط برخی از هیستونهای باستانی دارای دم هستند. فاصله بین قرقرههایی که سلولهای یوکاریوتی DNA خود را به دور آن میپیچند، بین 59 تا 70 Å (آنگستروم) تعیین شده است.
در کل، هیستونها پنج نوع تعامل یا برهمکنش با DNA ایجاد میکنند:
- پلهای نمکی و پیوندهای هیدروژنی بین زنجیرههای جانبی اسیدهای آمینه اساسی (به ویژه لیزین و آرژنین) و اکسیژنهای فسفات روی DNA
- مارپیچ – دوقطبیها مارپیچهای آلفا را در H2B، H3 و H4 تشکیل میدهند که باعث تجمع بار مثبت خالص در نقطه برهم کنش با گروههای فسفات با بار منفی روی DNA میشود.
- پیوندهای هیدروژنی بین ستون فقرات DNA و گروه آمید در زنجیره اصلی پروتئینهای هیستون
- برهمکنشهای غیرقطبی بین قندهای هیستون و دئوکسی ریبوز روی DNA
- درج شیارهای جزئی غیراختصاصی دم N انتهایی H3 و H2B در دو شیار کوچک هر کدام روی مولکول DNA
ماهیت بسیار اساسی هیستونها، جدای از تسهیل برهمکنشهای DNA-هیستون، به حلالیت آنها در آب کمک میکند. هیستونها در معرض تغییرات پس از ترجمه توسط آنزیمها عمدتاً در دمهای انتهایی N و همچنین در دومینهای کروی خود هستند. چنین تغییراتی عبارتند از متیلاسیون، سیترولیناسیون، استیلاسیون، فسفوریلاسیون، SUMOylation، ubiquitination و ADP-ribosylation. این تغییرات بر عملکرد تنظیم ژن آنها تأثیر میگذارند.
به طور کلی، ژنهایی که فعال هستند، هیستونهای محدودتری دارند، در حالی که ژنهای غیرفعال در طول اینترفاز به شدت با هیستونها مرتبط هستند. همچنین به نظر میرسد که ساختار هیستونها از نظر تکاملی حفظ شده است زیرا هر گونه جهش مضر در این پروتئینها به شدت ناسازگار خواهد بود. تمام هیستونها دارای یک پایانه یا ترمینال N با بار مثبت بالا با تعداد زیادی از بقایای لیزین و آرژنین هستند.
تکامل و توزیع گونهها
هیستونهای هستهای در هسته سلولهای یوکاریوتی و در بیشتر فیلاهای آرکئال (Archaeal phyla) یافت میشوند اما در باکتریها وجود ندارد. با این حال، هیستونهای پیوند دهنده (لینکر) در باکتریها همولوگ دارند. قبلا تصور میشد که جلبکهای تک سلولی شناخته شده به عنوان دینوفلاژلات (dinoflagellate) تنها یوکاریوتهایی هستند که به طور کامل فاقد هیستون میباشند. با این حال، مطالعات بعدی نشان داد که DNA آنها همچنان ژنهای هیستون را رمزگذاری میکند. برخلاف هیستونهای هستهای، پروتئینهای هیستون پیوند دهنده غنی از لیزین (H1) در باکتریها یافت میشوند که در غیر این صورت به عنوان نوکلئوپروتئین HC1/HC2 شناخته میشوند.
پیشنهاد شده است که پروتئینهای هیستون از نظر تکاملی به بخش مارپیچی دومین AAA+ گسترش یافته ATPase، دومین C و به دومین تشخیص سوبسترا N-ترمینال پروتئینهای Clp/Hsp100 مرتبط هستند. علیرغم تفاوت در توپولوژی آنها، این سه تاخوردگی دارای یک موتیف همولوگ مارپیچ-رشته-مارپیچ (HSH) میباشند.
هیستونهای باستانی (Archaeal histone) ممکن است شبیه پیش سازهای تکاملی هیستونهای یوکاریوتی باشند. علاوه بر این، هیستونهای نوکلئوزومی(هستهای) ممکن است از پروتئینهای ریبوزومی (RPS6/RPS15) تکامل یافته باشند که با آنها اشتراکات زیادی دارند؛ هر دو پروتئین کوتاه و پایهای هستند. پروتئینهای هیستون از جمله پروتئینهای بسیار حفاظت شده در یوکاریوتها هستند که بر نقش مهم آنها در زیستشناسی هسته تأکید میکنند. در مقابل، سلولهای اسپرم بالغ عمدتاً از پروتامینها (protamines) برای بسته بندی DNA ژنومی خود استفاده میکنند، به احتمال زیاد به این دلیل که این امر به آنها اجازه میدهد تا شکل بهتری از بسته بندی و متراکم سازی DNA را به دست آورند.
در برخی از کلاسهای اصلی، فرمهای متنوعی وجود دارد. آنها همسانی توالی اسید آمینه و شباهت ساختاری هسته را با یک کلاس خاص از هیستونهای اصلی دارند اما ویژگی خاص خود را نیز دارند که از هیستونهای اصلی متمایز است. این هیستونهای جزئی معمولاً وظایف خاصی از متابولیسم کروماتین را انجام میدهند. به عنوان مثال، CENPA مانند هیستون H3 تنها با ناحیه سانترومر کروموزوم مرتبط است. هیستون H2A نوع H2A.Z با محرکهای ژنهای رونویسی فعال مرتبط است و همچنین در جلوگیری از گسترش هتروکروماتین خاموش نقش دارد. علاوه بر این، H2A.Z نقشی در کروماتین برای ثبات ژنوم دارد. نوع دیگری از H2A هیستونها، H2A.X در S139 در نواحی اطراف شکستگیهای دو رشتهای فسفریله میشود و ناحیه تحت ترمیم DNA را مشخص میکند. هیستون H3.3 با بدنه ژنهای فعال رونویسی شده مرتبط است.
نقش و عملکرد
فشرده سازی رشتههای DNA
هیستونها به عنوان قرقرههایی عمل میکنند که DNA به دور آنها میپیچد. این امر فشردگی لازم را برای جا دادن ژنوم بزرگ یوکاریوتها در داخل هسته سلولی امکان پذیر میکند: مولکول متراکم شده 40000 بار کوتاه تر از یک مولکول بسته بندی نشده است.
تنظیم کروماتین
هیستونها تحت تغییرات پس از ترجمه قرار میگیرند که برهمکنش آنها را با DNA و پروتئینهای هستهای تغییر میدهد. هیستونهای H3 و H4 دارای دمهای بلندی هستند که از نوکلئوزوم بیرون زدهاند و میتوانند به صورت کووالانسی در چندین مکان اصلاح شوند. تغییرات دم شامل متیلاسیون، استیلاسیون، فسفوریلاسیون، یوبی کوئیتیناسیون، SUMOylation، سیترولیناسیون و ADP-ribosylation میباشد. هسته هیستونهای H2A و H2B نیز قابل اصلاح است. تصور میشود که ترکیبی از تغییرات یک کد را تشکیل میدهند که به اصطلاح «کد هیستون» نامیده میشود. تغییرات هیستون در فرآیندهای بیولوژیکی متنوعی مانند تنظیم ژن، ترمیم DNA، تراکم کروموزوم (میتوز) و اسپرماتوژنز (میوز) نقش دارند.
نام گذاری رایج اصلاحات هیستون عبارت است از:
- نام هیستون (به عنوان مثال، H3)
- مخفف اسید آمینه تک حرفی (به عنوان مثال، K برای لیزین) و موقعیت اسید آمینه در پروتئین
- نوع اصلاح (Me: متیل، P: فسفات، Ac: استیل، Ub: یوبیکوئیتین)
- تعداد تغییرات (فقط Me شناخته شده است که در بیش از یک نسخه در هر باقی مانده رخ میدهد. 1، 2 یا 3 تک، دی یا سه متیلاسیون است)
بنابراین H3K4me1 نشان دهنده تک متیلاسیون چهارمین باقی مانده (یک لیزین) از ابتدا (یعنی N-ترمینال) پروتئین H3 است.
تغییرات و اصلاحات
کاتالوگ عظیمی از تغییرات هیستون توصیف شده است اما هنوز از اکثر آنها درک عملکردی وجود ندارد. در مجموع، تصور میشود که اصلاحات هیستونی ممکن است زیر بنای کد هیستون باشد و به موجب آن ترکیبی از تغییرات هیستون معانی خاصی دارد. با این حال، بیشتر دادههای عملکردی مربوط به تغییرات برجسته هیستون منفرد است که از نظر بیوشیمیایی قابل مطالعه دقیق هستند.
علم شیمی
متیلاسیون لیزین (Lysine methylation)
افزودن یک، دو یا چند گروه متیل به لیزین تأثیر کمی بر خواص شیمیایی هیستون دارد. متیلاسیون بار لیزین را دست نخورده باقی میگذارد و تعداد حداقلی اتم را اضافه میکند، بنابراین بر هم کنشهای فضایی عمدتاً بیتأثیر هستند. با این حال، پروتئینهای حاوی دومینهای Tudor، کرومو یا PHD، در مقابل سایرین، میتوانند متیلاسیون لیزین را با حساسیت فوق العاده تشخیص دهند و مونو، دی و تری متیل لیزین را تا حدی متمایز کنند. به نظر میرسد برای برخی از لیزینها (مانند H4K20) مونو، دی و تری متیلاسیون معانی مختلفی دارد. به همین دلیل، متیلاسیون لیزین یک علامت بسیار پر معنی است و بر عملکردهای شناخته شده اصلاح هیستون نقش اساسی دارد.
سروتونیلاسیون گلوتامین (Glutamine serotonylation)
اخیراً نشان داده شده است که افزودن یک گروه سروتونین به موقعیت 5 گلوتامین H3 در سلولهای سروتونرژیک (serotonergic) مانند نورونها اتفاق میافتد. این پدیده بخشی از تمایز سلولهای سروتونرژیک است. این اصلاح پس از ترجمه در ارتباط با اصلاح H3K4me3 اتفاق میافتد. سروتونیلاسیون اتصال فاکتور رونویسی عمومی TFIID به جعبه TATA (TATA box) را تقویت میکند.
متیلاسیون آرژنین (Arginine methylation)
آنچه در بالا درباره شیمی متیلاسیون لیزین گفته شد در مورد متیلاسیون آرژنین نیز صدق میکند و برخی از دومینهای پروتئینی – به عنوان مثال، دومینهای Tudor – میتوانند به جای متیل لیزین برای متیل آرژنین خاص باشند. آرژنین به عنوان تک یا دی متیله شناخته شده است و متیلاسیون میتواند متقارن یا نامتقارن باشد (این متیلاسیونها به طور بالقوه دارای معانی متفاوتی هستند).
سیترولیناسیون آرژنین (Arginine citrullination)
آنزیمهایی به نام پپتیدیل آرژینین دیمینازها (PADs) گروه ایمین آرژنینها را هیدرولیز میکنند و یک گروه کتو (keto) را متصل میکنند؛ به طوری که یک بار مثبت کمتر بر روی باقی مانده اسید آمینه وجود دارد. این فرآیند در فعال سازی بیان ژن با ایجاد پیوند محکمتر هیستونهای اصلاح شده به DNA و در نتیجه دسترسی بیشتر کروماتین نقش داشته است. PADها همچنین میتوانند با حذف یا مهار تک متیلاسیون باقی ماندههای آرژنین روی هیستونها و در نتیجه مخالفت با اثر مثبت متیلاسیون آرژنین بر روی فعالیت رونویسی، اثر معکوس ایجاد کنند.
استیلاسیون لیزین (Lysine acetylation)
افزودن یک گروه استیل تأثیر شیمیایی عمدهای بر لیزین دارد زیرا بار مثبت را خنثی میکند. این امر جاذبه الکترواستاتیکی بین هیستون و ستون فقرات DNA با بار منفی را کاهش میدهد و ساختار کروماتین را ضعیف میکند. هیستونهای بسیار استیله شده کروماتین قابل دسترستری را تشکیل میدهند و تمایل دارند با رونویسی فعال مرتبط باشند. به نظر میرسد استیلاسیون لیزین از نظر معنی دقیق تر از متیلاسیون است، زیرا استیل ترانسفرازهای هیستون تمایل دارند روی بیش از یک لیزین عمل کنند. احتمالاً این پدیده نشان دهنده نیاز به تغییر چندین لیزین برای تأثیر قابل توجهی بر ساختار کروماتین است. این اصلاح در H3K27ac رخ میدهد.
فسفوریلاسیون سرین / ترئونین / تیروزین (Serine/threonine/tyrosine phosphorylation)
افزودن یک گروه فسفات با بار منفی میتواند منجر به تغییرات عمدهای در ساختار پروتئین شود که منجر به ایجاد نقش مشخص فسفوریلاسیون در کنترل عملکرد پروتئین میگردد. مشخص نیست که فسفوریلاسیون هیستون چه پیامدهای ساختاری دارد اما فسفوریلاسیون هیستون عملکردهای واضحی به عنوان یک اصلاح پس از ترجمه دارد و حوزههای اتصال مانند BRCT در این زمینه مشخص شده اند.
اثرات بر رونویسی
اکثر اصلاحات هیستون که به خوبی مطالعه شده اند در کنترل رونویسی نقش دارند.
ژنهایی که به طور فعال رونویسی میشوند
دو اصلاح هیستون به طور ویژه با رونویسی فعال مرتبط است:
تری متیلاسیون H3 لیزین 4 (H3K4me3)
این تری متیلاسیون در پروموتر ژنهای فعال رخ داده و توسط کمپلکس COMPASS انجام میشود. با وجود حفظ این کمپلکس و اصلاح هیستون از مخمر به پستانداران، کاملاً مشخص نیست که این اصلاح چه نقشی ایفا میکند. با این حال، این یک علامت عالی از پروموتورهای فعال است و سطح این اصلاح هیستون در پروموتر ژن به طور گسترده با فعالیت رونویسی ژن در ارتباط میباشد. شکل گیری این وضعیت به روشی نسبتاً پیچیده با رونویسی گره خورده است:
در اوایل رونویسی یک ژن، RNA پلیمراز II دچار تغییری از مرحله شروع تا طولانی شدن میشود که با تغییر در حالتهای فسفوریلاسیون دومین پایانی RNA پلیمراز II C (CTD) مشخص میشود. همان آنزیمی که CTD را فسفریله میکند، کمپلکس Rad6 را نیز فسفریله میکند که به نوبه خود علامت یوبیکوئیتین را به H2B K123 (K120 در پستانداران) اضافه میکند. H2BK123Ub در سراسر نواحی رونویسی شده رخ میدهد اما این علامت برای COMPASS برای تری متیله کردن H3K4 در پروموترها لازم است.
تری متیلاسیون H3 لیزین 36 (H3K36me3)
این تری متیلاسیون در بدنه ژنهای فعال رخ میدهد و توسط متیل ترانسفراز Set2 ایجاد میشود. این پروتئین با طویل شدن RNA پلیمراز II مرتبط است و H3K36Me3 نشان دهنده ژنهای رونویسی فعال است. H3K36Me3 توسط کمپلکس هیستون داستیلاز Rpd3 شناسایی میشود که تغییرات استیل را از هیستونهای اطراف حذف میکند، تراکم کروماتین را افزایش میدهد و رونویسی کاذب را سرکوب میکند. افزایش تراکم کروماتین از دسترسی عوامل رونویسی به DNA جلوگیری میکند و احتمال شروع رویدادهای رونویسی جدید در بدنه ژن را کاهش میدهد. بنابراین این فرآیند کمک میکند تا اطمینان حاصل شود که رونویسی متوقف نمیشود.
ژنهای سرکوب شده (Repressed genes)
سه تغییر هیستون به طور ویژه با ژنهای سرکوب شده مرتبط است:
تری متیلاسیون H3 لیزین 27 (H3K27me3)
این اصلاح هیستون توسط کمپلکس پلی کامب PRC2 ایجاد میشود. این پدیده یک نشانگر واضح از سرکوب ژن است و احتمالاً به پروتئینهای دیگری برای اعمال یک عملکرد سرکوب کننده متصل میشود. یک کمپلکس پلیکامب دیگر، PRC1، میتواند به H3K27me3 متصل شده و اصلاح هیستونی H2AK119Ub را اضافه کند که به تراکم کروماتین کمک میکند. بر اساس این دادهها به نظر میرسد که PRC1 از طریق عمل PRC2 به کار گرفته میشود. با این حال، مطالعات اخیر نشان میدهد که PRC1 در غیاب PRC2 در همان قسمتها به کار گرفته میشود.
دی و تری متیلاسیون H3 لیزین 9 (H3K9me2/3)
H3K9me2/3 یک نشانگر خوب و مشخص برای هتروکروماتین است و بنابراین به شدت با سرکوب ژن مرتبط است. تشکیل هتروکروماتین به بهترین وجه در مخمر Schizosaccharomyces pombe مورد مطالعه قرار گرفته است، جایی که این پدیده با به کارگیری کمپلکس خاموشی رونویسی القا شده با RNA (RITS) به RNAهای دو رشتهای تولید شده از تکرارهای سانترومریک، آغاز میشود. RITS متیل ترانسفراز هیستون Clr4 را جذب میکند که H3K9me2/3 را رسوب میکند. این فرآیند متیلاسیون هیستون نامیده میشود. H3K9Me2/3 به عنوان یک محل اتصال برای جذب Swi6 (پروتئین هتروکروماتین 1 یا HP1، یکی دیگر از نشانگرهای هتروکروماتین کلاسیک) عمل میکند که به نوبه خود فعالیتهای سرکوبگر بیشتری از جمله اصلاح کنندههای هیستون مانند هیستون داستیلازها و هیستون متیل ترانسفرازها را به خدمت میگیرد.
تری متیلاسیون H4 لیزین 20 (H4K20me3)
این اصلاح به شدت با هتروکروماتین مرتبط است. اگرچه اهمیت عملکردی آن نامشخص است. این علامت توسط متیل ترانسفراز Suv4-20h بوجود میآيد که حداقل تا حدی توسط پروتئین هتروکروماتین 1 جذب میشود.
پروموتورهای دو ظرفیتی (Bivalent promoters)
تجزیه و تحلیل تغییرات هیستون در سلولهای بنیادی جنینی (و سایر سلولهای بنیادی) نشان داد که بسیاری از پروموتورهای ژنی حامل H3K4Me3 و H3K27Me3 هستند. به عبارت دیگر این پروموتورها علائم فعال کننده و سرکوب کننده را به طور همزمان نشان میدهند. این ترکیب عجیب و غریب از تغییرات، ژنهایی را که آماده رونویسی هستند، نشان میدهد. آنها در سلولهای بنیادی مورد نیاز نیستند اما پس از تمایز به برخی گروه از سلولها به سرعت مورد نیاز هستند. هنگامی که سلول شروع به تمایز میکند، این پروموتورهای دو ظرفیتی بسته به گروه انتخابی به حالت فعال یا سرکوبگر تبدیل میشوند.
عملکردهای دیگر
آسیب DNA
علامت گذاری مکانهای آسیب DNA یک عملکرد مهم برای تغییرات هیستون (histone modifications) است. هیستونها همچنین از DNA در برابر تخریب اشعه ماوراء بنفش خورشید محافظت میکنند.
فسفوریلاسیون H2AX در سرین 139 (γH2AX)
H2AX فسفریله شده (همچنین به عنوان گاما H2AX شناخته میشود) نشانگری برای شکستگی دو رشته DNA است و بخشی از پاسخ به آسیب DNA را تشکیل میدهد. H2AX در اوایل پس از تشخیص شکستگی دو رشته DNA، فسفریله میشود و دومینی را بوجود میآورد که تعداد زیادی کیلو باز را در دو طرف آسیب گسترش میدهد. گاما H2AX به عنوان یک محل اتصال برای پروتئین MDC1 عمل میکند که به نوبه خود پروتئینهای کلیدی ترمیم DNA را به خدمت میگیرد و به این ترتیب، گاما H2AX بخش مهمی از ماشینی را تشکیل میدهد که پایداری ژنوم را تضمین میکند.
استیلاسیون H3 لیزین 56 (H3K56Ac)
H3K56Acx برای پایداری ژنوم مورد نیاز است. H3K56 توسط کمپلکس p300/Rtt109 استیله میشود. این نوع از هیستونها به سرعت در اطراف محلهای آسیب DNA استیله میشوند. استیله شدن H3K56 همچنین برای تثبیت کمپلکسهای چنگال مانند همانند سازی (replication fork) متوقف شده و جلوگیری از فروپاشی خطرناک این چنگالهای همانند سازی مورد نیاز است. اگرچه به طور کلی پستانداران بیشتر از میکروارگانیسمها از تغییرات هیستون استفاده میکنند، نقش اصلی H3K56Ac در تکثیر DNA فقط در قارچها وجود دارد و این به هدفی برای توسعه آنتی بیوتیکها تبدیل شده است.
ترمیم DNA
تری متیلاسیون H3 لیزین 36 (H3K36me3)
H3K36me3 توانایی جذب مجموعه MSH2-MSH6 (hMutSα) در مسیر ترمیم عدم تطابق DNA را دارد. به طور مداوم، مناطقی از ژنوم انسان با سطوح بالای H3K36me3 جهشهای سوماتیک کمتری را به دلیل فعالیت ترمیم ناهماهنگی در خود جای میدهند.
تراکم کروموزوم
فسفوریلاسیون H3 در سرین 10 (فسفو-H3S10)
میتوزیک کیناز B هیستون aurora H3 را در سرین 10 فسفریله میکند و باعث ایجاد یک آبشار از تغییرات میشود که واسطه ایجاد تراکم کروموزوم میتوزی است. بنابراین کروموزومهای متراکم به دلیل داشتن این علامت به طور بسیار قوی رنگ پذیر میشوند اما فسفوریلاسیون H3S10 نیز در مکانهای کروموزوم خاصی خارج از میتوز وجود دارد، به عنوان مثال در هتروکروماتین دور مرکز سلولها در طول G2. فسفوریلاسیون H3S10 همچنین با آسیب DNA ناشی از تشکیل حلقه R در مکانهای بسیار رونویسی شده مرتبط است.
فسفوریلاسیون H2B در سرین 10/14 (فسفو-H2BS10/14)
فسفوریلاسیون H2B در سرین 10 (مخمر) یا سرین 14 (پستانداران) نیز با تراکم کروماتین مرتبط است اما برای هدف بسیار متفاوتی که واسطه ایجاد تراکم کروموزوم در طول آپوپتوز است. این علامت صرفاً در آپوپتوز اثر دیررس ندارد زیرا مخمرهای حامل جهشهای این باقیمانده در برابر مرگ سلولی آپوپتوز ناشی از پراکسید هیدروژن مقاوم هستند.
اعتیاد
تغییرات اپی ژنتیکی دم هیستون در نواحی خاصی از مغز از اهمیت اساسی در اعتیاد برخوردار است. هنگامی که تغییرات اپی ژنتیکی خاص رخ میدهد، به نظر میرسد که آنها “اسکارهای (زخمهای) مولکولی” طولانی مدت هستند که ممکن است دلیل تداوم اعتیاد باشند.
افراد سیگاری (حدود 15 درصد از جمعیت ایالات متحده) معمولاً به نیکوتین معتاد هستند. پس از 7 روز قرار گرفتن موشها در معرض با نیکوتین، استیلاسیون هیستون H3 و هیستون H4 در پروموتور FosB در هسته اکومبنس (nucleus accumbens) مغز افزایش یافت و باعث افزایش 61 درصدی در بیان FosB شد. این پدیده همچنین بیان نوع اتصالی Delta FosB را افزایش میدهد. در هسته اکومبنس مغز، Delta FosB به عنوان یک “سوئیچ مولکولی پایدار” و “پروتئین کنترل اصلی” در ایجاد اعتیاد عمل میکند.
حدود 7 درصد از جمعیت ایالات متحده به الکل معتاد هستند. در موشهایی که تا 5 روز در معرض الکل قرار گرفتند، افزایش استیلاسیون هیستون 3 لیزین 9 در پروموتور پرونوسیسپتین (pronociceptin promoter) در کمپلکس آمیگدال (amygdala complex) مغز مشاهده شد. این استیلاسیون یک علامت فعال کننده برای پرونوسیسپتین است. سیستم گیرنده مواد مخدر nociceptin/nociceptin در اثرات تقویت کننده یا واکنشی الکل نقش دارد.
اعتیاد به متامفتامین (Methamphetamine) در حدود ۲/۰ درصد از جمعیت ایالات متحده رخ میدهد. استفاده مزمن متامفتامین باعث متیلاسیون لیزین در موقعیت 4 هیستون 3 میشود که در پروموتورهای ژنهای c-fos و گیرنده کموکاین C-C 2 (ccr2) قرار دارد و این ژنها را در هسته اکومبنس (NAc) فعال میکند. c-fos به خوبی شناخته شده و مشخص شده است که در اعتیاد حائز اهمیت میباشد. ژن ccr2 نیز در اعتیاد مهم است زیرا غیر فعال سازی جهشی این ژن، اعتیاد را مختل میکند.
سنتز
اولین مرحله از همانند سازی ساختار کروماتین، سنتز پروتئینهای هیستون است: H1، H2A، H2B، H3، H4. این پروتئینها در فاز S چرخه سلولی سنتز میشوند. مکانیسمهای مختلفی وجود دارد که به افزایش سنتز هیستون کمک میکند.
مخمر
مخمر حامل یک یا دو نسخه از هر ژن هیستون است که به صورت خوشهای (در کنار یکدیگر بودن) نیستند، بلکه در سراسر کروموزومها پراکنده شده اند. رونویسی ژن هیستون توسط چندین پروتئین تنظیم کننده ژن مانند فاکتورهای رونویسی که به نواحی پروموتور هیستون متصل میشوند، کنترل میشود. در مخمر جوانه زن (budding yeast)، ژن کاندید برای فعال سازی بیان ژن هیستون SBF است. SBF یک فاکتور رونویسی است که در اواخر فاز G1، زمانی که از رپرسور Whi5 (repressor Whi5) خود جدا میشود، فعال میشود. این زمانی اتفاق میافتد که Whi5 توسط Cdc8 فسفریله شود که خود یک Cdk G1/S است. سرکوب بیان ژن هیستون در خارج از فاز S وابسته به پروتئینهای Hir است که ساختار کروماتین غیر فعال را در محل ژنهای هیستون تشکیل داده و باعث مسدود شدن فعال کنندههای رونویسی میشوند.
متازوئن (Metazoan)
در متازوئنها، افزایش سرعت سنتز هیستون به دلیل افزایش پردازش pre-mRNA به شکل بالغ آن و همچنین کاهش در تخریب mRNA است. این اتفاق منجر به افزایش mRNA فعال برای ترجمه پروتئینهای هیستون میشود. مشخص شده است که مکانیسم فعالسازی mRNA شامل حذف بخشی از انتهای 3′ رشته mRNA است و به ارتباط با پروتئین اتصال به حلقه ساقه (SLBP) بستگی دارد. SLBP همچنین mRNAهای هیستونی را در طول فاز S با مسدود کردن تخریب توسط هسته 3’hExo تثبیت میکند. سطح SLBP توسط پروتئینهای چرخه سلولی کنترل میشود. این کنترل باعث میشود SLBP با ورود سلولها به فاز S تجمع پیدا کند و با خروج سلولها از فاز S تجزیه شود. SLBP برای تخریب شدن به واسطه فسفوریلاسیون در دو باقی مانده ترئونین توسط کینازهای وابسته به سیکلین (cyclin)، احتمالاً سیکلین A/cdk2، در انتهای فاز S نشاندار میشوند.
متازوئنها همچنین دارای نسخههای متعددی از ژنهای هیستون هستند که روی کروموزومها قرار گرفتهاند. این کروموزومها که در ساختارهایی به نام اجسام کژال (Cajal bodies) قرار گرفتهاند که توسط تجزیه و تحلیلهای جمعآوری شده از ترکیب کروموزوم در سطح ژنوم تعیین میشوند (4C-Seq).
ارتباط بین کنترل چرخه سلولی و سنتز
پروتئین هستهای آتاکسی تلانژکتازی (NPAT) که به عنوان فعال کننده پروتئین هستهای رونویسی هیستون نیز شناخته میشود، یک فاکتور رونویسی است که رونویسی ژن هیستون را بر روی کروموزومهای 1 و 6 سلولهای انسانی فعال میکند. NPAT همچنین یک بستر سیکلین E-Cdk2 است که برای انتقال بین فاز G1 و فاز S مورد نیاز است. NPAT بیان ژن هیستون را تنها پس از فسفریله شدن توسط سیکلین G1/S-Cdk E-Cdk2 در فاز S اولیه فعال میکند.
تاریخچه
هیستونها در سال 1884 توسط آلبرشت کوسل (Albrecht Kossel) کشف شدند. قدمت کلمه “هیستون” به اواخر قرن نوزدهم میرسد و از کلمه آلمانی “Histon” گرفته شده است. کلمه ای که خود منشأ نامشخصی دارد.
در اوایل دهه 1960، قبل از اینکه انواع هیستونها شناخته شوند و قبل از اینکه هیستونها در بین ارگانیسمهای دارای تنوع طبقه بندی به شدت حفاظت شوند، جیمز اف. بونر (James F. Bonner) و همکارانش مطالعهای را روی این پروتئینها آغاز کردند که مشخص بود ارتباط تنگاتنگی با DNA موجود در هسته ارگانیسمهای برتر دارند. بونر و همکار فوق دکتری او Ru Chih C. Huang نشان دادند که کروماتین جدا شده از سلول از رونویسی RNA در لوله آزمایش پشتیبانی نمیکند اما اگر هیستونها از این کروماتین استخراج شوند، RNA میتواند از DNA باقیمانده رونویسی شود. مقاله آنها به یک استناد کلاسیک تبدیل شد. پل تسو (Paul T’so) و جیمز بونر در سال 1964 کنگره جهانی شیمی و زیست شناسی هیستون را تشکیل داده بودند که در آن مشخص شد که در مورد تعداد انواع هیستون اتفاق نظر وجود ندارد و هیچ کس نمیداند که این پروتئینها را با جدا شدن از اورگانیسمهای مختلف میتوان مقایسه کرد. بونر و همکارانش سپس روشهایی را برای جدا سازی هر نوع هیستون توسعه دادند، هیستونهای منفرد را خالص سازی کردند، ترکیبهای اسید آمینهای موجود در یک هیستون مشابه را در موجودات مختلف و توالیهای اسید آمینه یک هیستون مشابه را در ارگانیسمهای مختلف با همکاری امیل اسمیت (Emil Smith) از UCLA مقایسه کردند. به عنوان مثال، آنها دریافتند که توالی هیستون IV بین نخود و تیموس گوساله بسیار حفظ شده است. با این حال، کار آنها بر روی ویژگیهای بیوشیمیایی هیستونهای منفرد نتوانست نشان دهد که چگونه هیستونها با یکدیگر یا با DNA که به شدت به آن متصل بودند، برهمکنش میکنند.
همچنین در دهه 1960، وینسنت آلفری (Vincent Allfrey) و آلفرد میرسکی (Alfred Mirsky)، بر اساس تجزیه و تحلیلهای خود از هیستونها پیشنهاد کردند که استیلاسیون و متیلاسیون هیستونها میتواند مکانیسم کنترل رونویسی را ارائه دهد. با این وجود، آنها آن نوع تجزیه و تحلیل دقیقی را که محققان بعدی برای نشان دادن اینکه چگونه چنین مقرراتی میتواند مختص ژن باشد، قادر به انجام آن بودند، در دسترس نداشتند. تا اوایل دهه 1990، هیستونها توسط اکثر افراد به عنوان مواد بسته بندی بی اثر برای DNA هسته یوکاریوتی رد میشدند، دیدگاهی که تا حدی بر اساس مدلهای مارک پتاشن (ark Ptashne) و دیگر افراد است. آنها معتقد بودند که رونویسی در واقع توسط برهمکنشهای پروتئین-DNA و پروتئین-پروتئین بر الگوهای DNA برهنه، همانطور که در باکتریها وجود دارد تا حد زیادی فعال میشود.
در طول دهه 1980، Yahli Lorch و Roger Kornberg نشان دادند که یک نوکلئوزوم روی یک پروموتور هسته از شروع رونویسی در شرایط آزمایشگاهی جلوگیری میکند و Michael Grunstein نشان داد که هیستونها رونویسی را در داخل بدن سرکوب میکنند. این اتفاق منجر به ایجاد این ایده شد که نوکلئوزوم به عنوان یک سرکوب کننده ژن عمومی عمل میکند. اعتقاد بر این است که مکانیسم رهایی از این سرکوب شامل اصلاح هیستون و عمل کمپلکسهای بازسازی کروماتین میشود. وینسنت آلفری و آلفرد میرسکی قبلاً نقش اصلاح هیستون را در فعال سازی رونویسی پیشنهاد کرده بودند که به عنوان تظاهرات مولکولی اپی ژنتیک (molecular manifestation of epigenetics) در نظر گرفته میشود. مایکل گرونشتاین (Michael Grunstein) و دیوید آلیس (David Allis) از این پیشنهاد – اهمیت استیلاسیون هیستون برای رونویسی در مخمر و فعالیت فعال کننده رونویسی Gcn5 به عنوان یک هیستون استیل ترانسفراز – حمایت کردند.
به نظر میرسد که تاریخ کشف هیستون H5 به دهه 1970 برمیگردد که اکنون به عنوان ایزوفرم (isoform) هیستون H1 در نظر گرفته میشود.
مترجم: فاطمه فریادرس