اطلاعات عمومی, ویکی ژن
کلستاز چیست؟
کلستاز چیست؟
کلستاز یک بیماری کبدی است و زمانی اتفاق می افتد که جریان صفرا از کبد کاهش یافته یا مسدود شود. صفرا مایعی است که توسط کبد تولید می شود و به هضم غذا، به ویژه چربی ها کمک می کند. وقتی جریان صفرا تغییر کند ، می تواند منجر به تجمع بیلی روبین شود. بیلی روبین رنگدانه ای است که توسط کبد تولید می شود و از طریق صفرا از بدن دفع می شود.
کلستاز دو نوع است:
- کلستاز داخل کبدی
- کلستاز خارج کبدی
کلستاز داخل کبدی از کبد سرچشمه می گیرد که علت آن می تواند موارد زیر باشد:
- بیماری
- عفونت
- مصرف دارو
- ناهنجاری های ژنتیکی
- اثرات هورمونی برجریان صفرا
- همچنین بارداری نیز می تواند خطر ابتلا به این بیماری را افزایش دهد.
کلستاز خارج کبدی در اثر وجود مانع فیزیکی در مجاری صفراوی ایجاد می شود. انسداد در مواردی مانند سنگ صفرا ، کیست و تومور، جریان صفرا را محدود می کند.
القای کلستاز در موش
در اکثر مهره داران، کبد صفرا تولید می کند که برای امولسیون سازی چربی های جذب شده و امکان هضم لیپیدها در روده کوچک و همچنین دفع بیلی روبین و سایر محصولات متابولیکی ضروری است. در کبد، انسداد آزمایشی سیستم صفراوی خارج کبدی یک آبشار پیچیده از حوادث پاتولوژیک را ایجاد می کند که منجر به کلستاز و التهاب می شود و در نتیجه یک واکنش فیبروتیک قوی ناشی از زمینه های اطراف پورتال ایجاد می شود.
بنابراین، جراحی بستن مجرای صفراوی رایج ترین الگویی است که برای القای آسیب انسدادی کلستاتیک در جوندگان و مطالعه رویدادهای سلولی و مولکولی که زمینه ساز این مکانیسم های پاتوفیزیولوژیک ناشی از جریان نامناسب صفرا است، شده است.
در سالهای اخیر، روشهای جراحی مختلفی توصیف شده است که به شما امکان اتصال مجدد یا ریاناستوموز بعد از بستن مجاری صفراوی (BDL) را می دهد؛ به عنوان مثال، BDL جزئی یا سایر روشهای جراحی برای تحقیقات خاص .
با این حال، متداول ترین مدل، انسداد کامل مجرای صفراوی مشترک است که پس از 21 تا 28 روز پاسخ فیبروتیک قوی ایجاد می کند. میزان مرگ و میر می تواند به دلیل عوارض عفونی یا عدم دقت فنی ، بالا باشد.
فیبروز کبدی به عنوان تولید بیش از حد و تجمع ماتریکس خارج سلولی (ECM) تعریف می شود که از یک شبکه پیچیده از فعل و انفعالات سلولهای ستاره ای کبدی تولید کننده ماتریس و طیف گسترده ای از سلولهای نفوذکننده خون و سلول های ساکن کبد میباشد.
اگرچه فیبروز کبدی می تواند توسط انبوهی از محرک های مختلف ایجاد شود اما مکانیسم های مولکولی زمینه ساز فیبروز به طور کلی بسیار شبیه هستند. به دنبال آسیب کبدی، برنامه ای کاملاً هماهنگ از تغییرات سلولی و مولکولی آغاز می شود. در این برنامه یک تعامل نزدیک بین سیگنال های التهابی، مونوسیت ها / ماکروفاژها و سلول های ستاره ای کبدی رخ می دهد که در پایان منجر به فعال شدن سلول های ستاره ای و انتقال آن به میوفیبروبلاست ها رسوب ECM و تغییرات آناتومیکی و عملکردی یکپارچگی بافت کبدی می شود.
فعال شدن سلولهای ستاره ای کبد به ویژه توسط سیگنالهای التهابی و فعل و انفعالات با ماکروفاژهای ساکن کبد (یعنی سلولهای کوپفر) هدایت می شود. الگوهای مولکولی مرتبط با پاتوژن توسط گیرنده های تخصصی تشخیص الگو مانند گیرنده های Toll-like که هنگام فعال شدن سیگنال از طریق یک شبکه پیچیده از مسیرهای مختلف باعث بیان و ترشح بسیاری از سیتوکین های التهابی و شیمیکین ها می شوند که روند التهابی را هدایت می کنند.
پاسخ التهابی و خونریزی کبدی ایجاد شده موقتی است تا عامل تولید کننده بیماری برطرف شود. در مقابل، در صورت ادامه آسیب، التهاب مزمن در کبد تکامل یافته و بیان و تجمع ECM در پیش زمینه باعث جایگزینی تدریجی پارانشیم کبدی طبیعی با تشکیل بافت اسکار میشود.
از آنجا که فیبروژنز کبدی در انسان یک مشکل بالینی در سراسر جهان است ، طی دهه های گذشته چندین مدل جوندگان آزمایشی در رابطه با نارسایی حاد و مزمن کبدی مورد آزمایش قرار گرفته است.
به عنوان مثال در سیستم موش، مدلهای معمول عبارتند از: تجویز انواع هپاتوتوکسینهای مختلف ، بستن مجرای صفراوی مشترک ، القای آسیب کبدی با واسطه ایمنی و معرفی هدفمند نقص ژن یا برعکس بیان بیش از حد ژن ها. بر مسیرهای سیگنالینگ حیاتی که در پاتوژنز فیبروز کبدی نقش دارند تأثیر می گذارد.
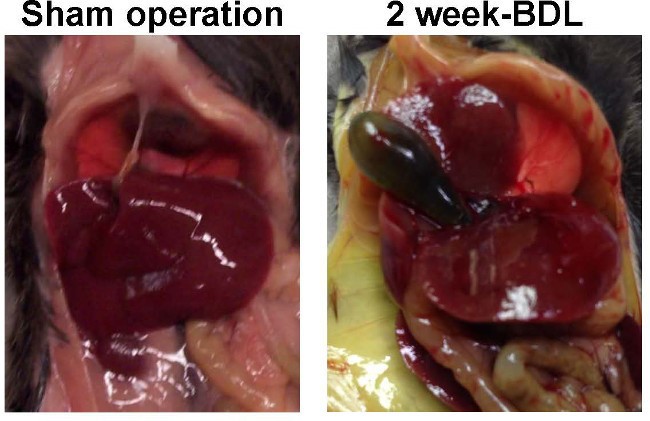
بستن مجرای صفراوی مشترک در جوندگان به عنوان یک روش تجربی در تحقیقات برای سالها انجام شده است. اولین پروتکل قابل تکرار برای بستن طولانی مدت مجاری صفراوی (BDL) در جوندگان در حال حاضر بیش از سه دهه پیش ارائه شده است. در این پروتکل هم کانولاسیون / انسداد و هم بستن باعث ایجاد سیروز در موشهای صحرایی با تغییرات ریختشناختی قابل مقایسه با موارد مشاهده شده در سیروز صفراوی انسانی شد.
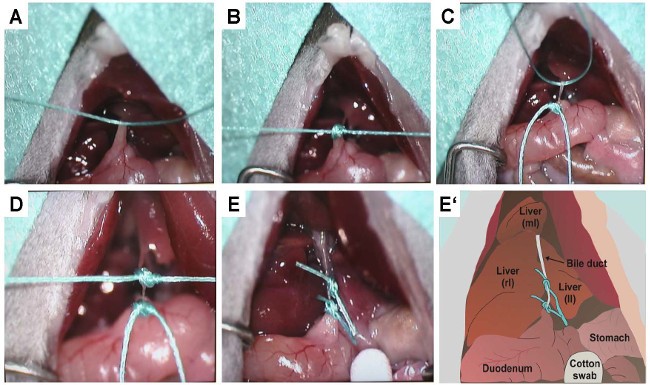
پروتکل مربوطه ساده است، روش جراحی نسبتاً سریع قابل اجراست و میزان زنده ماندن حیوانات با بیش از 95٪ زیاد است. در پروتکل کلاسیک کانولاسیون / انسداد موش صحرایی ، یک برش کوتاه 2 سانتی متری درست در زیر فرایند xiphoid ایجاد می شود.
پس از آن، یک کانول به قسمت پروگزیمال مجرای صفراوی وارد می شود و با بخیه در موقعیت خود ثابت می شود. در مرحله بعدی ، قسمت دیستال کانول با 3 گره انسداد یافته، از انتهای تحتانی برش خط میانی قرار گرفته و به صورت زیر جلدی در ربع پایین سمت راست قرار میگرد. در پایان، شکم بسته شده و حیوانات شروع به بهبودی میکنند. در پروتکل بستن ، موشها تحت دو بند شدن مجرای صفراوی مشترک یا با کالبد شکافی مجرای صفراوی بین لیگاتورها قرار می گیرند.
این مدل آزمایشی در سراسر جهان در صدها آزمایشگاه برای القای کلستاز کبد و فیبروز مورد قبول و استفاده قرار گرفته است. این باعث تکثیر سلولهای اپیتلیال صفراوی داخل کبدی ، تمایز میوفیبروبلاستی فیبروبلاستهای پورتال در اطراف سلولهای اپیتلیال صفراوی در حال تکثیر می شود و در نتیجه یک بیان بسیار گسترده و رسوب ECM ایجاد می شود. بنابراین ، استفاده از این مدل در رت و مایس در میان دانشمندان محبوب است که هدف آنها درک پاتوژنز التهاب کبدی و فیبروز است.
همچنین بخوانید…
خدمات مربوط به حیوانات آزمایشگاهی، ژنیران
دوره کارآموزی کار با حیوانات آزمایشگاهی ژنیران




سلام بنده کبد چرب گرید داشتم…که در سونوگرافی معلوم شد…الان مدتهاست خارش کف سر و پوسته سر و خارش عمومی بدن و مشکل رفلاکس و مشکلات گوارشی دارم امکان داره بیماری کبدم پیشرفت کرده باشه خیلی نگرانم
به پزشک مراجعه کنید
برای خانم 50 ساله با سابقه HTNوDM ویکسال پس از کله سیستکتومی مجددا در مجاری صفراوی سنگ تشکیل شده و سپس باercpسنگها دفع و استنت پلاستیکی در مجرا تعبیه شده. سوال اینست که اینک پس از گذشت سه ماه حتما باید استنت برداشته شود یا میتوان نگه داشت؟ بیمار شکایتی ندارد و درسونوی اخیر سنگ دیده نشده است. قبلا عرض سپاس دارم
بله، استنت پلاستیکی صفراوی باید حتماً پس از حدود ۳ ماه برداشته یا تعویض شود، حتی اگر بیمار بدون علامت باشد.
دلایل:
استنتهای پلاستیکی مستعد انسداد، عفونت (کلانژیت) و تشکیل بیوفیلم یا لجن صفراوی هستند.
باقیماندن بیش از حد توصیهشده (معمولاً ۳ ماه) خطر عوارض جدی دارد، حتی بدون علامت بالینی.
✅ بنابراین:
عدم وجود شکایت، دلیل کافی برای نگهداشتن استنت نیست.
پیشنهاد میشود بیمار جهت ارزیابی مجدد و برداشتن استنت یا تعویض آن ارجاع داده شود.