اطلاعات عمومی
پیوند هیدروژنی
پیوند هیدروژنی چیست؟
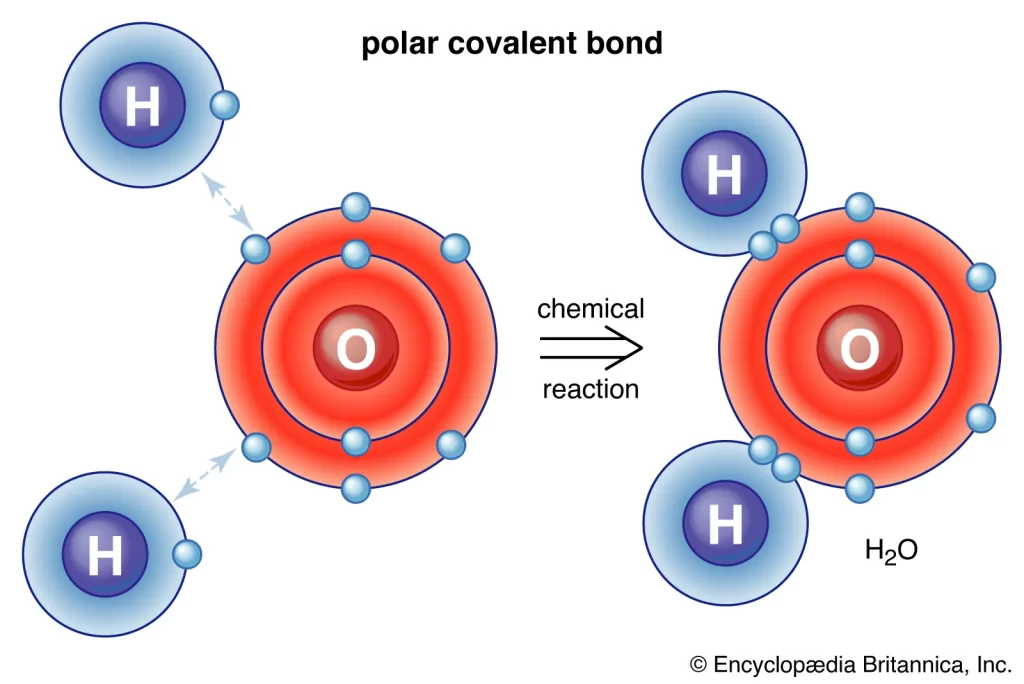
به تشکیل پیوندهای هیدروژنی اشاره دارد که یک گروه ویژه از نیروهای جاذبه بین مولکولی هستند که به دلیل برهمکنش دوقطبی-دوقطبی بین یک اتم هیدروژن که به یک اتم بسیار الکترونگاتیو متصل میشود و یک اتم بسیار الکترونگاتیو دیگر که در مجاور اتم هیدروژن قرار دارد ایجاد میشود. به عنوان مثال، در مولکولهای آب (H2O)، هیدروژن با اتم اکسیژن الکترونگاتیوتر پیوند کووالانسی برقرار میکند. بنابراین، پیوند هیدروژنی در مولکولهای آب به دلیل برهمکنشهای دوقطبی-دوقطبی بین اتم هیدروژن یک مولکول آب و اتم اکسیژن یک مولکول H2O دیگر ایجاد میشود.
جایگاه جفت پیوند الکترونها در پیوند O-H بسیار نزدیک به هسته اکسیژن است (به دلیل اختلاف زیاد در الکترونگاتیویهای اکسیژن و هیدروژن). بنابراین، اتم اکسیژن یک بار جزئی منفی (δ-) و اتم هیدروژن یک بار جزئی مثبت (δ+) ایجاد میکند. اکنون، پیوند هیدروژنی میتواند به دلیل جاذبه الکترواستاتیکی بین اتم هیدروژن یک مولکول آب (با بار δ+) و اتم اکسیژن مولکول آب دیگر (با بار δ-) رخ دهد.
بنابراین، پیوندهای هیدروژنی یک گروه بسیار ویژه از نیروهای جاذبه بین مولکولی هستند که فقط در ترکیبات دارای اتمهای هیدروژنی که به یک اتم بسیار الکترونگاتیو پیوند دارند، ایجاد میشوند. پیوندهای هیدروژنی در مقایسه با دوقطبی-دوقطبی و نیروهای پراکندگی معمولی قوی هستند. با این حال، آنها در مقایسه با پیوندهای کووالانسی یا یونی واقعی ضعیف میباشند.
شرایط تشکیل پیوند هیدروژنی چیست؟
در یک مولکول، وقتی یک اتم هیدروژن به یک اتم بسیار الکترونگاتیو متصل میشود، جفت الکترونهای به اشتراک گذاشته شده را بیشتر جذب میکند و بنابراین در انتهای این مولکولها کمی بار منفی ایجاد شده در حالی که در انتهای دیگرش کمی بار مثبت ایجاد میگردد. انتهای منفی یک مولکول، انتهای مثبت مولکول دیگر را جذب نموده و در نتیجه پیوند ضعیفی بین آنها ایجاد میشود. این پیوند، پیوند هیدروژنی نامیده میشود.
در نتیجه تشکیل پیوند هیدروژنی، یک اتم هیدروژن دو اتم الکترونگاتیو را به طور همزمان، یکی از طریق پیوند کووالانسی و دیگری توسط پیوند هیدروژنی، به هم متصل میکند. شرایط تشکیل پیوند هیدروژنی عبارتند از:
۱. مولکول باید حاوی یک اتم بسیار الکترونگاتیو متصل شده به اتم هیدروژن باشد. هر چه الکترونگاتیوی بیشتر باشد، قطبیت مولکول نیز بیشتر است.
۲. اندازه اتم الکترونگاتیو باید کوچک باشد. هرچه اندازه کوچکتر باشد، جاذبه الکترواستاتیکی نیز بیشتر است.
اثرات پیوند هیدروژنی بر عناصر
تجمع
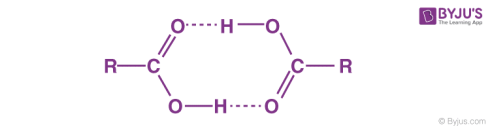
مولکولهای کربوکسیلیک اسید به دلیل پیوند هیدروژنی به صورت دایمر وجود دارند. جرم مولکولی چنین ترکیباتی دو برابر آن چیزی است که از فرمول ساده آنها محاسبه میگردد.
تجزیه
در محلول آبی، HF تجزیه شده و به جای یون فلوراید یون دی فلوراید میدهد. این به دلیل پیوند هیدروژنی موجود در HF است. مولکولهای HCl، HBr، HI پیوند هیدروژنی تشکیل نمیدهند. همین مورد دلیل عدم وجود ترکیباتی مانند KHCl2، KHBr2، KHI2 را توضیح میدهد.
چرا ترکیبات دارای پیوند هیدروژنی نقطه ذوب و جوش بالایی دارند؟
ترکیباتی که پیوند هیدروژنی دارند، نقطه ذوب و جوش غیرعادی بالایی را از خود نشان میدهند. نقطه ذوب و جوش بالای ترکیب حاوی پیوندهای هیدروژنی به این دلیل است که برای شکستن این پیوندها، به مقدار انرژی اضافی نیاز میباشد.
- نقطه جوش غیرمعمول بالای هیدروژن فلوراید در میان اسیدهای هالوژن به دلیل وجود پیوند هیدروژنی است.
- H2O به صورت مایع است در حالی که H2S، H2Se و H2Te همه در دمای معمولی جزو گازها به شمار میآیند. در آب، پیوند هیدروژنی باعث ایجاد پیوندهایی در مولکولهای آب میشود که در نتیجه سبب بالا رفتن نقطه جوش آب نسبت به سایر ترکیبات میگردد.
- آمونیاک نقطه جوش بالاتری نسبت به PH3 دارد، زیرا در NH3 پیوند هیدروژنی وجود دارد، اما در PH3 وجود ندارد.
- اتانول دارای نقطه جوش بالاتری نسبت به دی اتیل اتر است، زیرا در اتانول پیوند هیدروژنی وجود دارد.

نمونههایی از پیوندهای هیدروژنی
پیوند هیدروژنی در هیدروژن فلوراید
فلوئور با حداکثر مقدار الکترونگاتیوی، قویترین پیوند هیدروژنی را تشکیل میدهد.
پیوندهای هیدروژنی در آب
یک مولکول آب حاوی یک اتم اکسیژن بسیار الکترونگاتیو است که به اتم هیدروژن مرتبط است. اتم اکسیژن، جفت الکترونهای به اشتراک گذاشته شده را بیشتر جذب نموده و در انتهای این مولکول بار منفی ایجاد شده در حالی که اتمهای هیدروژن، بار مثبت میگیرند.
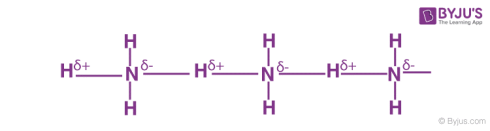
پیوند هیدروژنی در آمونیاک
حاوی اتم بسیار الکترونگاتیو نیتروژن است که به اتمهای هیدروژن متصل میشوند.
پیوند هیدروژنی در الکلها و اسیدکربوکسیلیک
الکل یک مولکول آلی است که حاوی یک گروه OH- است. به طور معمول، اگر هر مولکولی که حاوی اتم هیدروژن است به طور مستقیم به اکسیژن یا نیتروژن متصل شود، پیوند هیدروژنی به راحتی شکل میگیرد.
پیوند هیدروژنی در پلیمرها
پیوند هیدروژنی عامل مهمی در تعیین ساختارها و خواص سه بعدی است که توسط پروتئینهای سنتز شده و طبیعی به دست میآید. پیوندهای هیدروژنی همچنین نقش مهمی در تعریف ساختار سلولز و همچنین پلیمرهای مشتق شده مانند پنبه یا کتان دارند.
استحکام پیوند هیدروژنی
پیوند هیدروژنی یک پیوند ضعیف است. قدرت پیوند هیدروژنی در بین نیروهای ضعیف واندروالس و پیوندهای کووالانسی قوی قرار میگیرد. انرژی تفکیک پیوند هیدروژنی به جاذبه جفت الکترونهای به اشتراک گذاشته شده و در نتیجه به الکترونگاتیوی اتم بستگی دارد.
خواص پیوند هیدروژنی
حلالیت: الکلهای درجه پایینتر به دلیل پیوند هیدروژنی که میتواند بین مولکول آب و الکل برقرار شود، در آب محلول هستند.
فراریت: از آنجایی که ترکیبات حاوی پیوند هیدروژنی بین مولکولهای مختلف نقطه جوش بالاتری دارند، بنابراین فراریت کمتری دارند.
ویسکوزیته و کشش سطحی: مواد حاوی پیوند هیدروژنی به عنوان یک مولکول تجمع یافته وجود دارند. بنابراین جریان آنها نسبتاً دشوار میشود. ویسکوزیته بالاتر و کشش سطحی بالایی هم دارند.
چگالی کمتر یخ نسبت به آب: در مورد یخ جامد، پیوند هیدروژنی ساختار قفس مانندی از مولکولهای آب ایجاد میکند. در واقع، هر مولکول آب به صورت چهار وجهی با چهار مولکول آب در ارتباط است. مولکولها به اندازهای که در حالت مایع هستند، متراکم نشدهاند. هنگام ذوب شدن یخ، این ساختارهای مشابه به هم فرو میریزند و مولکولها به یکدیگر نزدیک میشوند. بنابراین با همان جرم یکسان از آب، حجم کاهش و چگالی افزایش مییابد. بنابراین، یخ در دمای K۲۷۳ چگالی کمتری نسبت به آب دارد و به همین دلیل است که یخ شناور میشود.
انواع پیوند هیدروژنی
دو نوع پیوند H وجود دارد که به صورت زیر طبقهبندی میشود:
- پیوند هیدروژنی بین مولکولی
- پیوند هیدروژنی درون مولکولی
پیوند هیدروژنی بین مولکولی
هنگامی که پیوند هیدروژنی بین مولکولهای مختلف از یک ترکیب یا ترکیبات متفاوت برقرار میشود، پیوند هیدروژنی از نوع بین مولکولی نامیده میشود. به عنوان مثال پیوند هیدروژنی در آب، الکل، آمونیاک و غیره.
پیوند هیدروژنی درون مولکولی
پیوند هیدروژنی که در خود یک مولکول اتفاق میافتد، پیوند هیدروژنی درون مولکولی نامیده میشود. در ترکیبات حاوی دو گروه اتفاق میافتد به طوری که یک گروه حاوی اتم هیدروژن متصل به یک اتم الکترونگاتیو و گروه دیگر حاوی یک اتم بسیار الکترونگاتیو متصل به یک اتم با الکترونگاتیوی کمتر گروه دیگر است.
پیوند، بین اتمهای هیدروژن یک گروه با اتم الکترونگاتیوتر گروه دیگر تشکیل میشود.
پیوند هیدروژنی متقارن
نوع خاصی از پیوند هیدروژنی است که در آن پروتون معمولاً در وسط بین دو اتم یکسان قرار میگیرد. قدرت پیوند بین هر اتم با هم برابر است. پیوند هیدروژنی متقارن نوعی پیوند چهار الکترونی سه مرکزی است. این پیوند همچنین در مقایسه با پیوند هیدروژنی “عادی” بسیار قویتر است و قدرت و استحکام آن تقریباً شبیه پیوند کووالانسی است.
پیوند فلزی چیست؟
فلزات با درخشندگی، رسانایی الکتریکی و حرارتی بالا، چکشخواری، شکلپذیری و استحکام کششی بالا مشخص میشوند. یک کریستال فلزی از تعداد بسیار زیادی اتم تشکیل شده است که در یک الگوی منظم قرار گرفتهاند.
مدلهای مختلفی برای توضیح ماهیت پیوند فلزی پیشنهاد شده است. دو ماژول مهم به شرح زیر است:

مدل دریای الکترون/ Electron Sea Model
در این مدل، فلزی متشکل از شبکهای از یونهای مثبت (یا هستهها) است که در دریایی از الکترونهای لایه ظرفیت متحرک غوطهور شده است و آزادانه در محدودههای کریستال حرکت میکنند. الکترونهای آزاد از هستههای یونی با بار مثبت در برابر نیروهای دافعه الکترواستاتیکی محافظت میکنند که در غیر این صورت یکی بر دیگری نیرو وارد میکرد. به نوعی، این الکترونهای آزاد بهعنوان «چسب» برای نگهداشتن هستههای یونی در کنار هم عمل میکنند.
نیروهایی که اتمها را در یک فلز در کنار هم نگه میدارند، در نتیجه جاذبه بین یونهای مثبت و الکترونهای آزاد متحرک اطراف، به عنوان پیوندهای فلزی شناخته میشوند. به وسیله الکترونها، دریا قبل از مکانیک کوانتومی، خواص ویژهی فلزات را توضیح میدهد. به عنوان مثال، رسانایی الکتریکی و حرارتی فلزات را میتوان با حضور الکترونهای متحرک در فلزات توضیح داد.
با اعمال میدان الکترونی، این الکترونهای متحرک، جریان الکتریکی را در سرتاسر فلزات از یک سر به سر دیگر هدایت میکنند. به همین ترتیب، اگر یک قسمت از فلز گرم شود، الکترونهای متحرک در بخشی از فلزات مقدار زیادی انرژی جنبشی به دست میآورند. این الکترونها آزاد و متحرک هستند، به سرعت در سراسر فلز حرکت نموده و گرما را به قسمت دیگر فلز هدایت میکنند.
چند پیوند هیدروژنی میتواند توسط آب تشکیل شود؟
آب میتواند چهار پیوند هیدروژنی ایجاد کند. دو جفت تنها اتم اکسیژن و دو اتم هیدروژن از آب در پیوند هیدروژنی بین مولکولی نقش دارند.
سوالات متداول
پیوند هیدروژنی چگونه بر اسیدیته تأثیر میگذارد؟
پیوند هیدروژنی اسیدیته مولکول را کاهش میدهد. به این دلیل که اتم هیدروژن در پیوند نقش دارد و نمیتواند پروتونه شود. این یک پیوند پایدار و قوی است.
چرا ترکیبات قطبی در پیوند هیدروژنی حل میشوند؟
ترکیبات قطبی به دلیل پیوند هیدروژنی در آب حل میشوند. مولکولهای قطبی توسط مولکولهای آب از طریق پیوند هیدروژنی جذب شده و بنابراین به راحتی در آب انحلال مییابند.
پیامدهای پیوند هیدروژنی چیست؟
چگالی یخ در آب به دلیل پیوندهای هیدروژنی قویتر در یخ جامد نسبت به آب مایع کمتر است. این یکی از پیامدهای مهم پیوند هیدروژنی است.
چند پیوند هیدروژنی بین جفت بازهای آدنین (A) – تیمین (T) و گوانین (G) – سیتوزین (C) وجود دارد؟
دو پیوند هیدروژنی بین A-T و سه پیوند هیدروژنی بین G-C وجود دارد.
خلاصه
به تشکیل پیوندهای هیدروژنی اشاره دارد که یک گروه ویژه از نیروهای جاذبه بین مولکولی هستند که به دلیل برهمکنش دوقطبی-دوقطبی بین یک اتم هیدروژن که به یک اتم بسیار الکترونگاتیو متصل میشود و یک اتم بسیار الکترونگاتیو دیگر که در مجاور اتم هیدروژن قرار دارد ایجاد میشود.
همچنین بخوانید: