تکنیک ها
هیبریدوما چیست؟
هیبریدوما چیست؟
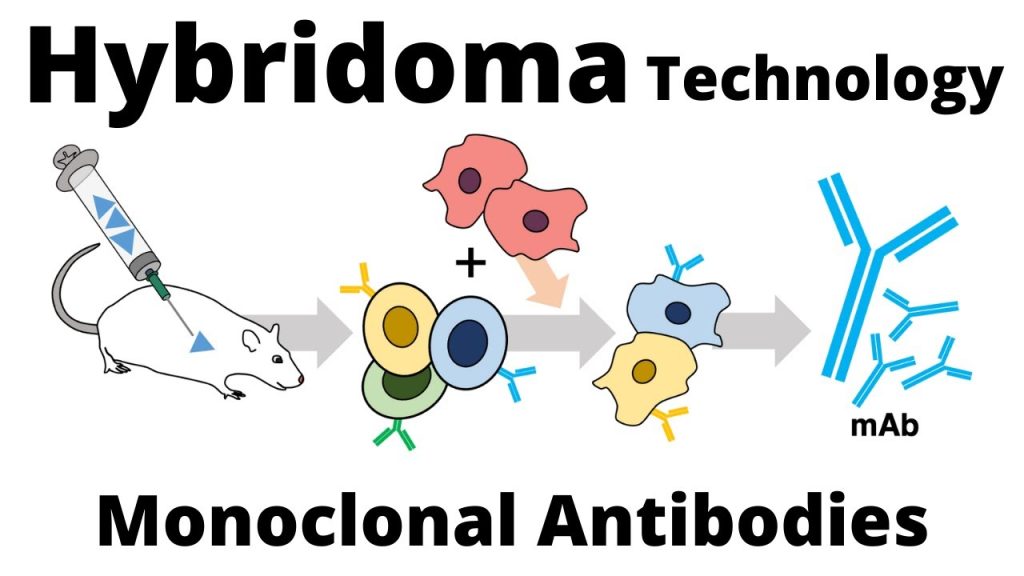
فناوری هیبریدوما روشی برای تولید تعداد زیادی آنتی بادی یکسان (آنتی بادی مونوکلونال نیز نامیده می شود) است. این فرآیند با تزریق آنتی ژنی به موش (یا پستاندار دیگر) آغاز می شود که پاسخ ایمنی را تحریک می کند. نوعی گلبول سفید ، سلول B ، آنتی بادی تولید می کند که به آنتی ژن تزریق شده متصل می شود.
این آنتی بادی های تولید کننده سلولهای B سپس از موش جمع شده و به نوبه خود با سلولهای سرطانی سلول B جاویدان ، میلوما ، برای تولید یک سلول ترکیبی به نام هیبریدوما ، که هر دو توانایی تولید آنتی بادی را دارد ، الحاق می شوند. طول عمر از سلول B و تولید مثل از میلوم. هیبریدوما را می توان کشت داد ، هر کشت با یک سلول هیبریدومای زنده شروع می شود ، درون هر کشت هیبریدومای ژنتیکی یکسان تشکیل میشود که به جای مخلوطی از آنتی بادی های مختلف (پلی کلونال) ، یک آنتی بادی در هر کشت (مونوکلونال) تولید می کند.
رده سلولی میلوما که در این فرآیند استفاده می شود به دلیل توانایی رشد در کشت بافت و عدم وجود سنتز آنتی بادی انتخاب شده است. برخلاف آنتی بادی های پلی کلونال ، که مخلوطی از مولکول های مختلف آنتی بادی هستند ، آنتی بادی های مونوکلونال تولید شده توسط هر یک از خط های هیبریدوما همه از نظر شیمیایی یکسان هستند.
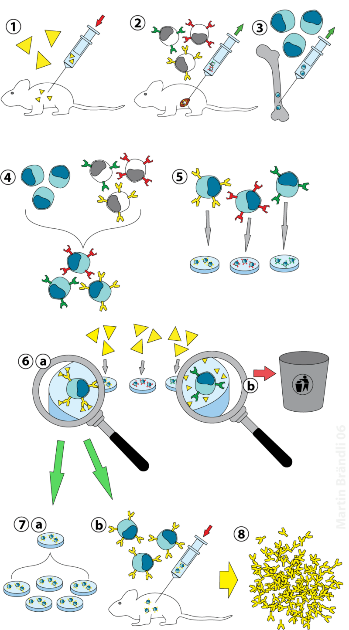
(1) Immunisation of a mouse (2) Isolation of B cells from the spleen (3) Cultivation of myeloma cells (4) Fusion of myeloma and B cells (5) Separation of cell lines (6) Screening of suitable cell lines (7) in vitro (a) or in vivo (b) multiplication (8) Harvesting
تاریخچه هیبریدوما
تولید آنتی بادی های مونوکلونال توسط سزار میلشتاین و ژرژ جی. ف. کوهلر در سال 1975 اختراع شد. آنها جایزه نوبل پزشکی و فیزیولوژی 1984 را با نیلز کاج جرن ، که کمک های دیگری به ایمونولوژی کرد ، به اشتراک گذاشتند. اصطلاح هیبریدوما توسط لئونارد هرتزنبرگ در جریان مراسم شنبه در آزمایشگاه سزار میلشتاین در 1976–1977 ابداع شد.
کاربردهای هیبریدوما
استفاده از آنتی بادی های مونوکلونال زیاد است و شامل پیشگیری ، تشخیص و درمان بیماری است. به عنوان مثال ، آنتی بادی های مونوکلونال می توانند زیرمجموعه سلول های B و سلول های T را تشخیص دهند ، که در شناسایی انواع مختلف سرطان خون مفید است. علاوه بر این ، از آنتی بادی های مونوکلونال خاص برای تعریف مارکرهای سطح سلول در گلبول های سفید خون و انواع سلول های دیگر استفاده شده است. این منجر به رشته ای از سری تمایز مارکرها شد.
این غالباً به عنوان نشانگر CD شناخته می شود و صدها اجزا مختلف سطح سلول را تعریف می کند که هر کدام با اتصال یک آنتی بادی مونوکلونال خاص مشخص می شوند. چنین آنتی بادی هایی برای مرتب سازی سلول های فعال شده با فلورسانس ، جداسازی ویژه انواع خاصی از سلول ها بسیار مفید است.
همچنین با کمک آنتی بادی های مونوکلونال ، می توان بافت ها و اندام ها را بر اساس بیان مارکرهای مشخصی که منعکس کننده پیدایش بافت یا سلول هستند ، طبقه بندی کرد. آنتی ژن اختصاصی پروستات ، آلکالن فسفاتاز جفت ، گنادوتروفین جفتی انسان ، α- فتوپروتئین و دیگران آنتی ژن های مرتبط با ارگان ها هستند و تولید آنتی بادی های مونوکلونال علیه این آنتی ژن ها به تعیین ماهیت تومور اولیه کمک می کند.
آنتی بادی های مونوکلونال به ویژه در تشخیص ضایعات مشابه مورفولوژیکی مانند مزوتلیوما پلور و صفاقی ، آدنوکارسینوما و در تعیین اندام یا منشا بافت متاستازهای تمایز نیافته بسیار مفید هستند. آنتی بادی های مونوکلونال منتخب در تشخیص متاستازهای مخفی (سرطان با منشا اولیه ناشناخته) با تجزیه و تحلیل ایمونوسیتولوژی مغز استخوان ، سایر آسپیراتهای بافتی و همچنین غدد لنفاوی و سایر بافتها کمک می کنند و می توانند حساسیت بیشتری نسبت به رنگ آمیزی هیستوپاتولوژیک طبیعی داشته باشند.
روش کار هیبریدوما
حیوانات آزمایشگاهی (پستانداران ، به عنوان مثال موش ها) ابتدا در معرض آنتی ژنی قرار می گیرند که در برابر آن یک آنتی بادی تولید می شود. معمولاً طی چند هفته تزریق آنتی ژن مورد بحث انجام می شود. این تزریق ها به طور معمول با استفاده از الکتروپوراسیون داخل بدن انجام می شود ، که به طور قابل توجهی پاسخ ایمنی را افزایش می دهد.
هنگامی که اسپلنوسیت ها از طحال پستاندار جدا شوند ، سلول های B با سلول های میلوما نامیرا الحاق می شوند. همجوشی سلول های B با سلول های میلوما با استفاده از الکتروفیوژن انجام می شود. الکتروفیوژن باعث می شود سلول های B و سلول های میلوما با استفاده از یک میدان الکتریکی تراز شده و جوش بخورند.
به عنوان راه جایگزین دیگر ، سلولهای B و میلوما می توانند توسط پروتکلهای شیمیایی به هم متصل شوند ، که اغلب از پلی اتیلن گلیکول استفاده می شود. سلول های میلوما از قبل انتخاب می شوند تا اطمینان حاصل شود که آنتی بادی ترشح نمی کنند و فاقد ژن هیپوکسانتین-گوانین فسفریبوسیل ترانسفراز (HGPRT) هستند و باعث حساس شدن آنها به محیط HAT می شود.
سلولهای ذوب شده تقریباً به مدت 10 تا 14 روز در محیط HAT (محیط هیپوكسانتین-آمینوپترین-تیمیدین) انكوبه می شوند. آمینوپترین مسیری را مسدود می کند که امکان سنتز نوکلئوتید را فراهم می کند. از این رو ، سلولهای میلوما ذوب نشده از بین می روند ، زیرا آنها نمی توانند از طریق مسیرهای نوین یا نجات ، نوکلئوتید تولید کنند زیرا فاقد HGPRT هستند.
از بین بردن سلولهای میلوما که الحاق نشده اند ضروری است زیرا آنها می توانند بر سلولهای دیگر به ویژه هیبریدومای ضعیف موثر باشند و الحاق آن ها را خنثی کنند. سلولهای B جوش نخورده به دلیل طول عمر کوتاه می میرند. به این ترتیب ، فقط هیبریدهای سلول B-myeloma زنده می مانند ، زیرا ژن HGPRT که از سلول های B می آید دارای عملکرد است. این سلول ها آنتی بادی تولید می کنند (خاصیت سلول های B) و جاودانه هستند (خاصیت سلول های میلوما).
سپس محیط کشت انکوبه شده رقیق میشود به طوری که در پلیت چندخانه هر چاهک فقط حاوی یک سلول باشد. از آنجا که آنتی بادی های موجود در یک چاهک توسط همان سلول B تولید می شوند ، به سمت همان اپی توپ هدایت می شوند و بنابراین آنتی بادی های مونوکلونال هستند.
همچنین بخوانید…