مقدمهای بر روشهای بیهوشی و جراحی در موشهای آزمایشگاهی و رتها
رت ها (Rattus norvegicus) و موش های آزمایشگاهی (Mus musculus) مدلهای اساسی در تحقیقات بیومدیکال هستند. انجام روشهای جراحی بر روی این حیوانات نیازمند بیهوشی مناسب است تا درد را به حداقل برساند، انطباق اخلاقی را تضمین کند و یکپارچگی نتایج آزمایشی را حفظ کند. استفاده صحیح از تکنیکهای جراحی، تجویز بیهوشی و مراقبتهای بعد از عمل برای رفاه حیوانات و قابلیت تکرارپذیری تحقیقات حیاتی است.
این مقاله یک راهنمای جامع در مورد روشهای بیهوشی، تکنیکهای جراحی، مخاطرات احتمالی، ابزار مورد نیاز و پروتکلهای مربوط به نحوه نگهداری حیوانات برای تضمین بالاترین استانداردهای رفاه حیوانات و دقت علمی ارائه میدهد.
بیهوشی در موشهای آزمایشگاهی و رتها
انواع بیهوشی
بیهوشی در جوندگان آزمایشگاهی میتواند به دو دسته تقسیم شود:
- بیهوشی عمومی (از دست دادن سیستماتیک هوشیاری)
- بیهوشی موضعی (مسدودسازی درد در ناحیه خاص)
1. بیهوشی عمومی
بیهوشی عمومی برای انجام روشهای تهاجمی استفاده میشود و شامل داروهای بیهوشی استنشاقی یا تزریقی است.
A. بیهوشی استنشاقی

- داروهای مورد استفاده:
- ایزوفلوران (1-3%) (ترجیح داده میشود به دلیل بازتوانی سریع و متابولیسم کم).
- سِوو فلوکان (2-5%) (تحریک کمتر ولی گرانتر).
- هالوتان (1-2%) (به دلیل پتانسیل سمیت به ندرت استفاده میشود).
- روشهای تحویل:
- اتاق القا: برای آرامسازی اولیه استفاده میشود.
- کلاهک بینی یا ماسک: بیهوشی را در حین جراحی حفظ میکند.
- سیستم بخار زن (Vaporizer System): این سیستم غلظت گاز کنترل شده را با تأمین اکسیژن فراهم میکند.
مزایا:
- کنترل دقیق عمق بیهوشی.
- القای سریع و بازتوانی سریع.
- بار متابولیک کمتر نسبت به داروهای تزریقی.
معایب:
- نیاز به تجهیزات تخصصی (بخارزن بیهوشی، سیستم جمعآوری بخار).
- خطر قرار گرفتن در معرض محیطی برای پرسنل.
B. بیهوشی تزریقی
داروهای رایج و دوزها (تزریق IP یا SC):
- کتامین (۱۰۰ میلیگرم/کیلوگرم) + زیلازین (۱۰ میلیگرم/کیلوگرم) (بسیار استفاده میشود)
- کتامین (۸۰ میلیگرم/کیلوگرم) + دکسمدتومیدین (۰.۵ میلیگرم/کیلوگرم) (بازتوانی بهبود یافته)
- پروپوفول (۱۰-۱۵ میلیگرم/کیلوگرم IV) (برای روشهای کوتاه)
- یورتان (۱.۲ گرم/کیلوگرمIP) (برای روشهای طولانی، خطر سمیت عصبی)
مزایا:
- نیازی به تجهیزات استنشاقی ندارد.
- مناسب برای مطالعات میدانی.
معایب:
- زمان بازتوانی طولانیتر از داروهای استنشاقی.
- عمق بیهوشی کمتر قابل تنظیم است.
بیهوشی موضعی
برای جراحیهای جزئی (مانند کوتاه کردن دم، روشهای زیرپوستی) استفاده میشود.
داروها:
- لیدوکائین (۲ میلیگرم/کیلوگرم SC/IP) (اثر کوتاهمدت)
- بوپیواکائین (۲.۵ میلیگرم/کیلوگرم SC/IP) (اثر بلندمدت)
محدودیتها:
- بیهوشی کامل را فراهم نمیکند.
- ممکن است نیاز به آرامبخش اضافی داشته باشد.
نظارت بر بیهوشی
نظارت بر بیهوشی عمق بیهوشی ایمن را تضمین کرده و از بروز عوارض جلوگیری میکند.

علائم بیهوشی کافی:
- از دست دادن رفلکس راستآمدن
- عدم وجود رفلکس قرنیه (بیهوشی عمیق)
- تنفس آرام و منظم
علائم حیاتی برای نظارت:
- نرخ تنفس (۴۰-۸۰ نفس در دقیقه)
- نرخ ضربان قلب (۲۵۰-۴۵۰ ضربه در دقیقه)
- اشباع اکسیژن (>95%)
- آزمایش رفلکس (فشردن انگشتان پا، رفلکس قرنیه)
تجهیزات مورد استفاده:
- پالس اکسیمتر
- پروب دما
- کاپنوگراف (برای اندازهگیری سطح CO₂)
خطرات و ایمنی بیهوشی
- ریسکهای مصرف بیش از حد: افسردگی تنفسی، هیپوترمی.
- هیپوترمی: جوندگان به سرعت تحت بیهوشی گرما از دست میدهند. از پدهای گرمایشی استفاده کنید.
- هیپوکسی: اطمینان از اکسیژنرسانی کافی، به ویژه با داروهای بیهوشی تزریقی.
- مواجهه پرسنل: برای داروهای بیهوشی استنشاقی از سیستمهای جمعآوری بخار استفاده کنید.
روشهای جراحی در موشها و رتهای آزمایشگاهی
تکنیکهای جراحی باید مطابق با پروتکلهای استریل انجام شود تا حداقل آسیب و بازتوانی سریع حاصل گردد.
آمادگیهای پیش از جراحی
- انتخاب حیوان و تطبیق محیطی
- فقط حیوانات سالم، با وزن بیشتر از ۲۵ گرم (موشها) یا ۱۵۰ گرم (رتها).
- حداقل ۵ روز قبل از جراحی به محیط جدید تطبیق داده شوند.
- گرسنگی پیش از جراحی
- رتها: ۸-۱۲ ساعت (اختیاری).
- موشها: هیچ گونه گرسنگی (به دلیل خطر هیپوگلیسمی).
- آمادهسازی محل جراحی
- موها را با تیغ برقی اصلاح کنید.
- پوست را با الکل 70% + پویتیدون-آیدین (بتادین) ضدعفونی کنید.
ابزارهای مورد نیاز برای جراحی
- اسکالپل (اندازه ۱۱ یا ۱۵)
- قیچی و فورسپس میکرو
- هموستاتها و رترکتورها
- سوزنهای جراحی ریز (۶-۰ یا ۷-۰)
- نگهدارندههای سوزن
- الکتروکاتری (برای هموستاز)
- روپوشهای جراحی و دستکشهای استریل
- لوپ بزرگنمایی (اختیاری برای جراحیهای حساس)
روشهای جراحی رایج
جراحیهای جزئی
- کاشتن زیرپوستی (مطالعات تحویل دارو)
- تزریق وریدی دم (اداره دارو به صورتIV)
جراحیهای عمده
- اواریکتومی (OVX)
- برای مطالعات هورمونی استفاده میشود.
- برش در ناحیه پشتی، برداشتن تخمدان، بخیه در لایهها.
- جراحی عصبی (جراحی استریوتاکسیک)
- برای تزریق به مغز یا کاشت الکترودها استفاده میشود.
- نیاز به فریم استریوتاکسیک برای هدفگیری دقیق دارد.
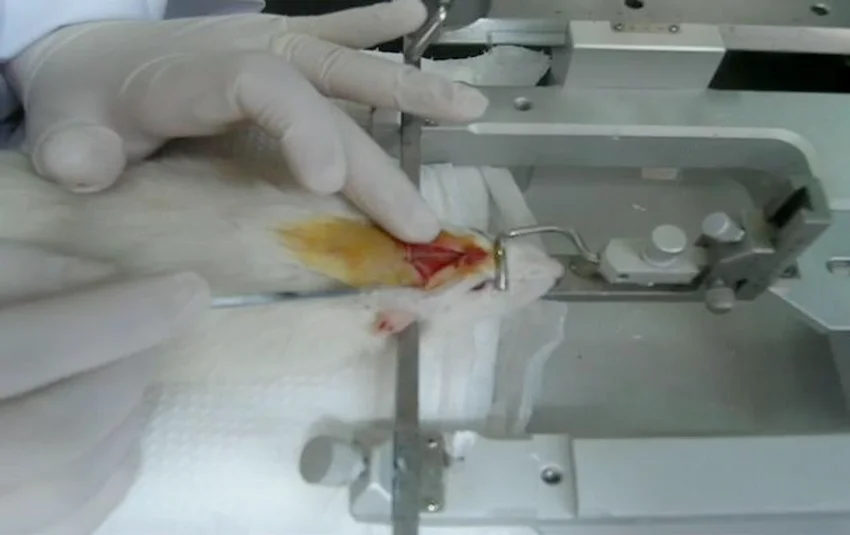
- لاپاروتومی
- برای دسترسی به اعضای شکمی (مانند کبد، کلیهها).
- برش میانه شکم، دستکاری اعضا، بسته شدن.
- تیمکتومی و اسپلنکتومی
- برای مطالعات سیستم ایمنی استفاده میشود.
مراقبتهای پس از جراحی
- مسکن
- بوپرنورفین (۰.۱ میلیگرم/کیلوگرم SC هر ۱۲ ساعت)
- ملوکسیکام (۱-۲ میلیگرم/کیلوگرم SC هر ۲۴ ساعت)
- کنترل دما
- قرار دادن روی پد گرمایشی با دمای ۳۷ درجه سانتیگراد.
- آبرسانی و تغذیه
- ارائه غذای نرم و محلول گلوکز 5% پس از جراحی.
- مراقبت از زخم و نظارت
- روزانه برای علائم عفونت یا باز شدن زخم بررسی شود.
خلاصه بهترین شیوهها
| گام | فرایند | نکات مهم |
| القای بیهوشی | ایزوفلوران یا کتانین/زایلازین | تنظیم دوز بر اساس واکنش حیوان |
| آمادهسازی جراحی | اصلاح مو، ضدعفونی کردن | بتادین + اتانول |
| تکنیکهای جراحی | انجام جراحی به روش آسپتیک، کنترل خونریزی | استفاده از ابزار دقیق |
| مراقبتهای پس از جراحی | مدیریت درد، هیدراسیون | نظارت روزانه |
نتیجهگیری
فرایندهای جراحی در جوندگان آزمایشگاهی نیاز به برنامهریزی دقیق، بیهوشی مناسب، تکنیکهای آسپتیک، و مراقبتهای پس از جراحی با دقت دارند. اطمینان از درمان اخلاقی و انسانی، رفاه حیوانات و اعتبار تحقیقاتی را افزایش میدهد. با پیروی از پروتکلهای استاندارد، محققان میتوانند عوارض جراحی را به حداقل برسانند و قابلیت بازتولید نتایج تجربی را به حداکثر برسانند.
همچنین بخوانید:




درمورد کلاس های جراحی حیوانات آزمایشگاهی میخواستم بدونم مدرس کی هست؟
سلام و وقت بخیر
جهت دریافت مشاوره با آزمایشگاه تماس بگیرید
آیا در این دوران که کرونا کمتر شده کلاسهای آزمایشگاهی نیز بصورت مجازی برگزار می گردد؟
سلام خیر با رعایت نکات بهداشتی ویژه کرونا دوره ها به صورت نیمه خصوصی برگزار میشوند.
بیهوش کردن حیوانات دردسرهای خاص خودش رو داره. این مرحله هم با سختی و آسونی تموم شد.چیزای خوبی بادگرفتم