دستهبندی نشده
مهندسی سلول های بنیادی و پزشکی بازساختی
درباره مهندسی سلول های بنیادی و پزشکی بازساختی
با پیشرفت تکنولوژیهایی مانند مهندسی ژنتیک و دستکاری چندین ژن به صورت همزمان، امکان مهندسی سلول به صورت عملی ممکن شده است. بااینحال، برای آنکه بتوانیم یک مهندسی مبتنی بر دانش داشته باشیم و عقلانی عمل کنیم، بایستی از روشهای سیستم بیولوژی و رویکردهای محاسباتی در تحقیقات خود استفاده کنیم تا هم در زمان و هم در هزینه صرفهجویی کنیم. یکی از مهترین دسته سلولهایی که در سالهای اخیر موردتوجه دانشمندان بوده است، سلول بنیادی است. این سلولها انواع مختلفی دارند و میتوانند به سلولهایی در ردههای پایینتر متمایز شوند. پس شما سلولهایی دارید که میتوانید آنها را به دسته سلولهای مختلفی تمایز دهید.
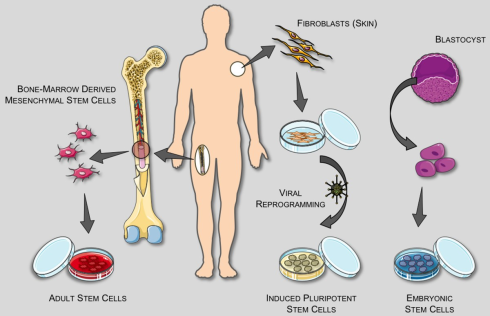
حالا چرا شبیهسازی و مهندسی سلول های بنیادی؟
اگرچه گوسفند دالی در سال 1997 خبرساز شد، شبیهسازی حیوانات حتی در آن زمان هم چیز جدیدی نبود. اولین آزمایشهای این چنینی به اواسط قرن بیستم باز میگردد. قورباغهها، موشها، گاوها و سایر مهرهداران قبلاً با موفقیت با استفاده از سلولهای جنینی و تکنیکی تحت عنوان انتقال هسته کلون شده بودند. در این تکنیک، هسته سلول تخمک (که شامل تمام کروموزومها است) برداشته شده و با هسته یک سلول جنینی از حیوان شبیهسازی جایگزین میشود.
جذابیت مطالعهای که روی دالی انجام شد این بود که او با انتقال هستهای از DNA یک سلول به اصطلاح بالغ (متمایز) شبیهسازی شد. در این مورد، این سلول پستانی بود.
تا آن زمان، زیستشناسان تصور می کردند که سلولهای بالغ فاقد پتانسیل رشد به یک ارگانیسم جدید و کاملاً فعال هستند. هنگامی که سلولها به طور غیرقابلبرگشت به سلولهای پوست، کبد یا مغز تمایز مییابند (به عنوان مثال)، بسیاری از ژنها به طور موثر “خاموش میشوند”. با این حال، بسیاری از این ژنهای خاموش در واقع برای رشد یک ارگانیسم جدید ضروری هستند. به همین دلیل است که آزمایشهای شبیهسازی قبلی با DNA از سلولهای قبلاً تمایز یافته شکست خورده بود.
ما هنوز به طور کامل نمیدانیم که چرا پروتکل استفاده شده توسط دانشمندانی که دالی را “اختراع کردند” اجازه میدهد که ژنهای لازم دوباره برنامهریزی شوند و کل ژنوم گوسفند فعال شود. هنوز هم چنین است که یک ارگانیسم جدید نمیتواند به تنهایی از یک سلول بالغ رشد کند. DNA بالغ باید به یک سلول تخمک بدون هسته منتقل شود، جایی که پروتئینهای مادر و مولکولهای سیگنال جنین را تعیین میکنند و باعث بیان مجموعهای دیگر از ژنها در نواحی مشخص میشوند. بدون این پروتئینها و مولکولها، جنین شروع به رشد نخواهد کرد.
چرا خلق دالی اینقدر هیجانانگیز بود؟ اول اینکه همانطور که در بالا ذکر شد، باور عمومی در مورد برگشتناپذیری تمایز سلولی را به چالش کشید و مهمتر از آن درهای جدیدی را در بیوتکنولوژی باز کرد. بزرگترین پتانسیل موجود در تولید داروهایی برای بیمارانی است که در برابر درمان بسیار مقاوم هستند.
مدت ها قبل از دالی، حیوانات مختلفی برای اهداف پزشکی مختلف مهندسی ژنتیک شده بودند:
- گوسفند و بز برای تولید پروتئینهای انسانی در شیرشان مهندسی شدهاند، مانند فاکتورهای انعقادی برای درمان اختلالات خونی مانند هموفیلی.
- سیستم ایمنی خوکها به گونهای اصلاح شده است که شبیه به انسان است تا اعضای بدن آنها بدون واکنش پس زدن به انسان پیوند داده شود.
- موشها از نظر ژنتیکی تغییر یافتهاند تا چاق شوند یا به بیماریهای خاصی مبتلا شوند تا دانشمندان بتوانند اختلالات مرتبط با آن را در انسان مطالعه کنند.
حیوانات شبیهسازی شده، صفات ویژه خود را برای نسل های زیادی حفظ می کنند. همچنین، آزمایش داروها بر روی مقادیر زیادی از حیوانات که تا حد امکان یکسان هستند به محققان کمک میکند تا آمار قابل اعتمادی را بدست آورند.
آیا انسان را نیز میتوان شبیهسازی کرد؟
سلول های بنیادی تمایز نیافته هستند، به این معنی که پتانسیل رشد به هر نوع سلولی در بدن را دارند. به عنوان مثال، میتوان سلولهای بنیادی را برای جایگزینی بافت تخریبشده در مغز بیماران مبتلا به بیماریهای دژنراتیو و صعبالعلاج مانند پارکینسون یا آلزایمر یا در کبد افرادی که از نارسایی کبدی رنج میبرند، کاشت.
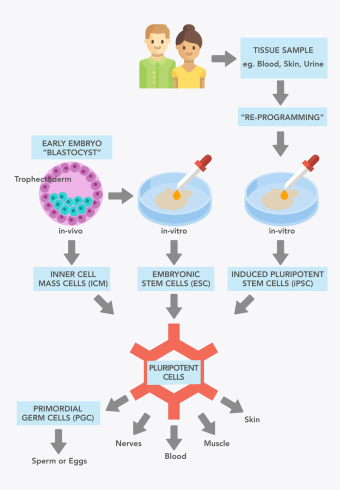
چنین روشهایی شامل ادغام هسته سلول بیمار با یک تخمک اهدایی بدون هسته است. این تخمک به جنینی تبدیل میشود که دقیقاً همان ژنوم بیمار را دارد. سلولهای بنیادی جنینی (سلولهایی با پتانسیل تبدیل شدن به هر بافتی) در مرحله بلاستوسیست “برداشت” می شوند. سلولها و بافتهای مشتقشده از سلولهای بنیادی را میتوان بدون ترس از رد شدن به بیمار پیوند زد.
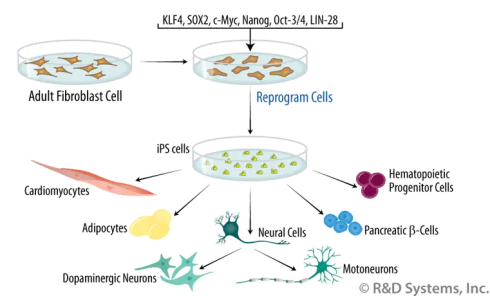
همانطور که می توانید تصور کنید، چنین تحقیقاتی به دلایل اخلاقی بسیار مورد بحث است. حتی اگر قرار باشد جنینها صرفاً برای نجات جان اهداکنندگان ایجاد شود، سؤالات نگرانکننده در مورد دسترسی و کاربرد این فناوری باقی میماند. در سال های اخیر، محققان جایگزین بالقوه ای برای سلولهای بنیادی جنینی کشف کردهاند. در سال 2006، محققان برای اولین بار موفق شدند سلولهای سوماتیک موش بالغ را با موفقیت به پرتوانی برگردانند، به این معنی که سلولها میتوانند به هر نوع سلول دیگری تغییر کنند.
این یک دستاورد بزرگ بود. مدت کوتاهی پس از آن، همین رویکرد در سلولهای انسانی کار کرد و سلولهای بنیادی پرتوان القایی (iPS) را تولید کرد. محققان سلولهای iPS را با وارد کردن چهار ژن در ژنوم سلولهای سوماتیک ایجاد کردند. این چهار ژن برای فاکتورهای رونویسی کد میشوند: سوئیچهایی که میتوانند فعالیت ژنهای دیگر را روشن یا خاموش کنند. با توجه به پیچیدگی یک سلول، واقعاً شگفت انگیز است که تنها چهار ژن میتواند چنین تغییر اساسی را ایجاد کند.
خطرات و چالش های مهمی باقی مانده است. انتقال ژن به سلولها چالش برانگیز بوده است. در ابتدا دانشمندان از ویروسها برای معرفی این چهار ژن استفاده میکردند، اما این ویروسها در برخی آزمایشهای حیوانی باعث سرطان شدند. از آن زمان سایر روشهای ایمنتر توسعه یافتهاند.
آزمایش های بیشتر نشان داده است که دو ژن از چهار ژن را میتوان با ژنهای دیگر جایگزین کرد. حتی میتوان برخی از آنها را حذف کرد. سلولهای iPS میتوانند انواع مختلفی از سلولها را ایجاد کنند، اما از جنبههای مهمی، مانند محل تگهای اپیژنتیکی، با سلولهای بنیادی جنینی متفاوت هستند. همچنین تولید حیوانات زنده مانند موش با iPS دشوارتر از سلول های بنیادی جنینی است.
تحقیقات در مورد iPS نویدهای زیادی برای پزشکی بازساختی دارد. با این حال، همانطور که برخی از دانشمندان اشاره میکنند، این روش نمیتواند به طور کامل جایگزین مطالعات روی سلولهای بنیادی جنینی شود و تحقیقات بسیار بیشتری مورد نیاز است. در بسیاری از کشورها تحقیقات سلولهای بنیادی جنینی غیرقانونی یا بسیار محدود است. در ایالات متحده، اگرچه برخی محدودیتها اعمال میشود، NIH ممکن است از تحقیقات علمی ارزشمند در سلولهای بنیادی انسانی، از جمله تحقیقات سلولهای بنیادی جنینی انسان، تا حدی که قانون اجازه میدهد، حمایت کند.
توسعه روشهایی برای ایجاد تغییرات دقیق و هدفمند در ژنوم سلولهای زنده، هدف دیرینه محققان زیستپزشکی بوده است که به دنبال درک و درمان بیماریهای ژنتیکی مانند کمخونی سلول داسی شکل و فیبروز کیستیک هستند.
ویرایش ژنوم نوعی مهندسی ژنتیک است که از نوکلئازهای مهندسی شده مصنوعی یا “قیچی مولکولی” برای وارد کردن، جایگزینی یا حذف DNA از ژنوم استفاده میکند. در سال های اخیر چندین روش توسعه یافته است که انقلابی در این زمینه ایجاد کرده است: تغییر نسبتاً سریع و هدفمند یک یا چند ژن در هر ژنوم مشخص. ژنهای هدف یا خاموش میشوند یا با افزودن قطعات مهندسی شده DNA تغییر مییابند.
روش CRISPR/Cas9 – مخفف عبارت Clustered Regularly Interspaced Short Palindromic Repeat/CRISPR Associated – یکی از تکنیکهای ویرایش ژنوم است. در این روش، وظیفه تشخیص DNA توسط قطعه ای از RNA که به یک موقعیت منطبق در DNA متصل میشود، انجام میشود. سپس نوکلئاز Cas9 DNA را قطع میکند. از مزایای CRISPR این است که می توان بیش از یک ژن را به طور همزمان هدف قرار داد. این به محققان اجازه میدهد تا بیماریهایی را که چند ژنی هستند به طور موثرتری مطالعه کنند.
ویژگیهای سلول های بنیادی
- خودنوسازی: توانایی یک سلول بنیادی برای تولید سلولهای بنیادی بیشتر با ویژگیهای مشابه سل
ول «والد».
- تمایز: تمایز فرآیندی است که در طول رشد رخ میدهد که طی آن سلولها عملکردهای تخصصی خود را انجام میدهند، مانند توانایی گلبول قرمز برای حمل اکسیژن یا سلول عصبی برای ارسال سیگنال الکتریکی.
انواع سلول های بنیادی
سلول های بنیادی جنینی انسان: سلولهای مرحله اولیه که میتوانند به هر نوع سلولی در بدن تبدیل
شوند. آنها از بلاستوسیستهای باقی مانده میآیند. آنها همچنین به عنوان سلولهای بنیادی پرتوان انسانی شناخته میشوند، زیرا میتوانند انواع سلولهای بدن را ایجاد کنند.
سلول های بنیادی خون بند ناف: سلولهای بنیادی خون بندناف در بدو تولد از بندناف بازیابی میشوند. اگرچه آنها از یک نوزاد تازه متولد شده میآیند، اما هنوز مانند سلولهای بنیادی بالغ محدود هستند زیرا میتوانند چند
ین نوع سلول بسازند، اما نه همه انواع سلولهای بدن. با این حال، بر خلاف سلولهای بنیادی بالغ، آنها میتوانند به طور نامحدود در محیط کشت رشد کنند و به محققان منابع نامحدودی را بدهد که برای ایجاد مدلهای بافت یا بیماری کافی است.
سلول های بنیادی بالغ: این سلولها در برخی از بافتهای بالغ بدن یافت میشوند، اما نه در تمام بافتها. برخلاف سلولهای بنیادی پرتوان، آنها فقط میتوانند انواع محدودی از سلولهای موجود در بافتی را بسازند که در آن زندگی میکنند. به عنوان مثال، سلولهای بنیادی بالغ از کبد فقط می توانند سلولهای کبدی بیشتری بسازند.
سلولهای iPS: سلولهای بنیادی پرتوان القایی (سلول های iPS) هستند. سلولهای iPS دارای ویژگیهای بسیاری از سلولهای بنیادی جنینی هستند، اما یکسان نیستند. این فناوری موفقیتآمیز برای تحقیقات، مانند ایجاد مدلهای بیماری بسیار مفید است، اما نیاز به سلولهای بنیادی جنینی را کاهش نمیدهد. آنها همچنین به عنوان سلول های بنیادی پرتوان انسانی شناخته می شوند.
سلول های بنیادی جنینی انسانی مشتق از SCNT: Somatic cell nuclear transfer (SCNT) روشی برای تولید سلولهای بنیادی جنینی است. در این روش، هسته سلول تخمک برداشته شده و با هسته سلول بالغ، مانند پوست یا سلول خونی، جایگزین میشود. سلولهای بنیادی تولید شده توسط SCNT و سلولهای تولید شده از بلاستوسیستها استانداردهای طلایی برای تحقیقات سلولهای بنیادی هستند.
پتانسیل سلول های بنیادی
Totipotent: سلول بنیادی کاملا تمایز نیافته که قادر به تولید یک ارگانیسم کامل است. زیگوت و سلولها در مراحل اولیه پس از لقاح (یعنی مرحله 2 سلولی) همهتوان در نظر گرفته میشوند.
پرتوان: سلول بنیادی تمایز نیافته، قادر به تولید هر نوع سلولی در بدن است. سلولهای بنیادی جنینی انسان و سلولهای بنیادی پرتوان القاشده توسط انسان، پرتوان در نظر گرفته میشوند.
چندتوانی: سلول بنیادی تا حدی تمایز یافته که میتواند تعدادی از انواع سلول را در یک دودمان خاص بسازد. سلولهای بنیادی بالغ و سلولهای بنیادی خون بند ناف چندتوانی در نظر گرفته میشوند.
انواع سلول
سلول پیش ساز یا Progenitor: اغلب با سلول بنیادی اشتباه گرفته میشود، یک نسل اولیه سلول بنیادی که فقط میتواند تمایز یابد، اما دیگر نمیتواند خود را تجدید کند. در اصطلاح علمی گفته میشود که سلولهای پیش ساز تمایز بیشتری نسبت به سلولهای بنیادی دارند.
سلولهای سوماتیک: تمام سلولهای موجود در ارگانیسم در حال رشد یا توسعه یافته به استثنای سلولهای ژرمینال (تخمک و اسپرم).
سلولهای بنیادی: سلولهایی که هم ظرفیت خودنوسازی (تولید سلولهای بنیادی بیشتر با تقسیم سلولی) و هم تمایز به سلولهای بالغ و تخصصی را دارند.
کاربردهای مهندسی سلول های بنیادی
پزشکی بازساختی یا Regenerative medicine: مداخلات پزشکی با هدف ترمیم اندامهای آسیبدیده، اغلب با استفاده از سلولهای بنیادی برای جایگزینی سلولها و بافتهای آسیبدیده در اثر پیری یا بیماری.
بیولوژی پیوند: علمی که پیوند اعضا و سلول ها را مطالعه میکند. زیستشناسان پیوند به بررسی سؤالات علمی میپردازند تا بفهمند چرا بافتها و اندامهای خارجی رد میشوند، نحوه عملکرد اندامهای پیوندی درگیر چطور است و چگونه می توان این عملکرد را حفظ کرد یا بهبود بخشید، برای به دست آوردن نتایج مطلوب، عضوی که باید پیوند زده شود چگونه باید کار کند.
پیوند آلوژنیک (Allogeneic transplantation): پیوند سلول، بافت یا عضو از یک فرد به فرد دیگری از همان گونه.
پیوند اتولوگ (Autologous transplantation): پیوند سلول، بافت یا عضو از یک فرد به همان فرد. چنین پیوندهایی پاسخ ایمنی را القا نمیکنند و رد نمیشوند.
پیوند سلولهای خونساز (Hematopoietic cell transplantation): پیوند سلولهای بنیادی خونساز با پتانسیل خونسازی. سلولهای بنیادی خونساز بازسازی سریع و پایدار خونسازی را فراهم میکنند و در مغز استخوان بزرگسالان، خون بند ناف، خون محیطی و در کبد جنین یافت میشوند.




درمان از طریق تزریق سلولهای بنیادی مربوط به کدام رشته و تخصص از پزشکی میشود یعنی دکتر مربوطه در این زمینه باید چه تخصصی داشته باشد متشکرم
تزریق سلولهای بنیادی بسته به بیماری، زیر نظر تخصصهای مختلف است:
بیماریهای خونی: هماتولوژی
بیماریهای مغز و اعصاب: نورولوژی یا جراحی مغز
بیماریهای ارتوپدی: ارتوپد
پوستی یا زیبایی: پوست یا پزشکی ترمیمی
قلبی: قلب و عروق
📌 معمولاً در کلینیکهای سلولدرمانی یا توسط پزشک مرتبط با محل بیماری انجام میشه.
سلام ..بهترین رشته های کارشناسی مرتبط با رشته پزشکی بازساختی ؟
سلام و وقت بخیر
جهت دریافت مشاوره با آزمایشگاه تماس بگیرید
چطوری در فیلد مهندسی سلول بنیادی و پزشکی ساختاری به درامد بالا برسم
برای دستیابی به درآمد بالا در حوزه مهندسی سلولهای بنیادی و پزشکی ساختاری:
۱. کسب مهارتهای تخصصی و نوین مانند ویرایش ژن (CRISPR) و چاپ زیستی (Bioprinting)
۲. همکاری با شرکتهای دانشبنیان و ورود به پروژههای صنعتی
۳. تقویت رزومه علمی جهت جذب فرصتهای بینالمللی یا جذب سرمایه
۴. ارائه خدمات آموزشی و آزمایشگاهی تخصصی در قالب برند یا مرکز تحقیقاتی مستقل
سلام وقت بخیر داخل ایران مجموعه ای هستش که سلولهای مهندسی یا پرتوان تولید کنند
در ایران، چندین مرکز تحقیقاتی و دانشگاهی وجود دارند که در زمینه سلولهای مهندسی شده و سلولهای پرتوان تحقیق و کار میکنند. این مراکز به تولید و بررسی سلولهای بنیادی و سلولهای پرتوان تخصصی پرداختهاند و در زمینههای پزشکی بازساختی و درمانهای نوین فعالیت میکنند. برخی از این مراکز عبارتند از:
مرکز تحقیقات سلولهای بنیادی رویان: این مرکز یکی از پیشروان در زمینه تحقیقات سلولهای بنیادی در ایران است و در زمینههای مختلفی از جمله سلولهای بنیادی جنینی و بالغ کار میکند.
پژوهشکده رویان: این پژوهشکده نیز تحت نظر موسسه رویان و وابسته به جهاد دانشگاهی است و در زمینههای مختلفی از تحقیقات سلولی و مولکولی فعالیت دارد.
مرکز تحقیقات سلولهای بنیادی دانشگاه تهران: این مرکز در دانشگاه تهران قرار دارد و در زمینه تحقیق و توسعه درمانهای مبتنی بر سلولهای بنیادی فعالیت میکند.
مرکز تحقیقات بیوتکنولوژی و سلولهای بنیادی دانشگاه شهید بهشتی: این مرکز تحقیقاتی به بررسی و توسعه روشهای نوین درمانی با استفاده از سلولهای بنیادی میپردازد.