دستهبندی نشده
طراحی پروتئین و مبانی آن در علم طراحی دارو
مبانی طراحی پروتئین از گذشته تاکنون
با تکیه بر کارهای پیشگامانه هو و دگرادو در اواخر دهه ۱۹۸۰ و رویکردهای طراحی پروتئین، بسیاری از ویژگی های اساسی پروتئین و ساختار آن را آشکار گردیدند. در این مطلب طراحی جدید پروتئین ها با کاربردهای عملی و برخی از نقاط عطف گذشته را به طور خلاصه بررسی می کنیم.
تاریخچه مختصری در مورد مبانی طراحی پروتئین
شاید هیچ کس به اندازه خود اولین طراحان پروتئین شگفت زده نشده باشند که چقدر ایجاد پروتئین های جدید برای اتخاذ حد مطلوب، کم و بیش آسان است. دو رویکرد مکمل در ابتدا مورد استفاده قرار گرفت. دگرادو و همکاران با استفاده از حداقل تعداد انواع اسیدهای آمینه و یک رویکرد سیستماتیک، به دنبال ایجاد چهار پروتئین مارپیچ بودند.
اولین مارپیچ ها بر اساس تمایل اسید آمینه طراحی شدند. سپس رابطهای تعامل هلیکس-مارپیچ معرفی شدند و چهار مارپیچ به هم مرتبط شدند. در هر مرحله طرح ها برای اطمینان از رفتار مطلوب بررسی شدند. این استراتژی امکان ارزیابی و در صورت نیاز اصلاح هر یک از اجزای طرح را فراهم میکرد.
ریچاردسونز و همکاران رویکرد تکمیلی را اتخاذ کردند. آنها نیز به دنبال ایجاد یک پروتئین باندل چهار مارپیچ بودند، اما هدف طراحی آنها این بود که تعداد انواع اسیدهای آمینه مورد استفاده را به حداکثر برسانند تا توالی تا حد امکان طبیعی باشد. هر دو گروه پروتئینهای مارپیچ فشرده و مونومر را ایجاد کردند که با روشهای محلول ساده، عمدتا دو رنگی دایرهای یا circular dichroism ارزیابی شد.
توجه به این نکته مهم است که هر دوی این رویکردها مشکل تاخوردگی پروتئین را به صورت معکوس در نظر می گرفتند. آنها سعی نداشتند پیشبینی کنند که یک توالی خاص چه ساختار سه بعدی را اتخاذ میکند، بلکه توالی را شناسایی میکردند که با یک چین خاص سازگار است. به موازات این طرحهای اولیه، تلاش قابلتوجهی نیز برای ترسیم و کمی کردن تجربی سهم ترمودینامیکی گرایشهای تشکیلدهنده ی مارپیچ α و مارپیچ β به کار گرفته شد. نتایج چنین اندازه گیری ها به طور قابل توجهی بر طراحی آینده تأثیر گذاشت.
به دنبال این موفقیتهای اولیه، علایق محققان حوزه طراحی پروتئین به ایجاد پروتئینهایی با خواص ترمودینامیکی تبدیل شد. نکته جالب این بود که اگرچه میتوان مارپیچهای مرتبط را طراحی کرد، اما شاید آنها بهجای اینکه واقعا بستهبندی و ویژگیهای ترمودینامیکی مرتبط با آن را که مشخصه پروتئینهای طبیعی است، خلاصه کنند، به شکلی با هم ارتباط دارند. متعاقبا، مونسون و همکاران. به صراحت چگونگی تغییر رفتار ترمودینامیکی پروتئین ها با طراحی مجدد هسته آبگریز را دنبال کردند.
در همان زمان، محققان از مدلهای coarse-grained برای طراحی محاسباتی هستههای پروتئینی استفاده کردند، با این مفهوم فراگیر که بقایای هسته باید آبگریز بوده و به طور موثر بستهبندی شوند. پوندر و ریچاردز مفهوم زنجیره جانبی اسید آمینه را ترویج کردند. rotamer ها که زنجیره های جانبی زیر مجموعه محدودی از زوایای دو وجهی را اتخاذ می کنند. آنها نشان دادند که محدودیتهای rotamer و آبگریزی بهعلاوه محدودیتهای دقیق در حجم آزاد، تعداد ترکیبهای آمینو اسیدی را که در هسته یک پروتئین کوچک سازگار هستند، به شدت محدود میکند.
بیکر و همکاران اولین فولد پروتئینی را که در طبیعت یافت نشد، با استفاده از نرم افزار Rosetta-Design طراحی و به صورت تجربی تایید کردند. استراتژی آنها ساخت داربست پروتئینی با استفاده از قطعات سه و نه residue از بانک اطلاعات پروتئین (PDB) بود.
علاوه بر طراحی پروتئینهای native-like، دانشمندان پروتئین همچنین شروع به معرفی عملکردهای جدید در پروتئینها با تأکید بسیار اولیه بر طراحی سایتهای اتصال یون فلزی، کردند. دلایل هم عملی و هم هیجانانگیز بودند: عملی چون روشهای طیفسنجی زیادی وجود دارد که میتوان برای توصیف هندسه اتصال در محلول استفاده کرد و هیجانانگیز است زیرا بسیاری از فعالیتها با یونهای فلزی در پروتئینها از جمله کاتالیز، انتقال الکترون و افزایش پایداری مرتبط هستند.
طراحی کاتالیزورهای مبتنی بر پروتئین بر اساس ایجاد یک محل اتصال برای وضعیت انتقال واکنش مورد نظر دنبال شد. طرحهای بهدستآمده فعالیت متوسطی را نشان دادند و بیشتر آنها متعاقبا با جهش زایی و انتخاب تصادفی بهبود یافته اند. قدرت تصادفی سازی و انتخاب برای بهبود طرح های اولیه بارها نشان داده شده است.
دگرادو و همکارانش رویکردهای مبتنی بر دانش را برای طراحی سازهها برای کاربردهای متنوع ارائه کردهاند. که پپتیدهای متصل شونده به غشاء، پپتیدهای سازماندهنده سطح و کریستالهای پروتئینی می باشند.
روشهای محاسباتی فعلی در طراحی پروتئین
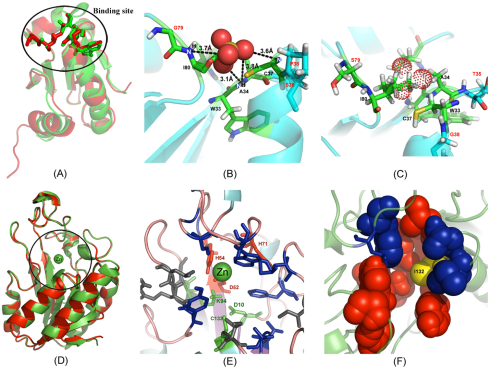
چرا بیشتر کارهای طراحی محاسباتی از پتانسیلهای مبتنی بر دانش به جای پتانسیلهای مبتنی بر مکانیک مولکولی استفاده میکنند؟ میدانهای نیروی مکانیک مولکولی کلاسیک، که از پتانسیلهای برهمکنش سادهسازی شده استفاده میکنند، سرعت محاسباتی را ارائه میدهند و پیادهسازی آنها ساده است. سادهسازیهای معمولی شامل استفاده از پتانسیلهای برهمکنش، تیمارهای پیوندهای کووالانسی با استفاده از پتانسیلهای مشابه لنارد جونز برای مدلسازی برهمکنشهای واندروالس، آبگریز و پیوند هیدروژنی است.
نقاط قوت این رویکرد این است که ساخت آن آسان است و کاربرد آن در برنامه های کامپیوتری مقیاس پذیر آسان است. معایب این رویکرد شامل جداسازی مصنوعی برهمکنش هایی است که عمیقا در هم تنیده شده اند، از جمله برهمکنش های واندروالس، پیوند هیدروژنی و برهم کنش های آبگریز که می تواند منجر به شمارش مضاعف، دشواری در کالیبره کردن سهم انرژی نسبی انواع مختلف برهمکنش ها و تعداد زیادی از پارامترهای ناشناخته شود که باید تعیین شوند.
در این زمینه، بهبودها یا بهروزرسانیهای بستههای نرمافزاری پرکاربرد را میتوان به عنوان یکی از دو نوع طبقهبندی کرد. یکی تغییر در مقادیر نسبی اصطلاحات انرژی که اغلب توسط دادههای آزمایشی بهبود یافته انجام میشود و دیگری افزودن موارد جدید است. اصطلاحات انرژی، برای مثال پتانسیلهای مبتنی بر دانش که تضمین میکند که زوایای دو وجهی زنجیره اصلی و زنجیره جانبی ترجیحا توزیعهای مشاهدهشده را از PDB نمونهبرداری میکنند.
اگرچه نتایج جهانی برای شبیهسازی پروتئین و پیشبینی ساختار از روی توالی همیشه در حال بهبود است، محدودیتهای آنها مستند شده است و تعدادی پیشنهاد برای بهبود آنها وجود دارد. در یک ارزیابی اخیر از میدانهای نیروی مختلف و عملکرد آنها در پیشبینی ساختارهای زنجیره جانبی پپتیدی، محققان نشان دادند که میدانهای نیروی مختلف، پیشبینیهای متفاوتی را برای توزیع زاویه دو وجهی زنجیره جانبی برای تقریبا هر اسید آمینه ارائه میدهند.
در مطالعه دیگری، پانده و همکاران از ۵۲۴ معیار تجربی برای ارزیابی عملکرد میدانهای نیرو مختلف با اجرای مسیرها بر روی پروتئین کوچک یوبیکوئیتین استفاده کردند. آنها دریافتند که میدانهای نیرو و مدلهای مختلف آب نتایج متفاوتی را بهدست میآورند. هرمانز و همکاران عملکرد میدانهای نیرو مختلف را در بازتولید زوایای دو وجهی ستون فقرات مشاهدهشده Ala و Gly مقایسه کردند.
آنها به این نتیجه رسیدند که هیچ یک از میدانهای نیروی کلاسیک فعلی به طور رضایتبخش عمل نمیکند و پیشنهاد کردند که اثرات مکانیکی کوانتومی (QM) باید برای پیشبینی مناسب گنجانده شود. در حال حاضر، چنین رویکردی برای طراحی پروتئین غیر عملی است. علاوه بر این، رویکردهای مبتنی بر QM به ورودی اولیه پتانسیلهای مبتنی بر دانش مانند (CMAP) نیاز دارند تا بتوانند به طور قابل اعتماد مقادیر مشاهدهشده در ساختارهای پروتئینی را در یک زمان معقول بازتولید کنند.
ریگان و همکاران یک رویکرد جایگزین برای طراحی پروتئین محاسباتی اتخاذ کرده اند. آنها نشان دادهاند که روشهای ساده مبتنی بر فضا، همانطور که توسط راماچاندران و همکاران ارائه شده است، ترکیبهای زاویه دو وجهی backbone و زنجیره جانبی را بهتر از تکنیکهای پیچیدهتر پیشبینی میکنند. به جای گنجاندن بسیاری از اصطلاحات مختلف در میدان نیروی مکانیک مولکولی، آنها استدلال میکنند که تنها مجموعه حداقلی از برهمکنشهای فضایی و محدودیتهای استریوشیمیایی باید اعمال شود تا ویژگیهای تعیینکننده ساختار پروتئین را به تصویر بکشد.
ثابت شده است که این روش بسیار موثر می باشد. این روش نه تنها پیشبینیهایی را برای ترکیبهای backbone و زنجیره جانبی فراهم می کند که در ساختارهای کریستالی پروتئین و توسط NMR در محلول مشاهده میشوند، بلکه اجازه میدهد مکانیزمی برای انتقال بین ترکیبهای مختلف زاویه دو وجهی زنجیره جانبی ارائه شود.
دستورالعمل های آینده برای طراحی پروتئین
ما نیازمند ابزارهای نظری یا محاسباتی برای طراحی ساختار پروتئین یا هر رابط تعاملی پروتئین-پروتئین می باشیم که تاکنون روشهای مختلف موفقیتهایی را داشتهاند. در این مطلب به تعدادی از مهمترین دستورالعمل ها برای طراحی پروتئین اشاره می کنیم.
در طراحی پروتئین محاسباتی، یک رویکرد رایج افزودن اصطلاحات مبتنی بر دانش به میدانهای نیروی موجود است با این حال، این استراتژی دارای معایبی است. در یک ارزیابی اخیر از چالشهای کنونی در طراحی رابطهای پروتئین-پروتئین، ناتوانی در مدلسازی دقیق انواع خاصی از برهمکنشها، مانند الکترواستاتیک و پیوند هیدروژنی، به عنوان یک محدودیت عمده ذکر شده است.
اثرات الکترواستاتیک و حلالپذیری اخیرا به تفصیل مورد بحث قرار گرفته است. یک سؤال مرتبط این است که آیا اثرات مکانیکی کوانتومی مانند قطبیت پذیری ابرهای الکترونی یا انرژیهای حلالپذیری ترکیبات برای کالیبره کردن پتانسیلهای کلاسیک ضروری هستند یا خیر. اینکه چگونه می توان تعامل بین فعل و انفعالات فضایی را به بهترین نحو مدل کرد، یک مشکل حل نشده باقی مانده است.
رتبهبندی صحیح طرحهای محاسباتی به دلایل مختلف همچنان یک چالش است. اول، زمانی که هر دو اصطلاح فیزیک و دانش مبتنی بر میدان نیرو برای تولید و ارزیابی طرحها گنجانده میشوند، کالیبره کردن نقاط قوت نسبی اصطلاحات و تعیین انرژی طرح در واحدهای فیزیکی دشوار است. بنابراین، رتبه بندی طرح ها با استفاده از چندین معیار به جای استفاده از همان میدان نیرو که فرآیند طراحی را هدایت می کند، ترجیح داده می شود.
علاوه بر این، هنگام استفاده از رویکردهایی که اصطلاحات مبتنی بر دانش و فیزیک را با هم ترکیب میکنند، اطمینان از اینکه همه سهمهای آنتالپیک پروتئین-پروتئین و پروتئین-آب و همچنین مشارکتهای آنتروپیک پروتئین و حلال به درستی در نظر گرفته شدهاند، دشوار است. در حالت ایدهآل، باید انرژی آزاد طرحها را برای رتبهبندی آنها محاسبه کرد.
Pivett وهمکاران برخی از این مسائل را با استفاده از شبیهسازی MD تمام اتم ها علاوه بر پروتکل طراحی استاندارد خود، برای ارزیابی طرحهای تکراری که منجر به یک آنزیم عملکردی میشود، مورد بررسی قرار دادند. با وجود این مشکلات، پیشرفت قابل توجهی در توسعه تکنیکهای محاسباتی برای پیشبینی و طراحی ساختارهای پروتئینی de novo صورت گرفته است.
این تا حدی به این دلیل است که با بررسی ساختارهای پروتئینی، طراحان می توانند اهداف طراحی را به روشی نسبتا ساده ترسیم کنند. در مقابل، هنگام طراحی پروتئین های کاربردی، هدف به هیچ وجه روشن نیست. عناصر خاصی را میتوان برای اتصال وضعیت انتقال طراحی کرد، اما پویاییهایی که همراه با فعالیت هستند و ممکن است ضروری باشند تقریبا چندان واضح نیستند. ارتباط بین ساختار، فعل و انفعالات پویای پروتئین-پروتئین و کاتالیز به خوبی درک نشده است.
تلاشهای طراحی آینده بر بهبود خواص فلورسنت پروتئینهای جدید متمرکز خواهد بود. این امر از طریق دورهای تکراری طراحی، حل ساختارهای کریستالی پروتئین جدید و سپس استفاده از این ساختارها به عنوان راهنمایی برای بهبود بیشتر به دست خواهد آمد. برای درک بهتر شبکه های سیگنالینگ، باید ابزارهایی ایجاد شود که بتواند بین پروتئین ها با تغییرات پس از ترجمه متفاوت تمایز قائل شود.
با طراحی حوزههای پروتئینی که سوبستراهای فسفریله را تشخیص میدهند، پیشرفتهایی حاصل شده است و تلاشهای آینده با ایجاد سویههای باکتریایی که میتوانند اسیدهای آمینه غیرطبیعی را در موقعیتهای خاص ترکیب کنند، آسانتر خواهد شد. محرک های جدید نیز مفید خواهند بود. برای ایجاد مسیرهای مصنوعی پیچیدهتر، نیاز به توسعه سوئیچهای اضافی است که میتوانند برای کنترل فعالیت چندین پروتئین به طور مستقل و در عین حال به حداقل رساندن تداخل با فرآیندهای سلولی بومی استفاده شوند.
همچنین توسعه سوئیچ های مولکولی که می توانند به محرک های مرتبط بیولوژیکی پاسخ دهند مفید خواهد بود. اینها به ایجاد مدارهای مصنوعی برای کاربردهای درمانی، صنعتی و تشخیص کمک زیادی می کنند. تمرکز اصلی دیگر ایجاد روش های جدید برای کنترل پروتئین ها با نور خواهد بود. حوزههای حساس به نور ایجاد خواهند شد که میتوانند طیف وسیعتری از فعالیتهای پروتئینی را کنترل کنند، به محرکهای نوری سریعتر پاسخ دهند و با طول موجهای بلندتر نسبت به طرحهای موجود القا شوند.
تلاشها برای طراحی پروتئینهای جدید ابتدا با هدف افزایش دانش ما از ساختار و فعالیت و همچنین با وعده ایجاد ابزارهای جدید پروتئینی انجام شد. در طول سال ها، درک اولیه ما از پروتئین ها بسیار افزایش یافته است و ما وارد دورانی شده ایم که می توانیم پروتئین های کاربردی تولید کنیم که انقلابی در پزشکی و فناوری ایجاد می کند.
با شرکت در کارآموزی طراحی دارو ژنیران دانش خود را در مورد مبانی طراحی پروتئین افزایش دهید: