بیماری ها
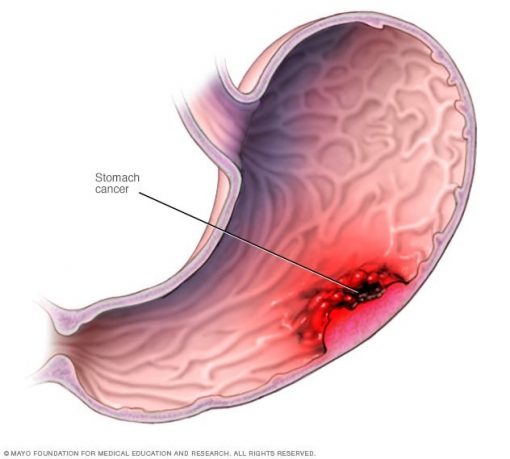
سرطان معده (Stomach Cancer) چیست؟
سرطان معده (Stomach Cancer) چیست؟
سرطان زمانی شروع میشود که سلولهای بدن شروع به رشد خارج از کنترل میکنند. تقریباً سلولهای موجود در هر قسمت از بدن میتوانند به سرطان تبدیل شوند و سپس به سایر قسمتهای بدن گسترش یابند.
سرطان معده (Stomach Cancer) که سرطان گاستریک (gastric cancer) نیز نامیده میشود، زمانی شروع میشود که سلولهای معده شروع به رشد غیر قابل کنترل میکنند.برای درک سرطان معده، دانستن ساختار و عملکرد طبیعی معده به شما کمک میکند.
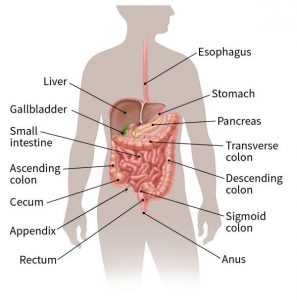
معده یک اندام کیسه مانند است که بخش مهمی از دستگاه گوارش را تشکیل میدهد.
پس از جویدن و بلعیدن، غذا وارد مری (esophagus) میشود، لولهای که غذا را از طریق گلو و قفسه سینه به معده میرساند. مری در محل اتصال معده به مری (GE) که درست زیر دیافراگم (ورقه نازکی از ماهیچه تنفسی زیر ریهها) قرار دارد به معده میپیوندد. سپس معده با ترشح شیره معده شروع به هضم غذا میکند. غذا و شیره معده مخلوط شده و سپس در قسمت اول روده کوچک به نام دوازدهه (duodenum) تخلیه میشود.
برخی از افراد از کلمه “معده” برای اشاره به ناحیه شکم استفاده میکنند. اصطلاح پزشکی این ناحیه معده است. به عنوان مثال، برخی از افراد مبتلا به درد در این ناحیه میگویند که “معده درد” دارند، در حالی که در واقع درد میتواند از برخی از اعضای دیگر آن ناحیه باشد. پزشکان این علامت را “درد شکمی” مینامند زیرا معده تنها یکی از اندامهای موجود در شکم است.
سرطان معده با سایر سرطانهایی که میتوانند در شکم ایجاد شوند، مانند سرطان کولون یا رکتوم (روده بزرگ)، کبد، پانکراس یا روده کوچک متفاوت است. این سرطانها میتوانند علائم متفاوت، دیدگاههای متفاوت و درمانهای متفاوتی داشته باشند.
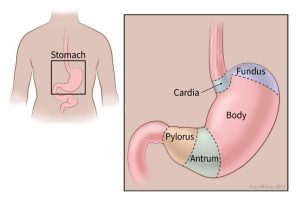
قسمتهایی از معده
معده 5 قسمت دارد.
3 قسمت اول، معده پروگزیمال (proximal stomach) را تشکیل میدهند:
- کاردیا (Cardia): قسمت اول که نزدیک ترین قسمت به مری است.
- فوندوس (Fundus): قسمت فوقانی معده در کنار کاردیا
- بدنه (جسم یا corpus): قسمت اصلی معده، بین قسمتهای فوقانی و تحتانی
برخی از سلولهای این قسمتهای معده، اسید و پپسین (آنزیم گوارشی) تولید میکنند که با هم ترکیب میشوند و شیره معده را میسازند که به هضم غذا کمک میکند. آنها همچنین پروتئینی به نام فاکتور داخلی (intrinsic factor) میسازند که بدن برای جذب ویتامین B12 به آن نیاز دارد.
2 قسمت پایینی، معده دیستال (distal stomach) را تشکیل میدهند:
- آنتروم (Antrum): قسمت پایینی (نزدیک روده کوچک)، جایی که غذا با شیره معده مخلوط میشود.
- پیلور (Pylorus): آخرین قسمت معده که به عنوان دریچه ای برای کنترل تخلیه محتویات معده به روده کوچک عمل میکند.
سایر اندامهای نزدیک معده شامل روده کوچک، کولون (روده بزرگ)، کبد، طحال و لوزالمعده است.
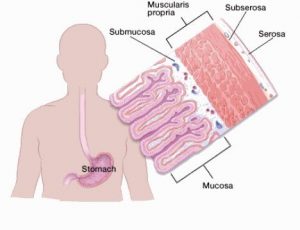
دیواره معده دارای 5 لایه است:
- داخلی ترین لایه مخاط (mucosa) است. در این محل اسید معده و آنزیمهای گوارشی ساخته میشوند. اکثر سرطانهای معده از این لایه شروع میشوند.
- لایه بعدی یک لایه حمایت کننده به نام زیر مخاط (submucosa) است.
- خارج از این لایه، عضله ماهیچه ای ضخیمی است که به حرکت و مخلوط کردن محتویات معده کمک میکند.
- 2 لایه بیرونی، زیر سروز (بافت پیوندی یا همبند یا subserosa) و بیرونی ترین سروز (دیواره معده یا serosa)، معده را احاطه میکنند.
لایهها در تعیین مرحله (وسعت) سرطان مهم هستند و میتواند گزینههای درمانی و وضعیت آتی (چشم انداز) فرد را تحت تاثیر قرار دهد. همان طور که سرطان از مخاط به لایههای عمیقتر رشد میکند، مرحله سرطان پیشرفتهتر میشود و ممکن است نیاز به درمان گستردهتری داشته باشد.
توسعه و گسترش سرطان معده
سرطان معده در طی سالیان متمادی به کندی رشد میکند. قبل از ایجاد یک سرطان واقعی، تغییرات پیش سرطانی اغلب در پوشش داخلی (مخاط) معده رخ میدهد. این تغییرات اولیه به ندرت باعث ایجاد علائمی در فرد شده و بنابراین اغلب شناسایی نمیشوند.
سرطانهایی که در بخشهای مختلف معده شروع میشوند میتوانند علائم مختلفی ایجاد کنند و معمولاً نتایج متفاوتی نیز به همراه دارند. محل سرطان نیز میتواند گزینههای درمانی را تحت تاثیر قرار دهد. به عنوان مثال، سرطانهایی که از محل اتصال GE شروع میشوند یا به آن رشد میکنند، معمولاً مانند سرطانهای مری مرحله بندی و درمان میشوند.
انواع سرطان معده
آدنوکارسینوما (Adenocarcinomas)
بیشتر سرطانهای معده (حدود 90 تا 95 درصد) آدنوکارسینوم هستند. این سرطانها از سلولهای غده ای در داخلی ترین پوشش معده (مخاط) ایجاد میشوند.
اگر به شما گفته شود که سرطان معده (یا سرطان گاستریک) دارید، تقریباً همیشه نوع این سرطان آدنوکارسینوم است. اطلاعات موجود در ادامه این مطلب هم که در مورد سرطان معده صحبت میکند به این نوع سرطان اشاره دارد.
2 نوع اصلی آدنوکارسینوم معده وجود دارد:
- نوع رودهای (intestinal)، تمایل به ایجاد وضعیت (چشم انداز) کمی بهتر برای بیمار دارد. احتمال بیشتری دارد که سلولهای سرطانی تغییرات ژنی خاصی داشته باشند که ممکن است امکان درمان با دارو درمانی هدفمند را فراهم کند.
- نوع منتشره (diffuse)، تمایل به رشد سریعتری دارد. نسبت به نوع روده ای کمتر شایع بوده و درمان آن نیز سخت تر است.

انواع دیگری از سرطانها که میتوانند در معده شروع شود
تومورهای استرومایی دستگاه گوارش (Gastrointestinal stromal tumors یا GIST)
این تومورهای غیر معمول در اشکال بسیار اولیه سلولهای دیواره معده به نام سلولهای بینابینی کژال (interstitial cells of Cajal) شروع میشوند.
برخی از GISTها بسیار بیشتر از سایرین در نواحی دیگر رشد میکنند یا به سایر قسمتهای بدن گسترش مییابند. اگرچه GISTها میتوانند در هر نقطه از دستگاه گوارش شروع شوند اما بیشتر آنها از معده آغاز میشوند
تومورهای نورواندوکرین (Neuroendocrine tumors ،از جمله کارسینوئیدها یا carcinoids)
تومورهای عصبی غدد درون ریز (NETs) در سلولهای معده (یا سایر قسمتهای دستگاه گوارش) شروع میشوند که در برخی جهات مانند سلولهای عصبی و در برخی دیگر مانند سلولهای هورمون ساز (غدد درون ریز) عمل میکنند. بیشتر NETها به کندی رشد کرده و به اندامهای دیگر سرایت نمیکنند اما برخی ازآنها میتوانند به سرعت رشد کرده و گسترش پیدا کنند. NETها با جزئیات بیشتری در تومورهای نورواندوکرین گوارشی (کارسینوئید) مورد بحث قرار میگیرند.
لنفومها (Lymphomas)
این سرطانها در سلولهای سیستم ایمنی به نام لنفوسیتها شروع میشوند. لنفومها معمولا در قسمتهای دیگر بدن شروع میشوند اما برخی ازآنها میتوانند در دیواره معده شروع شوند. درمان و چشمانداز این سرطانها به نوع لنفوم و عوامل دیگر بستگی دارد.
سایر سرطانها
انواع دیگر سرطان مانند کارسینوم سلول سنگفرشی (squamous cell carcinomas)، کارسینوم سلول کوچک (small cell carcinomas) و لیومیوسارکوم (leiomyosarcomas) نیز میتوانند از معده شروع شوند اما این سرطانها بسیار نادر هستند.
علائم و نشانههای سرطان معده
سرطان معده (سرطان گاستریک) در مراحل اولیه به ندرت علائمی را ایجاد میکند. در کشورهایی که غربالگری سرطان معده معمول نیست مانند ایالات متحده، اکثر سرطانهای معده تا زمانی که نسبتاً بزرگ نشده باشند یا به خارج از معده گسترش نیافته باشند، یافت نمیشوند.
هنگامی که سرطان معده علائم و نشانههایی را در فرد ایجاد میکند، این علائم میتواند شامل موارد زیر باشد:
- کم اشتهایی
- کاهش وزن (بدون هیچ گونه فعالیت بدنی یا رژیم)
- درد شکم (belly)
- ناراحتی مبهم در شکم، معمولا بالای ناف
- احساس سیری بعد از صرف یک وعده غذایی کوچک
- سوزش سر دل یا سوء هاضمه
- حالت تهوع
- استفراغ همراه با خون یا بدون آن
- تورم یا تجمع مایع در شکم
- وجود خون در مدفوع
- احساس خستگی یا ضعف در نتیجه داشتن گلبولهای قرمز بسیار کم (کم خونی)
- زرد شدن پوست و چشم (یرقان) در صورت گسترش سرطان به کبد
بیشتر این علائم، اغلب به دلایلی غیر از سرطان معده، مانند عفونت ویروسی یا زخم ایجاد میشوند. برخی از این علائم ممکن است ناشی از انواع دیگر سرطان نیز باشد. اما افرادی که هر یک از این مشکلات را دارند، به خصوص اگر از بین نرفتند یا بدتر شدند، باید به پزشک مراجعه کنند تا در صورت نیاز بتوان علت را پیدا کرده و آن را درمان کرد.
چه چیزی باعث سرطان معده میشود؟
تعداد زیادی عامل خطرزا شناخته شده برای سرطان معده وجود دارد اما اغلب دقیقاً مشخص نیست که چگونه این عوامل ممکن است بر نحوه تبدیل سلولهای معده به سلولهای سرطانی تأثیر بگذارند. این موضوع در طی تحقیقاتی در حال بررسی است.
تغییرات پیش سرطانی در معده
تغییرات متعددی که تصور میشود پیش سرطانی هستند میتوانند در پوشش داخلی معده رخ دهند.
در گاستریت آتروفیک (Atrophic gastritis)، سلولهای غده طبیعی معده یا کمتر تعداد معمول هستند یا اصلا وجود ندارند. همچنین درجاتی از التهاب نیز در معده وجود دارد (که در آن سلولهای معده توسط سلولهای سیستم ایمنی آسیب میبینند). گاستریت آتروفیک اغلب در اثر عفونت با باکتری هلیکوباکتر پیلوری ایجاد میشود. همچنین میتواند ناشی از یک واکنش خود ایمنی باشد که در آن سیستم ایمنی فرد به سلولهای پوششی معده حمله میکند. برخی از افراد مبتلا به این بیماری به کم خونی خطرناک یا سایر مشکلات معده از جمله سرطان مبتلا میشوند.
یکی دیگر از تغییرات احتمالی پیش سرطانی متاپلازی روده (intestinal metaplasia) است. در این شرایط، سلولهایی که به طور معمول روی معده قرار دارند، با سلولهایی که شبیه سلولهایی هستند که معمولاً روده را پوشاندهاند، جایگزین میشوند. افراد مبتلا به این بیماری اغلب گاستریت آتروفیک مزمن نیز دارند. این پدیده ممکن است به عفونت هلیکوباکتر پیلوری نیز مربوط باشد.
هم گاستریت آتروفیک و هم متاپلازی رودهای میتوانند منجر به داشتن سلولهای غدهای بسیار کمی شوند که معمولاً موادی ترشح میکنند که به محافظت از سلولهای پوشش داخلی معده کمک میکند. آسیب به DNA درون این سلولها گاهی اوقات میتواند منجر به دیسپلازی (dysplasia) شود که در آن سلولها بزرگتر شده و ظاهری بسیار غیر عادی پیدا میکنند (بیشتر شبیه سلولهای سرطانی). در برخی موارد، دیسپلازی میتواند به سرطان معده تبدیل شود.
تغییرات در ژنها (DNA) در سلولهای سرطانی معده
تحقیقات اخیر سرنخهایی در مورد چگونگی شکل گیری برخی سرطانهای معده ارائه کرده است. به عنوان مثال، باکتری هلیکوباکتر پیلوری (H pylori bacteria)، به ویژه انواع فرعی خاصی از آن، میتواند مواد موجود در برخی غذاها را به مواد شیمیایی تبدیل کند که باعث جهش (تغییر) در DNA سلولهای پوشش معده میشود. این اتفاق ممکن است توضیح دهد که چرا برخی غذاها مانند گوشتهای کنسرو شده خطر ابتلا به سرطان معده را در افراد افزایش میدهند. از سوی دیگر، برخی از غذاهایی که ممکن است خطر سرطان معده را کاهش دهند، مانند میوهها و سبزیجات، حاوی آنتی اکسیدانهایی (مانند ویتامینهای A و C) هستند که میتوانند مواد آسیب دهنده به DNA سلول را مسدود کنند.
سرطان معده نیز مانند سایر سرطانها در اثر تغییر در DNA داخل سلولها ایجاد میشود. DNA ماده شیمیایی است که حامل ژنهای ماست که عملکرد سلولهای ما را کنترل میکند. ما شبیه والدین خود هستیم زیرا آنها منبع DNA ما هستند. اما DNA بر چیزی بیشتر از ظاهر ما تأثیر میگذارد.
برخی از ژنها زمان رشد سلولها، تقسیم به سلولهای جدید و مرگ را کنترل میکنند:
- ژنهایی که به طور معمول به رشد، تقسیم شدن و زنده ماندن سلولها کمک میکنند، گاهی اوقات میتوانند به انکوژن (oncogenes) تبدیل شوند.
- ژنهایی که به کنترل تقسیم سلولی، ترمیم اشتباهات در DNA یا مرگ سلولها در زمان مناسب کمک میکنند، ژنهای سرکوب کننده تومور (called tumor suppressor genes) نامیده میشوند.
سرطانها میتوانند ناشی از تغییرات DNA باشند که انکوژنها را روشن نگه میدارند یا ژنهای سرکوب کننده تومور را خاموش میکنند.
جهشهای ژنی ارثی در مقابل اکتسابی
جهشهای ارثی در برخی از ژنها (همان طور که در فاکتورهای خطرزای سرطان معده توضیح داده شده است) میتواند خطر ابتلا به سرطان معده را افزایش دهد. اما تصور میشود که اینها تنها باعث ایجاد درصد کمی از سرطانهای معده میشوند.
بیشتر تغییرات ژنی که منجر به سرطان معده میشوند پس از تولد رخ میدهند. برخی از این جهشهای اکتسابی ممکن است ناشی از عوامل خطرزایی مانند عفونت هلیکوباکتر پیلوری یا مصرف تنباکو باشد. اما سایر تغییرات ژنی ممکن است فقط رویدادهای تصادفی باشد که گاهی اوقات در داخل سلولها اتفاق میافتد، بدون اینکه علت خارجی داشته باشد.
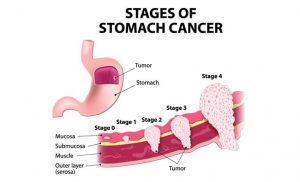
مراحل سرطان معده
پس از تشخیص سرطان معده (سرطان گاستریک)، پزشکان معاینات و آزمایشاتی را برای تعیین اینکه آیا گسترش یافته است یا خیر، انجام میدهند. این فرآیند مرحله (سطح) بندی نامیده میشود. مرحله سرطان میزان سرطان در بدن را توصیف میکند. این کار به تعیین اینکه سرطان چقدر جدی است و انتخاب بهترین روش درمان آن کمک میکند. پزشکان همچنین هنگام صحبت در مورد آمار زنده مانی از مرحله سرطان استفاده میکنند.
اگرچه تجربه سرطان هر شخص منحصر به فرد است اما سرطانهایی که مراحل مشابه دارند، چشم انداز مشابهی نیز داشته و اغلب به روش مشابهی نیز درمان میشوند.
سیستم مرحله بندی AJCC TNM
سیستم مرحله بندی که اغلب برای سرطان معده استفاده میشود، سیستم TNM کمیته مشترک آمریکایی سرطان (AJCC) است که آخرین بار در سال 2018 به روز شد.
از این سیستم برای مرحله بندی تمام سرطانهای معده (کارسینوم) به جز سرطانهایی که از محل اتصال معده به مری (جایی که معده و مری به هم میرسند) یا سرطانهایی که از کاردیا (نخستین قسمت معده) شروع میشوند و در محل اتصال معده به مری رشد میکنند، استفاده میشود. این سرطانها مانند سرطانهای مری مرحله بندی میشوند (و اغلب به همان روش نیز درمان میشوند). سایر انواع سرطان که میتوانند در معده شروع شوند، مانند تومورهای استرومایی دستگاه گوارش (GISTs) و لنفومها نیز مراحل متفاوتی دارند.
سیستم TNM برای سرطان معده بر اساس 3 اطلاعات کلیدی است:
دسته T وسعت تومور اصلی (اولیه) را توصیف میکند، از جمله اینکه سرطان تا چه حد در لایههای دیواره معده رشد کرده است و اینکه آیا به ساختارها یا اندامهای مجاور رسیده است یا خیر.
5 لایه دیواره معده شامل:
- مخاط: داخلی ترین لایه، جایی که تقریباً همه سرطانهای معده از آنجا شروع میشود. مخاط دارای 3 قسمت است: سلولهای اپیتلیال، لایهای از بافت همبند (لامینا پروپریا یا lamina propria) و لایه نازکی از ماهیچه (مخاط عضلانی).
- Submucosa: یک لایه پشتیبان در زیر مخاط
- Muscularis propria: لایه ضخیم ماهیچه ای که محتویات معده را حرکت داده و مخلوط میکند
- ساب سروز یا بافت پیوندی
- سروزا: لایه بیرونی و پیچیده معده
دسته N هر سرطانی را توصیف میکند که به غدد لنفاوی مجاور گسترش یابد.
دسته M هر گونه گسترش (متاستاز) به قسمتهای دورتر بدن مانند کبد یا ریهها را توصیف میکند.
اعداد یا حروف بعد از T، N و M جزئیات بیشتری در مورد هر یک از این عوامل ارائه میدهند. اعداد بالاتر به معنای پیشرفته تر بودن سرطان است.
گروه بندی مرحلهای
هنگامی که دسته بندیهای T، N و M یک فرد مشخص شد، این اطلاعات در فرآیندی به نام گروه بندی مرحله ای ترکیب میشوند تا یک مرحله کلی را تعیین کنند. مراحل اولیه سرطان معده مرحله 0 (سرطان در محل یا carcinoma in situ) نامیده میشوند و سپس این مراحل از I (1) تا IV (4) متغیرند. هرچه این عدد کمتر باشد، سرطان کمتر گسترش یافته است.
مرحله بندی را میتوان در زمانهای مختلف انجام داد.
سرطان معده ممکن است در زمانهای مختلف در طول دوره درمانی فرد، مرحله بندی شود.
معمولاً ابتدا به سرطان یک مرحله بالینی نسبت داده میشود. این کار بر اساس نتایج معاینات فیزیکی، بیوپسی، آزمایشهای تصویر برداری و روشها (مانند آندوسکوپی فوقانی یا لاپاراسکوپی) است که قبلاً انجام شده است. (این معاینات و آزمایشات در بخشهای پیش رو توضیح داده شده اند.) تعیین مرحله بالینی میتواند برای کمک به برنامه ریزی درمان استفاده شود.
اگر جراحی برای برداشتن سرطان انجام شود، مرحله پاتولوژیک (pathological stage که مرحله جراحی نیز نامیده میشود) را میتوان تعیین کرد. این کار بر اساس نتایج هر آزمایش یا آزمایشاتی است که انجام شده است. همچنین نتایج حاصل از جراحی نیز در آن دخیل است. گاهی اوقات مرحله پاتولوژیک با مرحله بالینی متفاوت است – به عنوان مثال، حالتی که جراحی نشان دهد که سرطان بیشتر از آنچه در آزمایشات تصویر برداری دیده میشود، گسترش یافته است.
برخی از افراد ممکن است قبل از جراحی از درمانهای دیگری مانند شیمی درمانی یا پرتو درمانی استفاده کنند تا سرطان را کوچک کرده و جراحی را آسانتر کنند. این کار به عنوان درمان نئوادجوانت (neoadjuvant treatment) شناخته میشود. بیماری ممکن است پس از گذراندن این روند درمانی مجدداً مرحله بندی شود تا میزان اثر بخشی آن ارزیابی گردد.
اگر سرطان شما از نظر بالینی مرحله بندی شده است یا اگر درمان نئوادجوانت داشتهاید، بهتر است در مورد مرحله خاص بیماری خود با پزشکتان صحبت کنید.
عوامل خطرزای سرطان معده
عامل خطرزا هر چیزی است که شانس ابتلا به بیماری مانند سرطان را افزایش دهد. سرطانهای مختلف عوامل خطرزای متفاوتی دارند. برخی از عوامل خطرزا مانند سیگار کشیدن را میتوان تغییر داد. سایر موارد، مانند سن یا سابقه خانوادگی فرد، قابل تغییر نیستند.
اما داشتن یک عامل خطرساز یا حتی چندین عامل به این معنی نیست که شما به این بیماری مبتلا خواهید شد. بسیاری از افراد با یک یا چند عامل خطرزا هرگز به سرطان مبتلا نمیشوند، در حالی که برخی دیگر که به سرطان مبتلا میشوند ممکن است عوامل خطرساز شناخته شده کمی داشته باشند یا اصلا چنین عواملی را نداشته باشند.
دانشمندان چندین عامل خطرزا را پیدا کردهاند که احتمال ابتلای فرد به سرطان معده را افزایش میدهند. برخی از اینها قابل کنترل هستند اما برخی دیگر را نمیتوان کنترل کرد.
جنسیت
سرطان معده در مردان بیشتر از زنان شایع است.
سن
سرطان معده ممکن است در افراد جوان نیز اتفاق بیفتد اما این خطر با افزایش سن افزایش مییابد. اکثر افرادی که به سرطان معده مبتلا میشوند در دهه 60، 70 یا 80 سالگی خود هستند.
قومیت
در ایالات متحده، سرطان معده در آمریکاییهای اسپانیایی تبار، آفریقایی-آمریکاییها، بومیان آمریکایی و ساکنان جزایر آسیایی یا اقیانوسیه بیشتر از سفید پوستان غیر اسپانیایی تبار شایع است.
جغرافیا
در سراسر جهان، سرطان معده در شرق آسیا، شرق اروپا و آمریکای جنوبی و مرکزی شایع تر است. این بیماری در آفریقا و آمریکای شمالی کمتر دیده میشود.
عفونت هلیکوباکتر پیلوری
به نظر میرسد عفونت با باکتری هلیکوباکتر پیلوری (H pylori) یکی از دلایل اصلی سرطان معده، به ویژه سرطان در قسمت تحتانی (دیستال) معده میباشد. عفونت طولانی مدت معده با این میکروب ممکن است منجر به گاستریت آتروفیک و سایر تغییرات پیش سرطانی در پوشش داخلی معده شود.
افراد مبتلا به سرطان معده نسبت به افراد بدون این سرطان، میزان عفونت هلیکوباکتر پیلوری بالاتری دارند. عفونت هلیکوباکتر پیلوری نیز با برخی از انواع لنفوم معده مرتبط است. با این حال، اکثر افرادی که این میکروب را در معده خود حمل میکنند، هرگز به سرطان مبتلا نمیشوند.
اضافه وزن یا چاق بودن
اضافه وزن یا چاقی با افزایش خطر ابتلا به سرطانهای کاردیا (قسمت فوقانی معده در نزدیکی مری) مرتبط است.
رژیم غذایی
خطر ابتلا به سرطان معده در افرادی که رژیم غذایی آنها شامل مقادیر زیادی از غذاهای نگهداری شده با نمک مانند ماهی و گوشت شور و ترشی سبزیجات است، افزایش مییابد.
به نظر میرسد خوردن گوشتهای فرآوری شده، کبابی یا ذغالی شده به طور منظم خطر ابتلا به سرطان معده غیر کاردیا را افزایش میدهد.
خوردن کم میوه یا عدم خوردن این مواد غذایی به احتمال زیاد خطر ابتلا به سرطان معده را افزایش میدهد. از سوی دیگر، به نظر میرسد خوردن مقدار زیادی میوههای تازه (به ویژه مرکبات) و سبزیجات خام خطر ابتلا به سرطان معده را کاهش میدهد.
مصرف الکل
مصرف الکل احتمالا خطر ابتلا به سرطان معده را افزایش میدهد. شواهد این ارتباط برای افرادی که 3 واحد یا بیشتر نوشیدنی الکلی در روز مصرف میکنند، قوی تر است.
مصرف تنباکو
سیگار کشیدن خطر ابتلا به سرطان معده را افزایش میدهد، به ویژه برای سرطانهای قسمت فوقانی معده در نزدیکی مری. میزان سرطان معده در افرادی که سیگار میکشند دو برابر میشود.
جراحی قبلی معده
احتمال بروز سرطان معده در افرادی که بخشی از معده خود را برای درمان بیماریهای غیر سرطانی مانند زخم برداشتهاند، بیشتر است. این پدیده ممکن است به این دلیل باشد که معده اسید کمتری تولید میکند و اجازه میدهد تا باکتریهای مضر بیشتری وجود داشته باشند. رفلاکس (Reflux یا بازگشت) صفرا از روده کوچک به معده پس از جراحی نیز ممکن است به افزایش این خطر بیافزاید. این سرطانها معمولاً سالها پس از جراحی ایجاد میشوند.
برخی از انواع پولیپ معده (stomach polyps)
پولیپها تودههای غیر سرطانی روی پوشش معده هستند. به نظر نمیرسد که اکثر انواع پولیپها (مانند پولیپ هایپرپلاستیک (hyperplastic polyps) یا پولیپهای التهابی (inflammatory polyps)) خطر ابتلا به سرطان معده را در افراد افزایش دهند. اما پولیپهای آدنوماتوز – که آدنوم (adenomas) نیز نامیده میشوند – گاهی اوقات میتوانند به سرطان تبدیل شوند.
کم خونی خطرناک (Pernicious anemia)
سلولهای خاصی در پوشش معده به طور معمول ماده ای به نام فاکتور داخلی (IF) میسازند که بدن برای جذب ویتامین B12 از غذاها به آن نیاز دارد. افراد بدون IF کافی ممکن است با کمبود ویتامین B12 مواجه شوند که بر توانایی بدن در ساخت گلبولهای قرمز جدید تأثیر میگذارد و میتواند مشکلات دیگری را نیز ایجاد کند. این وضعیت که کم خونی پرنیشیوز (Pernicious anemia) نامیده میشود، میتواند در اثر برخی شرایط خود ایمنی و همچنین برخی از انواع جراحی معده ایجاد شود. در افراد مبتلا به این بیماری همراه با کم خونی (داشتن گلبولهای قرمز بسیار کم)، خطر ابتلا به سرطان معده را افزایش مییابد.
بیماری منتریه (گاستروپاتی هیپرتروفیک یا Menetrier disease)
در این شرایط، رشد بیش از حد پوشش داخلی معده باعث ایجاد چینهای بزرگ در پوشش داخلی معده و کاهش سطح اسید معده میشود. از آن جایی که این بیماری بسیار نادر است، دقیقاً مشخص نیست که چقدر خطر ابتلا به سرطان معده را افزایش میدهد.
سندرمهای سرطانی ارثی
برخی از افراد جهشهای ژنی (تغییرات) را از والدین خود به ارث میبرند که منجر به ایجاد شرایطی میشود که میتواند خطر ابتلا به سرطان معده را در آنها افزایش دهد. این سندرمهای ارثی تنها درصد کمی از سرطانهای معده را در سراسر جهان تشکیل میدهند.
سرطان معده منتشره ارثی (Hereditary diffuse gastric cancer یا HDGC)
این سندرم ارثی خطر ابتلا به سرطان معده را به شدت افزایش میدهد. این وضعیت نادر است اما خطر ابتلا به سرطان معده در طول زندگی در میان افراد مبتلا 70 درصد است. زنان مبتلا به این سندرم نیز در معرض خطر ابتلا به سرطان سینه تهاجمی لوبولار (invasive lobular breast cancer) هستند. این سندرم اغلب به دلیل جهش در ژن CDH1 ایجاد میشود.
سندرم لینچ (Lynch syndrome، سرطان ارثی کولورکتال غیر پولیپوز یا HNPCC)
سندرم لینچ (که قبلا HNPCC نامیده میشد) یک اختلال ژنتیکی ارثی است که خطر ابتلا به سرطان کولورکتال، سرطان معده و برخی سرطانهای دیگر را افزایش میدهد. این سندرم در اثر جهش در یکی از ژنهای ترمیم عدم تطابق (MMR) مانند MLH1 یا MSH2 ایجاد میشود. این ژنها به طور معمول به ترمیم DNA آسیب دیده کمک میکنند.
پولیپ آدنوماتوز خانوادگی (FAP یا Familial adenomatous polyposis)
افراد مبتلا به FAP از سنین پایین شروع به ساخت پولیپهای زیادی در روده بزرگ و گاهی اوقات در معده و روده خود میکنند. افراد مبتلا به این سندرم در معرض خطر بسیار بالایی برای ابتلا به سرطان روده بزرگ و خطر کمی برای ابتلا به سرطان معده هستند. FAP در اثر جهش در ژن APC ایجاد میشود.
آدنوم معده و پولیپ پروگزیمال معده (GAPPS یا Gastric adenoma and proximal polyposis of the stomach)
این وضعیت نادر به دلیل جهش در بخش خاصی از ژن APC ایجاد میشود. افراد مبتلا به GAPPS پولیپهای زیادی در معده خود ایجاد میکنند و خطر ابتلا به سرطان معده را افزایش میدهند.
سندرم Li-Fraumeni
افراد مبتلا به این سندرم در معرض خطر ابتلا به انواع مختلفی از سرطانها از جمله ابتلا به سرطان معده در سنین نسبتاً پایین هستند. سندرم Li-Fraumeni به دلیل جهش در ژن TP53 ایجاد میشود.
سندرم پوتز جگرز (PJS یا Peutz-Jeghers syndrome)
افراد مبتلا به این عارضه در معده و روده و همچنین در نواحی دیگر از جمله بینی، مجاری تنفسی ریهها و مثانه دچار پولیپ میشوند. پولیپهای معده و روده هامارتوم (hamartomas) نامیده میشوند. آنها میتوانند مشکلاتی مانند خونریزی یا انسداد روده ایجاد کنند. PJS همچنین میتواند باعث ایجاد لکههای تیره مانند کک و مک روی لبها، داخل گونهها و سایر نواحی بدن شود. افراد مبتلا به PJS در معرض افزایش خطر ابتلا به انواع مختلف سرطان از جمله سرطان روده بزرگ، پانکراس، معده و سینه هستند. این سندرم در اثر جهش در ژن STK11 ایجاد میشود.
سابقه خانوادگی سرطان معده
افرادی که دارای بستگان درجه یک (والدین، خواهر و برادر یا فرزندان) هستند که سرطان معده داشته اند، حتی بدون ابتلا به یکی از سندرمهای سرطانی ارثی که در بالا توضیح داده شد، بیشتر در معرض ابتلا به این بیماری هستند. با این حال، اکثر افرادی که به سرطان معده مبتلا میشوند، سابقه خانوادگی آن را ندارند.
نقص ایمنی متغیر رایج (CVID یا Common variable immune deficiency)
در افراد مبتلا به CVID، سیستم ایمنی نمیتواند آنتی بادیهای کافی برای محافظت در برابر میکروبها را بسازد. این اتفاق میتواند منجر به ابتلا به عفونتهای مکرر و همچنین مشکلات دیگر از جمله گاستریت آتروفیک و کم خونی خطرناک شود. افراد مبتلا به CVID بیشتر در معرض ابتلا به لنفوم معده و سرطان معده هستند.
عفونت ویروس اپشتین بار (EBV یا Epstein-Barr virus)
ویروس اپشتین بار باعث مونونوکلئوز عفونی (infectious mononucleosis) میشود (که مونو (mono) نیز نامیده میشود). اکثر افراد در دوره ای از زندگی خود، معمولاً در کودکی یا نوجوانی، به این ویروس مبتلا میشوند.
EBV با سرطان نازوفارنکس (nasopharyngeal cancer) و برخی از اشکال لنفوم مرتبط است. همچنین این ویروس در سلولهای سرطانی حدود 5 تا 10 درصد افراد مبتلا به سرطان معده یافت میشود، اگرچه هنوز مشخص نیست که آیا این ویروس واقعاً باعث سرطان معده میشود یا خیر. سرطانهای معده مرتبط با EBV رشد کندتری داشته و تمایل کمتری نیز به گسترش دارند.
مشاغل خاص
به نظر میرسد کارگران در صنایع زغال سنگ، فلز و لاستیک در معرض خطر بیشتری برای ابتلا به سرطان معده هستند.
داشتن گروه خونی A
گروههای خونی به مواد خاصی اطلاق میشود که به طور معمول در سطح گلبولهای قرمز و برخی دیگر از انواع سلولها وجود دارند. این گروهها در تطبیق خون برای انتقال خون مهم هستند. به دلایل ناشناخته، افراد دارای گروه خونی A در معرض خطر بیشتری برای ابتلا به سرطان معده هستند.
آیا میتوان از ابتلا به سرطان معده پیشگیری کرد؟
هیچ راه مطمئنی برای پیشگیری از سرطان معده وجود ندارد اما کارهایی وجود دارد که میتوانید با انجام آنها خطر ابتلا به این سرطان را در خود کاهش دهید.
رژیم غذایی، تغذیه، وزن بدن، فعالیت بدنی و مصرف الکل
اضافه وزن یا چاقی خطر ابتلا به برخی از انواع سرطان معده را افزایش میدهد، بنابراین رسیدن به وزن مناسب و حفظ آن ممکن است خطر ابتلا به این بیماری را کاهش دهد.
انجام فعالیت بدنی منظم ممکن است به کاهش خطر ابتلا به سرطان معده نیز کمک کند.
جدای از اثرات احتمالی این عامل بر خطر ابتلا به سرطان معده، حفظ وزن سالم و فعال بودن ممکن است خطر ابتلا به چندین سرطان و مشکلات سلامتی دیگر را نیز کاهش دهد.
رژیم غذایی حاوی مقدار زیادی میوه و سبزیجات تازه احتمالا خطر ابتلا به سرطان معده را نیز کاهش میدهد. به خصوص مرکبات (مانند پرتقال، لیمو و گریپ فروت) ممکن است مفید باشند اما توجه داشته باشید که گریپ فروت و آب گریپ فروت میتوانند سطوح خونی داروهای خاصی را که مصرف میکنید، تغییر دهند. قبل از افزودن گریپ فروت به رژیم غذایی خود با تیم پزشکی خود در این مورد صحبت کنید.
انجمن سرطان آمریکا توصیه میکند که افراد از یک الگوی غذایی سالم پیروی کنند که شامل انواع میوهها و سبزیجات رنگارنگ و غلات کامل است و از مصرف گوشت قرمز و فرآوری شده، نوشیدنیهای شیرین شده با شکر و غذاهای بسیار فرآوری شده پرهیز کرده و یا مصرف آنها را محدود میکند.
مصرف الکل احتمالاً خطر ابتلا به سرطان معده را افزایش میدهد، بنابراین اجتناب از مصرف الکل یا محدود کردن مصرف آن ممکن است خطر ابتلا را کاهش دهد.
مطالعاتی که به سایر عوامل غذایی مانند مصرف مکملهای غذایی یا نوشیدن چای (به ویژه چای سبز) پرداختهاند، در مورد کاهش خطر ابتلا به سرطان معده به نتایج قطعی منتهی نشده اند. تحقیقات بیشتری در این زمینهها مورد نیاز است.
سیگار نکشیدن
سیگار کشیدن میتواند خطر ابتلا به سرطانهای بالای معده (نزدیک ترین قسمت به مری) را افزایش دهد. مصرف تنباکو خطر ابتلا به بسیاری از انواع دیگر سرطان را نیز افزایش میدهد. اگر از تنباکو استفاده نمیکنید، مصرف آن را آغاز نکنید.
درمان عفونت هلیکوباکتر پیلوری
هنوز مشخص نیست افرادی که پوشش معده آنها به طور مزمن به باکتری هلیکوباکتر پیلوری آلوده است اما هیچ علامتی ندارند باید با آنتی بیوتیک درمان شوند یا خیر. این موضوع تحقیقات فعلی است. برخی از مطالعات نشان داده اند که دادن آنتی بیوتیک به افراد مبتلا به عفونت هلیکوباکتر پیلوری ممکن است تعداد ضایعات پیش سرطانی در معده را کاهش داده و خطر ابتلا به سرطان معده را کاهش دهند. اما همه مطالعات این نتایج را پیدا نکردهاند.
در حالی که هنوز مشخص نیست که آیا همه افراد مبتلا به عفونت هلیکوباکتر پیلوری باید درمان شوند یا خیر، برخی تحقیقات نشان داده اند که ممکن است درمان افراد مبتلا به هلیکوباکتر پیلوری که به دلایل دیگر در معرض خطر بالاتر سرطان معده هستند، مانند داشتن یک خویشاوند نزدیک مبتلا به سرطان معده، مفید باشد.
تحقیقات بیشتری لازم است تا مطمئن شویم که روند درمان سایر گروههای افراد مبتلا به عفونت هلیکوباکتر پیلوری میتواند خطر سرطان معده را کاهش دهد یا خیر.
اگر پزشک شما فکر میکند که ممکن است عفونت هلیکوباکتر پیلوری داشته باشید، روشهای مختلفی برای آزمایش وجود دارد؛ از جمله آزمایش تنفس، آزمایش خون، آزمایش مدفوع، و روش آندوسکوپی که در آن بیوپسی (نمونه برداری) انجام میشود. (به آزمایشات مربوط به سرطان معده مراجعه کنید.)
مصرف آسپرین
به نظر میرسد استفاده از آسپرین یا سایر داروهای ضد التهابی غیر استروئیدی (NSAIDs) مانند ایبوپروفن (ibuprofen) یا ناپروکسن (naproxen) خطر ابتلا به سرطان معده را کاهش میدهد. این داروها همچنین میتوانند خطر ابتلا به پولیپ روده بزرگ و سرطان روده بزرگ را نیز کاهش دهند. اما آنها همچنین میتوانند باعث خونریزی داخلی جدی (و حتی تهدید کردن حیات فرد) و سایر خطرات بالقوه سلامتی در برخی افراد شوند.
اکثر پزشکان کاهش خطر ابتلا به سرطان را برای افرادی که این داروها را به دلایل دیگری مانند درمان آرتریت (arthritis) مصرف میکنند، یک مزیت اضافه میدانند. اما پزشکان به طور معمول مصرف NSAIDها را به طور خاص برای پیشگیری از سرطان معده توصیه نمیکنند. مطالعات هنوز مشخص نکرده اند که مزایای کاهش خطر ابتلا به سرطان برای چه افرادی بر خطرات عوارض خونریزی بیشتر است.
برای افرادی که به شدت در معرض خطر هستند
سرطان معده منتشره ارثی (HDGC) یک بیماری ارثی نادر است که در آن افراد در معرض خطر ابتلا به سرطان معده هستند که اغلب در سنین پایین ایجاد میشود. این سندرم نادر اغلب به دلیل جهش ارثی در ژن CDH1 ایجاد میشود.
بسیار مهم است که افراد و خانوادههای مبتلا به این سندرم ارثی را بشناسید زیرا اکثر افرادی که به آن مبتلا هستند به سرطان معده مبتلا میشوند. خانوادههای مبتلا به HDGC معمولاً دو یا چند نفر از خویشاوندان نزدیک که به سرطان معده (معمولاً نوع منتشره) مبتلا شده اند و یا حداقل یک نفر که قبل از سن 50 سالگی مبتلا به این سرطان تشخیص داده شده اند، دارند. برخی از اعضای این خانوادهها نیز ممکن است به سرطان سینه لوبولار تهاجمی مبتلا شوند.
پزشکان اغلب افرادی را که ممکن است HDGC داشته باشند به یک متخصص ژنتیک ارجاع میدهند، بنابراین آنها میتوانند در مورد انجام آزمایشات ژنتیکی با پزشک خود صحبت کنند. اگر آزمایش انجام شود و نشان دهد که یک فرد دارای جهش (تغییر غیر طبیعی) در ژن CDH1 است، پزشکان اغلب توصیه میکنند که قبل از ایجاد سرطان، معده خود را (معمولاً بین 20 تا 30 سالگی) از بدن خارج کنند. با این حال، این عمل (به نام گاسترکتومی کامل یا total gastrectomy) میتواند منجر به تغییرات طولانی مدت در نحوه غذا خوردن فرد شود.
برخی دیگر از سندرمهای سرطانی ارثی نیز با افزایش خطر ابتلا به سرطان معده مرتبط هستند؛ از جمله سندرم لینچ (Lynch syndrome)، پولیپوز آدنوماتوز خانوادگی (FAP)، سندرم Li-Fraumeni، و سندرم Peutz-Jeghers. خطر ابتلا به سرطان معده با این سندرمها تقریباً به اندازه HDGC نیست، بنابراین برداشتن معده معمولاً برای افرادی که این سندرمها را دارند، توصیه نمیشود. با این حال، پزشکان ممکن است انجام آزمایشهای منظم را برای یافتن زود هنگام سرطان معده در برخی از این افراد توصیه کنند.
آیا سرطان معده زود تشخیص داده میشود؟
غربالگری، انجام آزمایش برای یک بیماری مانند سرطان، در افراد بدون علائم است.
برخی از آزمایشهایی که میتوانند برای غربالگری سرطان معده استفادهد شوند مانند آندوسکوپی فوقانی (upper endoscopy)، در تستهای سرطان معده توضیح داده شدهاند.
غربالگری سرطان معده در افراد در معرض خطر متوسط
هیچ سازمان پزشکی بزرگی در ایالات متحده غربالگری معمول سرطان معده را در افراد در معرض خطر متوسط توصیه نمیکند. این کار عمدتاً به این دلیل است که این بیماری در ایالات متحده رایج نیست، بنابراین مزایای غربالگری به احتمال زیاد بیشتر از مضرات احتمالی نیست (مانند نیاز به آزمایشها یا روشهای اضافی، حتی در برخی از افرادی که ممکن است در نهایت سرطان معده نداشته باشند).
از آن جایی که غربالگری معمول سرطان معده در ایالات متحده انجام نمیشود، اکثر افراد تا زمانی که علائم و نشانههای خاصی که به نیاز به آزمایشهای پزشکی اشاره میکنند را انجام نمیدهند، مبتلا به سرطان معده تشخیص داده نمیشوند.
در برخی از کشورهای آسیای شرقی و آمریکای جنوبی که سرطان معده بسیار شایعتر است، غربالگری انبوه جمعیت به یافتن بسیاری از سرطانهای معده در مراحل اولیه و احتمالاً قابل درمانتر کمک کرده است. با این حال، مشخص نیست که آیا این کار منجر به کاهش تعداد مرگ و میر ناشی از سرطان معده شده است یا خیر.
غربالگری سرطان معده در افراد در معرض خطر
مزایای غربالگری ممکن است در برخی از افرادی که در معرض خطر ابتلا به سرطان معده هستند بیشتر باشد، زیرا آنها عوامل خطرزای خاصی دارند (به عنوان مثال، برخی از شرایط بالقوه پیش سرطانی معده یا شرایط ارثی مانند سندرم لینچ یا پولیپوز آدنوماتوز خانوادگی [FAP]). به عنوان مثال، آندوسکوپی فوقانی ممکن است در فواصل منظم در این افراد توصیه شود.
اگر عوامل خطرزایی دارید که ممکن است خطر ابتلا به سرطان معده را افزایش دهد، با پزشک خود در مورد مزایا و معایب احتمالی غربالگری سرطان معده صحبت کنید.
غربالگری معمولاً برای افراد خانوادههای مبتلا به سرطان معده منتشره ارثی (HDGC) توصیه نمیشود. در عوض، پزشکان اغلب توصیه میکنند که افرادی که تغییراتی در ژن CDH1 دارند که باعث این سندرم میشود، برداشتن معده خود (گاسترکتومی کامل) را در نظر بگیرند زیرا خطر ابتلا به سرطان معده در آنها بسیار بالا است.
آزمایشات سرطان معده
سرطان معده (همچنین به عنوان سرطان گاستریک شناخته میشود) معمولاً زمانی تشخیص داده میشود که فرد به دلیل علائم یا علائمی که دارد به پزشک مراجعه کند. در صورت مشکوک بودن به سرطان معده، معاینات و آزمایشاتی لازم است تا از ابتلا به بیماری مطمئن شوید. اگر سرطان تشخیص داده شود، ممکن است آزمایشهای دیگری برای کسب اطلاعات بیشتر در مورد آن مورد نیاز باشد.
تاریخچه پزشکی، معاینه فیزیکی و آزمایشاتی برای بررسی خونریزی
هنگام گرفتن سابقه پزشکی، پزشک در مورد علائم شما (مانند مشکلات موجود در خوردن، درد، نفخ و غیره) و عوامل خطرزای احتمالی میپرسد تا ببیند آیا این عوامل ممکن است نشان دهنده سرطان معده باشد یا علت دیگری دارد. معاینه فیزیکی میتواند اطلاعاتی را در مورد علائم احتمالی سرطان معده یا سایر مشکلات سلامتی به پزشک شما بدهد. به ویژه، پزشک شکم شما را برای بررسی وجود هر چیز غیر طبیعی معاینه میکند.
پزشک ممکن است آزمایش خون را برای بررسی کم خونی (تعداد کم گلبولهای قرمز خون) که میتواند ناشی از خونریزی معده در طی سرطان معده باشد، تجویز کند. همچنین ممکن است آزمایشی برای جستجوی خون در مدفوع (feces) انجام شود که با چشم غیر مسلح قابل مشاهده نیست. نتایج این آزمایش هم میتواند نشانه خونریزی در معده باشد.
اگر پزشک فکر میکند که ممکن است سرطان معده یا نوع دیگری از اختلالات معده داشته باشید، احتمالاً شما را به یک متخصص گوارش (پزشکی که بیماریهای دستگاه گوارش را درمان میکند) ارجاع میدهد که شما را معاینه کند و حتی ممکن است آزمایشهای بیشتری را انجام دهد.
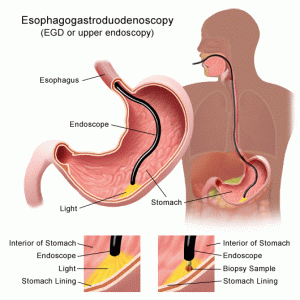
آندوسکوپی فوقانی
آندوسکوپی فوقانی (که ازوفاگوگاسترودئودنوسکوپی یا EGD نیز نامیده میشود) آزمایشی است که اغلب در صورتی انجام میشود که پزشک فکر میکند ممکن است سرطان معده داشته باشید.
در طول این آزمایش، پزشک یک آندوسکوپ را که یک لوله نازک، منعطف و روشن با یک دوربین فیلمبرداری کوچک است را از انتهای گلو عبور میدهد. این کار به پزشک اجازه میدهد تا پوشش داخلی مری، معده و قسمت اول روده کوچک را ببیند. در صورت مشاهده نواحی غیرطبیعی، نمونههای بیوپسی را میتوان با استفاده از وسایلی که از آندوسکوپ عبور داده میشود، برداشت. نمونههای بافت به آزمایشگاه فرستاده شده و در آن جا با میکروسکوپ بررسی میشوند تا از نظر وجود سرطان بررسی شوند.
متأسفانه، مشاهده برخی از انواع سرطان معده در طول آندوسکوپی دشوار است.
آندوسکوپی همچنین میتواند به عنوان بخشی از یک آزمایش تصویر برداری خاص به نام اولتراسوند آندوسکوپی (endoscopic ultrasound) استفاده شود که در زیر توضیح داده شده است.
در برخی موارد، از آندوسکوپی میتوان برای کمک به حذف سرطانهای مراحل اولیه استفاده کرد. این روش همچنین میتواند برای کمک به پیشگیری یا تسکین علائم یا سایر عوارض ناشی از سرطان معده، بدون نیاز به جراحی گسترده تر استفاده شود. (به بخش جراحی برای سرطان معده مراجعه کنید.)
به احتمال زیاد قبل از آندوسکوپی دارویی برای بیهوش کردن (آرام بخش) به شما داده میشود.
بیوپسی (Biopsy)
اگر در آندوسکوپی یا آزمایش تصویر برداری ناحیهای غیر طبیعی به نظر برسد، پزشک ممکن است به وجود سرطان مشکوک شود اما تنها راه برای تشخیص قطعی سرطان، انجام بیوپسی است. در طول بیوپسی، پزشک قطعاتی کوچک (نمونه) از ناحیه غیر طبیعی را برمیدارد.
بیوپسی برای بررسی سرطان معده اغلب در طول آندوسکوپی فوقانی انجام میشود. اگر پزشک در حین آندوسکوپی، هر ناحیه غیر طبیعی را در پوشش معده مشاهده کرد، میتوان ابزارهایی را به آندوسکوپ منتقل کرد تا بواسطه آنها نمونه برداری انجام داد.
برخی از سرطانهای معده میتوانند از عمق دیواره معده شروع شوند که میتواند نمونه برداری از آنها را با آندوسکوپی استاندارد سخت کند. اگر پزشک مشکوک باشد که سرطان در دیواره معده عمیقتر است، میتوان از سونوگرافی آندوسکوپی (که در زیر توضیح داده شده است) برای هدایت یک سوزن نازک و تو خالی به دیواره معده برای گرفتن نمونه بیوپسی استفاده کرد.
بیوپسی همچنین ممکن است از مناطقی که احتمال گسترش سرطان وجود دارد، مانند غدد لنفاوی مجاور یا مناطق مشکوک در سایر قسمتهای بدن گرفته شود.
آزمایش نمونههای بیوپسی
نمونههای بیوپسی به آزمایشگاه فرستاده میشوند تا زیر میکروسکوپ بررسی شوند. نمونهها بررسی میشوند که آیا حاوی سرطان هستند یا نه و اگر سرطان دارند، حاوی چه نوع سرطانی هستند (به عنوان مثال، آدنوکارسینوم روده یا منتشره، تومور کارسینوئید، تومور استرومایی گوارشی [GIST] یا لنفوم).
اگر سرطان معده تشخیص داده شود، ممکن است آزمایشهای آزمایشگاهی بیشتری روی نمونههای بیوپسی انجام شود تا اطلاعات بیشتری در مورد سلولهای سرطانی بدانیم. این کار ممکن است بر نحوه درمان سرطان تأثیر بگذارد.
آزمایش HER2: سلولهای سرطانی ممکن است برای بررسی اینکه آیا پروتئین محرک رشدی به نام HER2 را بیش از حد دارند یا خیر، آزمایش شوند. سرطانهایی که سطح HER2 در آنها افزایش یافته است HER2 مثبت نامیده میشوند. این سرطانها را میتوان با داروهایی که پروتئین HER2 را هدف قرار میدهند، درمان کرد.
نمونه بیوپسی معمولاً برای بررسی میزان HER2 با استفاده از روش ایمونوهیستوشیمی (IHC) یا هیبریداسیون در محل فلورسنت (FISH) آزمایش میشود. اغلب ابتدا از آزمایش IHC استفاده میشود که نتایج را در مقیاس 0 تا 3+ به ما میدهد.
- اگر نتایج 0 یا 1+ باشد، سرطان HER2 منفی است، بنابراین داروهایی که HER2 را هدف قرار میدهند احتمالا مفید نیستند.
- اگر آزمایش 3+ را نشان دهد، سرطان HER2 مثبت است، بنابراین درمان با داروهایی که HER2 را هدف قرار میدهند میتواند یک گزینه باشد.
- وقتی نتیجه 2+ باشد، وضعیت HER2 سرطان مشخص نیست، بنابراین برای روشن شدن نتیجه باید نمونه با آزمایش FISH آزمایش شود.
آزمایش برای تغییرات ژنی یا پروتئینی دیگر: سلولهای سرطانی ممکن است برای تغییرات ژنی یا پروتئینی دیگری که ممکن است بر درمان تأثیر بگذارند نیز آزمایش شوند. مثلا:
- اگر سلولها دارای مقدار مشخصی از پروتئین ایست بازرسی ایمنی (immune checkpoint protein) به نام PD-L1 باشند، درمان با یک مهارکننده نقطه بازرسی ایمنی مانند پمبرولیزوماب (Keytruda) ممکن است یک گزینه باشد.
- اگر سلولها دارای سطوح بالایی از ناپایداری ریزماهواره (MSI-H یا microsatellite instability) یا نقص در ژن ترمیم عدم تطابق (dMMR) باشند، درمان با یک بازدارنده نقطه بازرسی ایمنی ممکن است یک گزینه باشد.
- اگر سلولها دارای بار جهش توموری بالا (TMB-H) هستند، به این معنی که دارای جهشهای ژنی زیادی هستند، درمان با یک مهارکننده ایست بازرسی ایمنی ممکن است یک گزینه باشد.
- اگر سلولها در یکی از ژنهای NTRK تغییراتی داشته باشند، داروهای هدفمند خاصی ممکن است گزینه ای برای درمان باشند.
تستهای تصویر برداری
تستهای تصویر برداری از اشعه ایکس، میدانهای مغناطیسی، امواج صوتی یا مواد رادیو اکتیو برای ایجاد تصاویری از داخل بدن شما استفاده میکنند. آزمایشات تصویر برداری ممکن است به دلایل مختلفی انجام شوند، از جمله:
- برای کمک به یافتن اینکه آیا یک ناحیه مشکوک ممکن است سرطانی باشد یا خیر.
- برای فهمیدن میزان گسترش سرطان
- برای کمک به تعیین اینکه آیا درمان موثر بوده است یا خیر.
مجموعه فوقانی دستگاه گوارش (GI یا Upper gastrointestinal)
این یک آزمایش اشعه ایکس برای بررسی پوشش داخلی مری، معده و قسمت اول روده کوچک است. این آزمایش کمتر از آندوسکوپی فوقانی برای بررسی سرطان معده یا سایر مشکلات معده استفاده میشود زیرا ممکن است برخی از نواحی غیر طبیعی را از دست داده و به پزشک اجازه نمونه برداری را نمیدهد. اما این روش نسبت به آندوسکوپی کمتر تهاجمی است و ممکن است در برخی شرایط مفید باشد.
برای این آزمایش، شما یک محلول گچی سفید حاوی ماده ای به نام باریم (barium) را مینوشید. باریم پوشش داخلی مری، معده و روده کوچک را میپوشاند. (در این زمان ممکن است هوا نیز از طریق یک لوله نازک به معده پمپ شود.) سپس چندین عکس اشعه ایکس گرفته میشود. از آن جایی که اشعه ایکس نمیتواند از پوشش باریم عبور کند، هر ناحیه غیر طبیعی در پوشش این اندامها را مشخص میکند.
اسکن توموگرافی کامپیوتری (CT یا CAT)
سی تی اسکن از اشعه ایکس برای تهیه تصاویر دقیق و مقطعی از بافتهای نرم بدن استفاده میکند.
سی تی اسکن میتواند معده را نسبتاً واضح نشان دهد و اغلب میتواند محل سرطان را تأیید کند. سی تی اسکن همچنین میتواند سایر قسمتهای بدن را که سرطان معده ممکن است به آنها سرایت کرده باشد، مانند کبد و غدد لنفاوی مجاور را نشان دهد. این کار میتواند به تعیین وسعت (مرحله) سرطان و اینکه آیا جراحی میتواند گزینه درمانی خوبی باشد، کمک کند.
بیوپسی سوزنی با هدایت CT: از سی تی اسکن نیز میتوان برای هدایت سوزن بیوپسی به ناحیه مشکوک به گسترش سرطان استفاده کرد. برای این آزمایش، در حالی که پزشک سوزن بیوپسی را از طریق پوست به سمت توده سرطانی حرکت میدهد، روی میز سی تی اسکن دراز میکشید. سی تی اسکن تا زمانی که سوزن در داخل توده قرار گیرد، تکرار میشود. سپس نمونه بیوپسی برداشته شده و برای انجام آزمایش به آزمایشگاه فرستاده میشود.
سونوگرافی آندوسکوپی
سونوگرافی آندوسکوپی (EUS) اغلب برای مشاهده میزان گسترش سرطان در دیواره معده یا نواحی مجاور یا غدد لنفاوی مجاور استفاده میشود.
برای این آزمایش، یک پروب سونوگرافی کوچک روی نوک آندوسکوپ قرار میگیرد. در حالی که بیهوش هستید، آندوسکوپ از گلو و معده عبور میکند. کاوشگر در مقابل دیواره معده که محل سرطان است قرار میگیرد. پروب امواج صوتی منتشر میکند و پژواکها را در هنگام برگشت تشخیص میدهد. این پژواکهای بازگشت داده شده سپس به تصاویر تبدیل میشوند. پزشکان میتوانند از این تصاویر برای مشاهده لایههای دیواره معده و همچنین غدد لنفاوی مجاور و سایر ساختارها در خارج از معده استفاده کنند.
EUS همچنین میتواند برای کمک به هدایت سوزن به ناحیه مشکوک برای گرفتن نمونه بیوپسی (که به عنوان بیوپسی سوزنی هدایت شده توسط EUS شناخته میشود) استفاده شود.
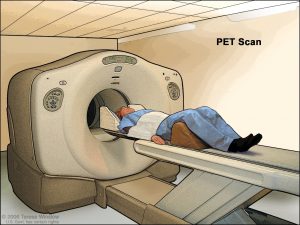
اسکن توموگرافی گسیل پوزیترون (PET)
اسکن PET میتواند برای کمک به تعیین میزان سرطان در بدن مفید باشد. برای این آزمایش، نوعی قند که کمی رادیو اکتیو است و عمدتاً در سلولهای سرطانی جمع میشود، به شما تزریق میشود. سپس از یک دوربین مخصوص برای ایجاد تصویری از مناطق پرتوزا در بدن استفاده میشود. تصویر مانند سی تی اسکن یا اسکن ام آر آی دقیق نیست اما اسکن PET میتواند مناطق احتمالی مبتلا به سرطان را در تمام نواحی بدن به طور همزمان جستجو کند.
بسیاری از دستگاههای جدیدتر میتوانند هم زمان اسکن PET و CT را انجام دهند (PET/CT scan). این کار به پزشک اجازه میدهد تا مناطقی را که در اسکن PET “روشن میشوند” را با جزئیات بیشتری بررسی کند.
اگرچه اسکن PET میتواند برای یافتن مناطق گسترش سرطان مفید باشد اما این روش همیشه در انواع خاصی از سرطان معده مفید نیست زیرا برخی از انواع سلولها مقدار زیادی از قند رادیو اکتیو را نمیگیرند.
تصویر برداری رزونانس مغناطیسی (MRI)
مانند سی تی اسکن، MRI میتواند تصاویر دقیقی از بافتهای نرم بدن را نشان دهد. اما ام آر آی از امواج رادیویی و آهنرباهای قوی به جای اشعه ایکس استفاده میکند.
این آزمایش به اندازه سی تی اسکن برای بررسی سرطان معده استفاده نمیشود اما ممکن است در موقعیتهای خاص، مانند زمانی که به دنبال تومور در کبد میگردید، مفید باشد.
اشعه ایکس قفسه سینه
این آزمایش میتواند نشان دهد که آیا سرطان به ریهها گسترش یافته است یا خیر. همچنین ممکن است برای کمک به تعیین اینکه آیا یک فرد دارای بیماریهای ریوی یا قلبی جدی است یا خیر، استفاده شود. این کار ممکن است بر تعیین اینکه آیا جراحی یک گزینه درمانی برای سرطان است یا خیر، تأثیر بگذارد. اگر سی تی اسکن از قفسه سینه انجام شده باشد، نیازی به اشعه ایکس قفسه سینه نیست.
تستهای دیگر
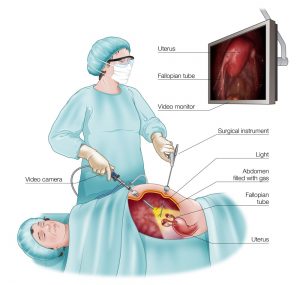
لاپاراسکوپی (Laparoscopy)
اگر سرطان معده قبلاً تشخیص داده شده باشد و آزمایشهای تصویر برداری مانند سی تی اسکن یا اسکن PET نشان نداده باشند که این سرطان به سایر قسمتهای بدن سرایت کرده است، پزشکان ممکن است قبل از هر عمل جراحی دیگری لاپاراسکوپی را انجام دهند. این تست میتواند به تأیید اینکه سرطان هنوز فقط در معده است، کمک کند. به این معنی که جراحی برای برداشتن آن ممکن است همچنان یک گزینه باشد.
این روش در اتاق عمل در حالی که تحت بیهوشی عمومی هستید (در خواب عمیقی فرو رفتهاید) انجام میشود. یک لاپاراسکوپ (لوله ای نازک و انعطاف پذیر با یک دوربین فیلم برداری کوچک در انتهای آن) از طریق یک برش کوچک در شکم وارد میشود. این کار به پزشک اجازه میدهد تا از نزدیک سطوح اندامها و غدد لنفاوی مجاور داخل شکم را بررسی کند یا حتی نمونههای کوچکی از بافت را که میتوان برای بررسی سرطانی بودن آزمایش کرد، بردارد.
اگر به نظر نمیرسد که سرطان گسترش یافته باشد، گاهی اوقات پزشک شکم را با نمک (آب نمک) “شستشو” میکند. به این کار شستشوی صفاقی (peritoneal washing) میگویند. سپس مایع جمع آوری شده و از نظر وجود سلولهای سرطانی بررسی میشود.
گاهی اوقات لاپاراسکوپی با سونوگرافی ترکیب میشود تا تصویر بهتری از سرطان ارائه شود.
تستهای عملکردی اندامها
اگر سرطان تشخیص داده شود، پزشک ممکن است آزمایشهای آزمایشگاهی خاصی را توصیه کند، به خصوص اگر جراحی ممکن است یک گزینه باشد. به عنوان مثال، آزمایشهای خون برای اطمینان از عملکرد طبیعی کبد و کلیهها و لخته شدن خون شما انجام میشود.
اگر جراحی برای شما برنامه ریزی شده باشد یا قصد دریافت داروهایی را داشته باشید که میتوانند بر قلب تأثیر بگذارند، ممکن است برای اطمینان از عملکرد خوب قلب، نوار قلب (EKG) و یا اکوکاردیوگرام (سونوگرافی قلب) نیز انجام دهید.
سرطان معده چگونه درمان میشود؟
جراحی (Surgery) برای سرطان معده
اگر بتوان آن را انجام داد، جراحی اغلب بخشی از درمان سرطان معده است. اگر سرطان به سایر قسمتهای بدن سرایت نکرده باشد، جراحی (اغلب همراه با سایر درمانها) بهترین فرصت را برای تلاش برای درمان سرطان ارائه میدهد.
جراحی به دو دلیل عمده انجام میشود:
- جراحی برای برداشتن سرطان: بسته به محل و مرحله (وسعت) سرطان، ممکن است جراحی برای برداشتن سرطان و بخشی یا تمام معده و همچنین برخی از غدد لنفاوی مجاور و سایر ساختارها انجام شود. جراح سعی میکند تا حد امکان بافت معده طبیعی را برندارد. گاهی اوقات سایر اعضای بدن نیز باید برداشته شوند.
- جراحی تسکینی (Palliative surgery): اگر سرطان خیلی گسترده باشد که نتوان آن را به طور کامل برداشت، ممکن است همچنان جراحی برای جلوگیری از خونریزی ناشی از تومور یا جلوگیری از مسدود شدن معده توسط رشد تومور انجام شود. این نوع جراحی میتواند از بروز علائم پیشگیری کرده یا آنها را تسکین دهد اما انتظار نمیرود که سرطان را درمان کند.
جراحی برای برداشتن سرطان
برای حذف سرطان معده میتوان از انواع مختلف جراحی استفاده کرد. نوع عمل مورد استفاده بستگی به این دارد که سرطان در چه قسمتی از معده قرار دارد و تا چه اندازه در مناطق مجاور رشد کرده است.
قبل از جراحی، با جراح خود در مورد اینکه چه مقدار از معده باید برداشته شود، صحبت کنید. برخی از جراحان سعی میکنند تا جایی که میتوانند بافت معده طبیعی را دست نخورده باقی بگذارند. این کار ممکن است به بیماران اجازه دهد تا بعد از جراحی غذای عادی تری بخورند. با این حال، هدف اصلی جراحی این است که مطمئن شوید همه بافتهای سرطانی حذف شده اند. جراح سعی میکند حاشیههای جراحی منفی را ایجاد کند، به این معنی که هیچ سلول سرطانی در لبههای قسمتهای برداشته شده معده دیده نمیشود، حتی زمانی که آن را زیر میکروسکوپ نگاه میکنند.
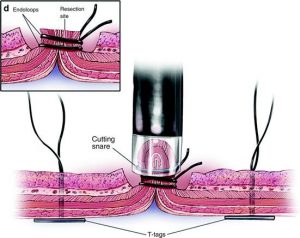
رزکسیون آندوسکوپی (Endoscopic resection)
برداشتن آندوسکوپی مخاط (EMR) و تشریح آندوسکوپی زیر مخاطی (ESD) روشهایی هستند که میتوانند برای درمان برخی از سرطانها در مراحل اولیه استفاده شوند، زمانی که تصور میشود تومور عمیقاً در دیواره معده رشد نکرده باشد و احتمال انتشار آن در خارج از معده نیز بسیار کم است.
این روشها نیازی به برش (incision) در پوست ندارند. در عوض، جراح یک آندوسکوپ (لوله ای بلند و انعطاف پذیر با یک دوربین فیلمبرداری کوچک در انتهای آن) را از گلو و داخل معده عبور میدهد. ابزارهای جراحی را میتوان از طریق آندوسکوپ عبور داد تا تومور و برخی از لایههای دیواره معمولی معده در زیر و اطراف آن برداشته شود. (ESD عمیق تر از EMR به داخل دیواره معده فرو میرود.)
این عملها به همان اندازه که در برخی از کشورهای آسیای شرقی (مانند ژاپن) که سرطان معده در آنها شایعتر است و اغلب به دلیل غربالگری در مراحل اولیه یافت میشود، در ایالات متحده انجام نمیشود. اگر قصد انجام این نوع جراحی را دارید، باید آن را در مرکزی انجام دهید که تجربه انجام این روش را داشته باشد.
گاسترکتومی جزئی (Subtotal gastrectomy)
در این عمل تنها بخشی از معده برداشته میشود. این روش اغلب در صورتی توصیه میشود که سرطان فقط در قسمت تحتانی معده باشد (در این صورت به عنوان گاسترکتومی دیستال (distal gastrectomy) شناخته میشود). همچنین ممکن است برای سرطانهایی که فقط در قسمت فوقانی معده هستند نیز استفاده شود (در این صورت به عنوان یک گاسترکتومی پروگزیمال (proximal gastrectomy) شناخته میشود).
بخشی از معده، گاهی همراه با بخشی از مری (در گاسترکتومی پروگزیمال) یا قسمت اول روده کوچک (در گاسترکتومی دیستال) برداشته میشود. سپس بخشهای باقی مانده از معده دوباره به هم وصل میشود. در این روش مقداری از امنتوم (omentum، لایه همبند مانندی از بافت چربی که معده و رودهها را میپوشاند) به همراه غدد لنفاوی مجاور نیز برداشته میشود. اگر سرطان به طحال یا قسمتهایی از سایر اندامهای مجاور رسیده باشد، آنها نیز برداشته میشوند.
اگر به جای کل معده تنها بخشی از معده برداشته شود، بعد از جراحی غذا خوردن بسیار آسان تر است.
گاسترکتومی کامل (Total gastrectomy)
این عمل در صورتی انجام میشود که سرطان به طور گسترده در معده پخش شده باشد. همچنین اغلب اگر سرطان در قسمت فوقانی معده و در نزدیکی مری باشد، توصیه میشود.
جراح، کل معده، غدد لنفاوی مجاور و امنتوم را برمیدارد. همچنین ممکن است طحال و قسمتهایی از مری، رودهها، لوزالمعده یا سایر اندامهای مجاور را در صورتی که سرطان بهآنها رسیده باشد، از بدن خارج شوند. سپس انتهای مری به قسمتی از روده کوچک متصل میشود. این کار اجازه میدهد تا غذا به سمت پایین روده حرکت کند. اما افرادی که معدهشان را برداشتهاند، فقط میتوانند مقدار کمی غذا را به طور یکدفعه بخورند. به همین دلیل، آنها باید تعداد دفعات بیشتری غذا بخورند.
رویکردهای جراحی برای گاسترکتومی جزئی یا کلی
اکثر گاسترکتومیهای ساب توتال (جزئی) و توتال (کلی) از طریق یک برش بزرگ در پوست شکم (belly) انجام میشود. گاهی اوقات به این روش جراحی باز (open surgical approach) نیز گفته میشود.
در برخی از مراکز، این عملها به صورت لاپاروسکوپی گاسترکتومی انجام میشوند که در آن ابزارهای جراحی بلند و نازکی (از جمله ابزاری که در انتهای آن یک دوربین فیلم برداری کوچک وجود دارد) از طریق چندین برش کوچک به داخل شکم وارد میشوند. برخی از جراحان این عملها را با استفاده از جراحی لاپاراسکوپی به کمک وسایل رباتیکی (که گاهی اوقات جراحی رباتیک (robotic surgery) نامیده میشود) انجام میدهند. در این تکنیک، جراح روی یک پانل کنترل مینشیند و بازوهای رباتیکی را که در انتهای آن ابزار لاپاراسکوپی قرار دارند حرکت میدهد.
اگرچه رویکرد لاپاراسکوپی (از جمله جراحی رباتیک) ممکن است منجر به بستری فرد بیمار برای مدت کوتاهتری در بیمارستان، درد کمتر پس از عمل و زمان بهبودی کوتاهتر (به دلیل برشهای کوچکتر) شود، بسیاری از پزشکان احساس میکنند که این روش قبل از انجام آن نیاز به مطالعه بیشتری دارد تا به عنوان یک درمان استاندارد برای سرطان معده در نظر گرفته شود.
مهم نیست که از کدام روش استفاده میشود، مهم این است که جراح شما در تکنیکی که استفاده میکند ماهر و با تجربه باشد.
برداشتن غدد لنفاوی
در گاسترکتومی جزئی یا کلی، غدد لنفاوی مجاور برداشته میشوند. این عمل به عنوان دیسکسیون غدد لنفاوی (lymph node dissection) یا لنفادنکتومی (lymphadenectomy) شناخته میشود و بخش بسیار مهمی از فرایند جراحی است. بسیاری از پزشکان احساس میکنند که موفقیت جراحی به طور مستقیم با تعداد غدد لنفاوی که جراح برداشته است، مرتبط است.
در ایالات متحده، توصیه میشود که حداقل 16 غده لنفاوی (که لنفادنکتومی D1 نامیده میشود) هنگام انجام عمل معده برداشته شود. جراحان در برخی از کشورهای آسیای شرقی (مانند ژاپن و کره جنوبی) با برداشتن تعداد بیشتری از غدد لنفاوی نزدیک به سرطان (به نام لنفادنکتومی D2) میزان موفقیت بسیار بالایی داشتند.
جراحان در اروپا و ایالات متحده نتوانستهاند با نتایج جراحان در شرق آسیا برابری کنند. مشخص نیست که آیا این امر به این دلیل است که جراحان آسیای شرقی باتجربهتر هستند (سرطان معده در این کشورها بسیار شایعتر است) زیرا بیماران آنها معمولاً به بیماری در مراحل اولیه مبتلا میشوند (به دلیل غربالگری سرطان معده) و سالمتر هستند یا اینکه عوامل دیگری در این مسئله نقش دارند.
در هر صورت، برای چنین عملی به یک جراح ماهر که در جراحی سرطان معده با تجربه است نیاز است تا بیشترین تعداد غدد لنفاوی را از بدن خارج کند. از جراح خود در مورد تجربه او در مورد جراحی سرطان معده بپرسید. مطالعات نشان داده اند که نتایج زمانی بهتر است که هم جراح و هم بیمارستان تجربه زیادی در درمان بیماران مبتلا به سرطان معده داشته باشند.
جراحی تسکینی برای سرطان غیر قابل برداشت
برای افراد مبتلا به سرطان معده که نمیتوان معده آنها را به طور کامل برداشت، جراحی اغلب همچنان میتواند برای کمک به کنترل سرطان یا کمک به پیشگیری یا تسکین علائم یا عوارض آنها استفاده شود.
بای پس معده (Gastric bypass یا گاستروژونوستومی)
تومورهای موجود در قسمت پایین معده ممکن است در نهایت به اندازهای بزرگ شوند که مانع خروج غذا از معده گردند. برای افرادی که به اندازه کافی برای جراحی سالم هستند، یک گزینه برای کمک به پیشگیری یا درمان بیماری، دور زدن قسمت پایین معده است. این کار با اتصال بخشی از روده کوچک (the jejunum) به قسمت فوقانی معده انجام میشود که به غذا اجازه میدهد تا از طریق اتصال جدید از معده خارج شود.
گاسترکتومی ساب توتال
برای برخی از افرادی که به اندازه کافی برای جراحی سالم هستند، برداشتن قسمتی از معده همراه با تومور میتواند به درمان مشکلاتی مانند خونریزی، درد یا مسدود شدن راه عبور غذا از معده توسط تومور کمک کند، حتی اگر جراحی سرطان را درمان نکند. از آن جایی که هدف درمان سرطان نیست، غدد لنفاوی مجاور و بخشهایی از سایر اندامها معمولاً نیازی به برداشتن ندارند.
قرار دادن لوله تغذیه
برخی از افراد مبتلا به سرطان معده قادر به خوردن یا نوشیدن کافی برای دریافت تغذیه مناسب نیستند. یک عمل جزئی میتواند برای قرار دادن یک لوله تغذیه از طریق پوست شکم و در قسمت تحتانی معده (معروف به لوله گاستروستومی یا لوله G) یا داخل روده کوچک (لوله ژژنوستومی یا لوله J) انجام شود. سپس مواد مایع را میتوان مستقیماً در لوله قرار داد.
روشهای آندوسکوپی (Endoscopy)
در برخی شرایط، روشهای آندوسکوپی فوقانی را میتوان برای کمک به پیشگیری یا تسکین علائم، بدون نیاز به جراحی گسترده تر انجام داد:
- ابلیشن تومور آندوسکوپی (Endoscopic tumor ablation): در برخی موارد، مانند افرادی که از سلامت کافی برای جراحی برخوردار نیستند، میتوان از آندوسکوپ (لوله بلند و انعطاف پذیری که از گلو عبور میکند) با لیزر در انتهای آن برای از بین بردن بخشی از تومور استفاده کرد. این کار میتواند برای توقف خونریزی یا کمک به رفع انسداد لوله گوارش بدون جراحی انجام شود.
- قرار دادن استنت (Stent placement): یکی دیگر از گزینههای غیر جراحی برای جلوگیری از مسدود شدن دهانه ابتدایی یا انتهایی معده، استفاده از آندوسکوپ برای قرار دادن استنت (لوله فلزی تو خالی) در دهانه این مناطق است. این کار به باز نگه داشتن آن کمک کرده و اجازه میدهد تا غذا از آن عبور کند. برای تومورهای قسمت فوقانی (پرگزیمال) معده، استنت در جایی قرار میگیرد که مری و معده به هم میرسند. برای تومورهای قسمت تحتانی (دیستال) معده، استنت در محل اتصال معده و روده کوچک قرار میگیرد.
اختلالات و عوارض احتمالی جراحی
جراحی برای سرطان معده پیچیده است و میتواند عوارضی داشته باشد. این موارد میتواند شامل خونریزی ناشی از جراحی، لخته شدن خون و آسیب به اندامهای مجاور در طول عمل باشد. به ندرت ممکن است اتصالات جدید ایجاد شده بین انتهای معده، مری و روده کوچک نشت کند.
تکنیکهای جراحی در سالهای اخیر بهبود یافتهاند، بنابراین تنها درصد بسیار کمی از افراد در اثر جراحی برای سرطان معده جان خود را از دست میدهند. احتمال این اتفاق در زمانی که عمل گسترده تر است – مانند زمانی که سایر اندامها نیز برداشته میشود – بیشتر است اما این احتمال در دستان جراحان بسیار ماهر کمتر هم میشود.
حداقل تا چند روز پس از گاسترکتومی کامل یا ساب توتال، اجازه نخواهید داشت چیزی بخورید یا بنوشید. این امر به این منظور است که به دستگاه گوارش زمان داده شود تا بهبود یابد و اطمینان حاصل شود که در قسمتهایی که در حین عمل به یکدیگر متصل شده اند، نشتی وجود ندارد.
عوارض جانبی پس از جراحی میتواند شامل حالت تهوع، سوزش سر دل، درد شکم (belly) و اسهال، به ویژه بعد از غذا خوردن باشد. این عوارض جانبی ناشی از این واقعیت است که به محض برداشتن قسمتی از معده یا تمام آن، غذا پس از صرف آن بسیار سریعتر وارد روده میشود. این عوارض جانبی ممکن است با گذشت زمان بهتر شوند اما برای برخی از افراد ممکن است این اتفاق نیفتد. پزشک شما ممکن است داروهایی را برای کمک به این عوارض احتمالی تجویز کند.
تغییراتی در رژیم غذایی شما پس از یک گاسترکتومی جزئی یا کامل لازم است. بزرگترین تغییر این است که شما باید وعدههای غذایی کوچکتر را به صورت مکرر بخورید. مقدار معده برداشته شده بر میزان نیاز شما برای تغییر روش غذا خوردن تاثیر میگذارد.
برخی از افراد ممکن است پس از جراحی سرطان معده در مصرف مواد غذایی کافی دچار مشکل شوند. درمانهای بیشتر مانند شیمی درمانی و پرتو درمانی پس از جراحی میتواند این مشکل را بدتر نیز کند.
برای کمک به این امر، گاهی اوقات یک لوله در روده قرار میگیرد، چه در زمان جراحی چه بعد از آن. انتهای دیگر این لوله که لوله ژژنوستومی یا لوله J نامیده میشود، خارج از پوست روی شکم باقی میماند. مایع تغذیهای را میتوان مستقیماً از طریق این لوله وارد روده کرد تا به پیشگیری یا درمان سوء تغذیه کمک کند.
معده به بدن کمک میکند تا برخی ویتامینها را جذب کند، بنابراین افرادی که گاسترکتومی ساب توتال یا کلی انجام داده اند ممکن است دچار کمبود ویتامین شوند. اگر قسمتهای خاصی از معده برداشته شود، پزشکان به طور معمول مکملهای ویتامینی را تجویز میکنند که برخی از آنها را فقط میتوان تزریق کرد.
این موضوع مهم است که شما باید مطمئن شوید که جراحتان در درمان سرطان معده مجرب است و میتواند به روزترین عملها را برای کاهش خطر عوارض انجام دهد.
شیمی درمانی (Chemotherapy) برای سرطان معده
شیمی درمانی (chemo) از داروهای ضد سرطانی استفاده میکند که به داخل ورید (از طریق خط IV یا کاتتر ورید مرکزی) به فرد تزریق شده یا از طریق دهان به عنوان قرص تجویز میشوند. این داروها وارد جریان خون میشوند و به تمام نواحی بدن میرسند و این کار درمان را برای سرطانی که به اندامهایی فراتر از جایی که شروع شده گسترش یافته است، مفید میسازد.
چه زمانی از شیمی درمانی برای سرطان معده استفاده میشود؟
شیمی درمانی ممکن است در زمانهای مختلف برای کمک به درمان سرطان معده استفاده شود:
- شیمی درمانی را میتوان قبل از جراحی برای سرطان معده تجویز کرد. این کار به عنوان درمان نئوادجوانت (neoadjuvant treatment) شناخته میشود. (گاهی اوقات شیمی درمانی همراه با پرتو درمانی انجام میشود که به عنوان chemoradiation شناخته میشود.) درمان نئوادجوانت اغلب میتواند تومور را کوچک کرده و احتمالاً جراحی را آسان تر کند. همچنین ممکن است به جلوگیری از عود سرطان کمک کرده و عمر طولانی تری را برای بیماران موجب شود. برای برخی از مراحل سرطان معده، شیمی درمانی نئوادجوانت یکی از گزینههای درمانی استاندارد است. اغلب، دوباره پس از جراحی به فرد شیمی درمانی داده میشود.
- ممکن است پس از جراحی برای برداشتن سرطان، شیمی درمانی داده شود. این روش درمان کمکی (adjuvant treatment) نامیده میشود. هدف از شیمی درمانی کمکی از بین بردن هر ناحیه ای از سرطان است که ممکن است نادیده گرفته شده باشد اما برای دیدن نیز بسیار کوچک است. این کار میتواند به جلوگیری از عود سرطان کمک کند. اغلب، برای سرطان معده، شیمی درمانی همراه با پرتو درمانی پس از جراحی انجام میشود. این کار ممکن است به ویژه برای سرطانهایی که نمیتوانند به طور کامل با جراحی حذف شوند مفید باشد.
- اگر سرطان به نقاط دور دست بدن گسترش یافته باشد (متاستاز یا metastasized) یا به دلایل دیگری نتوان آن را خارج کرد، ممکن است شیمی درمانی به عنوان درمان اولیه (اصلی) تجویز شود. شیمی درمانی ممکن است به کوچک کردن سرطان یا کاهش رشد آن کمک کند که خود میتواند علائم را تسکین دهد و به افراد کمک کند تا عمر طولانی تری داشته باشند.
پزشکان شیمی درمانی را به صورت دورهای انجام میدهند و در هر دوره از درمان، یک دوره استراحت به دنبال دارد تا به بدن فرصت بهبودی بدهد. هر چرخه معمولاً چند هفته طول میکشد.
کدام داروهای شیمی درمانی برای سرطان معده استفاده میشود؟
بسیاری از داروهای شیمی درمانی مختلف را میتوان برای درمان سرطان معده استفاده کرد، از جمله:
- 5-FU (فلوئورواوراسیل یا fluorouracil)، اغلب همراه با لوکوورین (اسید فولینیک یا leucovorin) داده میشود.
- کاپسیتابین (Capecitabine)
- کربوپلاتین (Carboplatin)
- سیس پلاتین (Cisplatin)
- دوستاکسل (Docetaxel)
- اپی روبیسین (Epirubicin)
- Irinotecan
- اگزالیپلاتین (Oxaliplatin)
- پاکلی تاکسل (Paclitaxel)
- تری فلوریدین (Trifluridine) و تیپیراسیل (Lonsurf)، یک داروی ترکیبی به شکل قرص
اغلب، 2 یا 3 مورد از این داروها ترکیب میشوند (گاهی اوقات همراه با یک داروی هدفمند دیگر). اما انجام این کار بستگی به عواملی مانند مرحله سرطان، سلامت کلی فرد و اینکه آیا شیمی درمانی با پرتو درمانی با هم ترکیب شده است یا خیر، دارد. ترکیبات حاصل از سه دارو میتوانند عوارض جانبی بیشتری داشته باشند، بنابراین معمولاً برای افرادی که از سلامت بسیار خوبی برخوردار هستند و پزشک میتواند به دقت آنها را پیگیری کند، استفاده میشوند.
برای مراحل اولیه سرطان، برخی از ترکیبات دارویی رایج که قبل و یا بعد از جراحی استفاده میشوند، عبارتند از:
- اگزالی پلاتین به علاوه 5-FU/leucovorin (FOLFOX)، یا اگزالیپلاتین به علاوه کپسیتابین (CAPOX)
- FLOT (5-FU/leucovorin، اگزالیپلاتین و دوستاکسل)
- Docetaxel یا Paclitaxel به علاوه 5-FU یا capecitabine
- سیس پلاتین پلاس (Cisplatin plus) یا 5-FU یا کپسیتابین (capecitabine)
- پاکلی تاکسل (Paclitaxel) و کربوپلاتین (carboplatin)
هنگامی که پس از جراحی شیمی درمانی همراه با پرتو درمانی به فرد داده میشود، ممکن است از یک داروی منفرد مانند 5-FU یا کپسیتابین استفاده شود.
برای سرطان پیشرفته معده، بسیاری از ترکیبات مشابه از داروها را میتوان استفاده کرد، اگرچه پزشکان اغلب ترکیبی از 2 دارو را به جای 3 دارو برای کاهش عوارض جانبی ترجیح میدهند. برخی از رایج ترین ترکیبات مورد استفاده عبارتند از:
- اگزالی پلاتین به علاوه 5-FU/leucovorin (FOLFOX)، یا اگزالیپلاتین به علاوه کپسیتابین (CAPOX)
- سیس پلاتین پلاس یا 5-FU یا کپسیتابین
- Irinotecan plus 5-FU و leucovorin (FOLFIRI)
- پاکلیتاکسل به علاوه سیس پلاتین یا کربوپلاتین
- Docetaxel به علاوه سیس پلاتین
- اپی روبیسین، سیس پلاتین یا اگزالی پلاتین و 5-FU یا کپسیتابین
- Docetaxel، 5-FU و یا سیس پلاتین، کربوپلاتین یا اگزالیپلاتین
اگر فردی به اندازه کافی سالم نباشد که بتواند ترکیبی از داروهای شیمی درمانی را دریافت کند، ممکن است به جای آن از یک دارو مانند 5-FU، کپسیتابین، دوستاکسل یا پاکلیتاکسل استفاده شود.
اگر یکی از این ترکیبات (یا یک داروی منفرد) دیگر مفید نباشد، ممکن است دارو یا ترکیبی از داروها امتحان شود.
عوارض جانبی شیمی درمانی
داروهای شیمی درمانی به سلولهایی در بدن که به سرعت در حال تقسیم هستند حمله میکنند که این امر میتواند منجر به بروز عوارض جانبی شود.
این عوارض به نوع و دوز داروها و طول روند درمان بستگی دارد. عوارض جانبی ناشی از شیمی درمانی میتواند شامل موارد زیر باشد:
- تهوع و استفراغ
- از دست دادن اشتها
- ریزش مو
- اسهال یا یبوست
- زخمهای دهانی
- افزایش احتمال عفونت (به دلیل کمبود گلبولهای سفید)
- خونریزی یا کبودی آسان (به دلیل کمبود پلاکت)
- خستگی و تنگی نفس (در اثر کمبود گلبولهای قرمز)
این عوارض معمولاً پس از پایان درمان از بین میروند. به عنوان مثال، موها معمولاً پس از پایان دوره درمان دوباره رشد میکنند. حتماً به تیم پزشکی سرطان خود در مورد هر گونه عوارض جانبی که دارید، اطلاع دهید زیرا اغلب راههایی برای کمک به رفع آنها وجود دارد. به عنوان مثال، میتوان داروهایی را برای پیشگیری یا کاهش تهوع و استفراغ تجویز کرد.
برخی از داروهای شیمی درمانی عوارض جانبی خاصی دارند. تیم درمانی شما میتواند به شما کمک کند تا بدانید کدام یک از این موارد ممکن است برای شما رخ دهند.
آسیب عصبی (نوروپاتی یا neuropathy): داروهایی مانند سیس پلاتین، اگزالی پلاتین، دوستاکسل و پاکلیتاکسل میتوانند به اعصاب آسیب برسانند. گاهی أوقات این وضعیت میتواند به علائمی (عمدتاً در دستها و پاها) مانند درد، سوزش یا سوزن سوزن شدن، حساسیت به سرما یا گرما یا ضعف منجر شود. در بیشتر موارد، پس از قطع درمان این مشکل از بین میرود اما ممکن است در برخی افراد به صورت طولانی مدت وجود داشته باشد. اگزالیپلاتین همچنین میتواند بر اعصاب گلو تأثیر بگذارد و باعث درد گلو شود که این وضعیت هنگام تلاش برای خوردن یا نوشیدن مایعات یا غذاهای سرد بدتر میشود.
آسیب قلبی: اپی روبیسین و برخی داروهای دیگر در صورت استفاده طولانی مدت یا در دوزهای بالا میتوانند به قلب آسیب برسانند. به همین دلیل، پزشکان دوزها را به دقت کنترل میکنند و از آزمایشات قلبی مانند اکوکاردیوگرام (echocardiograms) یا اسکن MUGA برای نظارت بر عملکرد قلب استفاده میکنند. درمان با این داروها با اولین نشانه آسیب قلبی متوقف میشود.
سندرم دست و پا (Hand-foot syndrome) میتواند در طول درمان با کپسیتابین یا 5-FU (زمانی که به صورت انفوزیون و تزریقی به فرد داده میشود) رخ دهد. این حالت به صورت قرمزی در دست و پا شروع میشود که سپس میتواند به درد و حساسیت در کف دست و پا تبدیل شود. اگر این وضعیت تشدید شود، ممکن است تاول، پینه یا کنده شدن پوست ایجاد شود که گاهی زخمهای دردناکی را در فرد ایجاد میکند. بهترین راه برای جلوگیری از سندرم شدید دست و پا این است که در صورت داشتن علائم اولیه مانند قرمزی یا حساسیت به پزشک خود اطلاع دهید تا اقدامات لازم برای جلوگیری از بدتر شدن شرایط انجام شود.
اسهال یک عارضه جانبی رایج در بسیاری از داروهای شیمی درمانی است اما میتواند با irinotecan به طور به خصوصی در ارتباط باشد. این وضعیت برای جلوگیری از کم آبی شدید باید فوراً درمان شود – در اولین نشانه از مدفوع شل. اگر داروی شیمی درمانی دریافت میکنید که احتمالاً باعث اسهال میشود، پزشک دستور العملهایی را در مورد داروهایی که باید مصرف کنید و مقدار مصرف آنها برای کنترل این علامت به شما میدهد.
برخی از داروهای شیمی درمانی میتوانند عوارض جانبی دیگری ایجاد کنند. با تیم درمانی خود در مورد انواع عوارض جانبی که باید مراقب آن باشید صحبت کنید.
درمان دارویی هدفمند (Targeted Drug Therapy) برای سرطان معده
همان طور که محققان در مورد تغییرات سلولهایی که باعث سرطان میشوند اطلاعات بیشتری کسب کرده اند، داروهای جدیدتری نیز تولید کرده اند که به طور خاص این تغییرات را هدف قرار میدهد. داروهای هدفمند متفاوت از داروهای استاندارد شیمی درمانی (chemo) عمل میکنند.آنها گاهی اوقات و در زمانی که داروهای شیمی درمانی استاندارد کارایی نداشته، برای فرد مفید بوده و اغلب عوارض جانبی متفاوتی نیز دارند.
بسته به شرایط، گاهی اوقات میتوان از داروهای هدفمند برای درمان سرطان معده (gastric cancer) به تنهایی یا همراه با شیمی درمانی استفاده کرد.
داروهایی که HER2 را هدف قرار میدهند
در برخی از افراد مبتلا به سرطان معده، سلولهای سرطانی دارای مقدار زیادی پروتئین محرک رشد به نام HER2 روی سطح خود هستند. سرطانهایی که در آنها سطح HER2 افزایش یافته است، HER2 مثبت نامیده میشوند. داروهایی که پروتئین HER2 را هدف قرار میدهند اغلب میتوانند در درمان این سرطانها مفید باشند.
تراستوزوماب (Trastuzumab، هرسپتین و دیگر نامها)
تراستوزوماب یک آنتی بادی مونوکلونال است، یک نسخه مصنوعی از پروتئین سیستم ایمنی که HER2 را هدف قرار میدهد. افزودن تراستوزوماب به شیمی درمانی میتواند به برخی از افراد مبتلا به سرطان معده پیشرفته و HER2 مثبت کمک کند تا بیشتر از زمانی که فقط تحت شیمی درمانی قرار میگیرند، عمر کنند.
این دارو فقط در صورتی کارایی دارد که سلولهای سرطانی دارای HER2 بیش از حد باشند، بنابراین نمونههای سرطانی باید قبل از شروع درمان برای بررسی میزان سطح HER2 مورد آزمایش قرار گیرند (به تستهای سرطان معده مراجعه کنید).
تراستوزوماب به داخل ورید (از طریق خط IV یا کاتتر ورید مرکزی) تزریق میشود. برای سرطان معده، این دارو معمولاً هر 2 یا 3 هفته یک بار همراه با شیمی درمانی تجویز میشود.
Herceptin نام تجاری اصلی تراستوزوماب بود اما چندین نسخه مشابه (به نام بیوسیمیلار یا biosimilars) نیز اکنون در دسترس هستند؛ از جمله Ogivri، Herzuma، Ontruzant، Trazimera و Kanjinti.
عوارض جانبی تراستوزوماب
عوارض جانبی تراستوزوماب نسبتاً خفیف است. آنها میتوانند شامل تب و لرز، ضعف، حالت تهوع، استفراغ، سرفه، اسهال و سردرد باشند. این عوارض بعد از دریافت اولین دوز کمتر رخ میدهند.
این دارو همچنین به ندرت میتواند باعث آسیب قلبی شود. اگر تراستوزوماب با داروهای شیمی درمانی خاصی به نام آنتراسایکلینها مانند اپی روبیسین (epirubicin) داده شود، این خطر بیشتر است. قبل از شروع درمان با این دارو، پزشک ممکن است عملکرد قلب شما را با اکوکاردیوگرام یا اسکن MUGA آزمایش کند.
فام تراستوزوماب دروکستکان (Fam-trastuzumab deruxtecan یا Enhertu)
این یک ترکیب آنتی بادی-دارو (ADC) است که یک آنتی بادی مونوکلونال مرتبط با یک داروی شیمی درمانی است.
در این مورد، آنتی بادی ضد HER2 با اتصال به پروتئین HER2 روی سلولهای سرطانی، مانند یک سیگنال محلی عمل میکند و شیمی درمانی را مستقیماً به آنها میرساند.
این ADC میتواند به تنهایی برای درمان سرطان معده HER2 مثبت پیشرفته، معمولاً پس از آزمایش درمان با تراستوزوماب استفاده شود.
این دارو به داخل ورید (از طریق خط IV یا کاتتر ورید مرکزی) تزریق میشود و برای سرطان معده، معمولاً هر 3 هفته یک بار تجویز میشود.
عوارض جانبی فام تراستوزوماب دروکستکان
این دارو میتواند باعث کاهش تعداد سلولهای خونی شود که خود خطر عفونت و خونریزی را در فرد افزایش میدهد. سایر عوارض جانبی رایج این دارو میتواند شامل تهوع، استفراغ، اسهال یا یبوست، کاهش اشتها، تب، احساس خستگی و ریزش مو باشد.
این دارو میتواند در برخی افراد باعث بروز بیماری ریوی جدی شود که حتی ممکن است تهدید کننده حیات وی باشد. بسیار مهم است که اگر علائمی مانند سرفه، خس خس سینه، مشکل تنفسی یا تب دارید فوراً به پزشک یا پرستار خود اطلاع دهید.
این دارو همچنین به ندرت میتواند باعث آسیب قلبی شود. قبل از شروع درمان با این دارو، پزشک ممکن است عملکرد قلب شما را با اکوکاردیوگرام یا اسکن MUGA آزمایش کند.
داروهایی که VEGF را هدف قرار میدهند
برای رشد تومورها، آنها نیاز به ساخت رگهای خونی جدید برای دریافت خون و مواد مغذی دارند. یکی از پروتئینهایی که به سلولهای بدن میگوید رگهای خونی جدید بسازند VEGF نام دارد. پروتئین VEGF این کار را با اتصال به پروتئینهای سطح سلولی به نام گیرندههای VEGF انجام میدهد.
راموسیروماب (Cyramza، Ramucirumab)
Ramucirumab یک آنتی بادی مونوکلونال است که به گیرنده VEGF متصل میشود. این امر از اتصال VEGF به سلولها جلوگیری میکند و به آنها دستور میدهد رگهای خونی بیشتری نسازند. این کار میتواند به کاهش یا توقف رشد برخی سرطانها کمک کند.
راموسیروماب برای درمان سرطان پیشرفته معده، اغلب پس از توقف حداقل یک داروی شیمی درمانی (یا ترکیبی) استفاده میشود.
این دارو به صورت انفوزیون داخل وریدی (IV)، معمولاً هر 2 هفته یک بار تجویز میشود. میتوان آن را به تنهایی یا همراه با شیمی درمانی به بیمار داد.
عوارض جانبی راموسیروماب
شایع ترین عوارض جانبی این دارو فشار خون بالا، سردرد و اسهال است.
عوارض جانبی کمتر شایع اما احتمالاً جدی میتواند شامل لخته شدن خون، خونریزی شدید، ایجاد سوراخ در معده یا روده (perforations) و مشکلاتی در بهبود زخم باشد. اگر سوراخی در معده یا روده ایجاد شود، میتواند منجر به عفونت شدید شود و ممکن است برای اصلاح نیاز به جراحی داشته باشد.
مهارکنندههای TRK
تعداد بسیار کمی از سرطانهای معده تغییراتی در یکی از ژنهای NTRK دارند. این اتفاق باعث میشود سلولها پروتئینهای TRK غیر طبیعی بسازند که میتواند منجر به رشد غیر طبیعی آنها و ایجاد سرطان شود.
لاروترکتینیب (Larotrectinib یا Vitrakvi) و انترکتینیب (Rozlytrek یا entrectinib) داروهایی هستند که پروتئینهای TRK را هدف قرار میدهند. این داروها را میتوان برای درمان سرطانهای پیشرفته با تغییرات ژن NTRK که با وجود درمانهای دیگر همچنان در حال رشد هستند، استفاده کرد.
این داروها به صورت قرص، یک یا دو بار در روز مصرف میشوند.
عوارض جانبی مهارکنندههای TRK
عوارض جانبی رایج این داروها میتواند شامل سرگیجه، خستگی، حالت تهوع، استفراغ، یبوست، افزایش وزن و اسهال باشد.
عوارض جانبی کمتر شایع اما جدی میتواند شامل آزمایشات غیر طبیعی کبد، مشکلات قلبی و گیجی باشد.
سایر داروهای هدفمند
داروهای درمان هدفمند دیگری نیز در حال حاضر بر علیه سرطان معده آزمایش میشوند. برخی از آنها پروتئین HER2 را هدف قرار میدهند، در حالی که برخی دیگر اهداف متفاوتی دارند.
ایمونوتراپی (Immunotherapy) برای سرطان معده
ایمونوتراپی استفاده از داروها برای کمک به سیستم ایمنی خود فرد است که سلولهای سرطانی را به طور موثرتری پیدا کرده و از بین ببرد.
مهارکنندههای ایست بازرسی ایمنی (Immune checkpoint inhibitors)
بخش مهمی از سیستم ایمنی، توانایی آن در جلوگیری از حمله به سلولهای طبیعی بدن است. برای انجام این کار، از پروتئینهای «نقطه بازرسی یا checkpoint» روی سلولهای ایمنی استفاده میکنند که مانند سوئیچهایی عمل میکنند که برای شروع پاسخ ایمنی باید روشن (یا خاموش شوند). سلولهای سرطانی گاهی اوقات از این نقاط بازرسی برای جلوگیری از حمله سیستم ایمنی استفاده میکنند.
داروهایی که این نقاط بازرسی را هدف قرار میدهند (به نام مهارکنندههای ایست بازرسی ایمنی) میتوانند برای درمان برخی از افراد مبتلا به سرطان معده (که به عنوان سرطان گاستریک نیز شناخته میشود) استفاده شوند.
مهارکنندههای PD-1
نیولوماب (Nivolumab یا Opdivo) و پمبرولیزوماب (Keytruda یا pembrolizumab) داروهایی هستند که PD-1 – پروتئینی روی سطح سلولهای سیستم ایمنی به نام سلولهای T – را هدف قرار میدهند. پروتئین PD-1 به طور معمول به جلوگیری از حمله سلولهای T به سایر سلولهای بدن کمک میکند. با مسدود کردن PD-1، این داروها پاسخ ایمنی در برابر سلولهای سرطانی را تقویت میکنند. این کار میتواند برخی از تومورها را کوچک کرده یا رشد آنها را کند کند.
افراد مبتلا به سرطان معده پیشرفته میتوانند Nivolumab را به طور معمول و همراه با شیمی درمانی استفاده کنند.
این دارو به صورت انفوزیون داخل وریدی (IV) معمولاً هر 2 یا 3 هفته یک بار تجویز میشود.
پمبرولیزوماب را میتوان برای درمان سرطان پیشرفته معده استفاده کرد (معمولاً پس از آزمایش سایر درمانها از جمله شیمی درمانی) و اگر سلولهای سرطانی دارای یکی از موارد زیر باشند:
- سطح بالایی از ناپایداری ریز ماهواره (MSI-H) یا نقص در ژن تعمیر عدم تطابق (dMMR)
- بار جهشی توموری بالا (TMB-H)، به این معنی که جهشهای ژنی زیادی داشته باشند.
این دارو همچنین میتواند برای افراد مبتلا به سرطان معده پیشرفته که آزمایش HER2 آنها مثبت است، به عنوان بخشی از اولین قدم در روند درمان همراه با شیمی درمانی و داروی هدفمند تراستوزوماب استفاده شود.
این دارو به صورت انفوزیون داخل وریدی (IV) معمولاً هر 3 یا 6 هفته یک بار تجویز میشود.
عوارض جانبی احتمالی
عوارض جانبی این داروها میتواند شامل موارد زیر باشد:
- احساس خستگی یا ضعف
- تب
- سرفه کردن
- حالت تهوع
- خارش
- زوائد پوستی
- از دست دادن اشتها
- درد عضلانی یا مفصلی
- تنگی نفس
- یبوست یا اسهال
سایر عوارض جانبی جدی تر کمتر رخ میدهد. این عوارض میتواند شامل موارد زیر باشد:
واکنشهای انفوزیون (Infusion reactions): برخی از افراد ممکن است در حین مصرف یکی از این داروها، واکنش انفوزیون داشته باشند. این وضعیت مانند یک واکنش آلرژیک است و میتواند شامل تب، لرز، برافروختگی صورت، زوائد پوستی، خارش پوست، احساس سرگیجه، خس خس سینه و مشکل در تنفس باشد. مهم است که در صورت داشتن هر یک از این علائم در حین مصرف یکی از این داروها، فوراً به پزشک یا پرستار خود اطلاع دهید.
واکنشهای خود ایمنی (Autoimmune reactions): این داروها اساساً با حذف یکی از محافظهای سیستم ایمنی بدن عمل میکنند. گاهی اوقات این امر باعث میشود که سیستم ایمنی بدن به سایر قسمتهای بدن حمله کند که میتواند منجر به مشکلات جدی یا حتی تهدید کننده حیات در ریهها، رودهها، کبد، غدد هورمون ساز، کلیهها، پوست یا سایر اندامها شود.
بسیار مهم است که هر گونه عوارض جانبی جدید را فوراً به تیم پزشکی خود گزارش دهید. در صورت بروز عوارض جانبی جدی، ممکن است لازم باشد روند درمان متوقف شود و حتی ممکن است دوزهای بالایی از کورتیکواستروئیدها (corticosteroids) را برای سرکوب سیستم ایمنی خود دریافت کنید.
پرتو درمانی (Radiation Therapy) برای سرطان معده
پرتو درمانی از پرتوها یا ذرات پر انرژی برای از بین بردن سلولهای سرطانی در قسمت خاصی از بدن استفاده میکند.
چه زمانی از پرتو درمانی استفاده میشود؟
پرتو را میتوان به روشهای مختلفی برای کمک به درمان سرطان معده (سرطان گاستریک) استفاده کرد:
- برای برخی از سرطانهای قرار گرفته در مراحل اولیه، میتوان از پرتو درمانی همراه با شیمی درمانی (chemo) قبل از جراحی استفاده کرد تا سرطان را کوچک کرده و حذف آن را آسان تر کند. (این ترکیب به عنوان chemoradiation شناخته میشود.)
- پس از جراحی، میتوان از پرتو درمانی همراه با شیمی درمانی برای از بین بردن سلولهای سرطانی که در طول جراحی برداشته نشده اند استفاده کرد. این کار ممکن است به تاخیر یا جلوگیری از عود سرطان کمک کند.
- برای سرطانهایی که با جراحی قابل حذف نیستند، گاهی اوقات میتوان از پرتو درمانی برای کمک به کند کردن رشد سرطان و کاهش علائمی مانند درد، خونریزی یا مشکلات تغدیهای استفاده کرد.
پرتو درمانی چگونه انجام میشود؟
هنگامی که پرتو درمانی برای درمان سرطان معده استفاده میشود، پرتو از دستگاهی خارج از بدن بر روی سرطان متمرکز میشود. اغلب، انواع خاصی از پرتو درمانی، مانند پرتو درمانی منسجم سه بعدی (3D-CRT) یا پرتو درمانی تعدیل شده شدت (IMRT) استفاده میشود. این روشها از رایانهها برای هدف گیری پرتوها به سمت سرطان از چندین زاویه (و همچنین سایر تکنیکهای خاص) استفاده میکنند. این کار میتواند به تمرکز تابش بر روی سرطان کمک کرده و آسیب به بافتهای طبیعی مجاور را محدود کند.
قبل از شروع روند درمانهای شما، تیم پزشکی اندازه گیریهای دقیقی را برای تعیین زوایای صحیح برای نشانه گیری پرتوها و دوز مناسب تابش انجام میدهد. این جلسه برنامه ریزی که شبیه سازی (simulation) نامیده میشود، معمولا شامل انجام تستهای تصویر برداری مانند اسکن سی تی یا ام آر آی است.
پرتو درمانی بسیار شبیه عکس برداری با اشعه ایکس است اما پرتو درمانی بسیار قوی تر است. روند درمان بدون درد است. هر دوره درمانی فقط چند دقیقه طول میکشد، اگرچه زمان تنظیم – قرار دادن شما در موقعیت مناسب برای دوره درمانی – معمولاً بیشتر طول میکشد. دورههای درمانی معمولاً 5 روز در هفته و حداقل در طول چند هفته انجام میشوند اما طول درمان به دلیل انجام آن بستگی دارد.
عوارض جانبی احتمالی پرتو درمانی
عوارض جانبی پرتو درمانی برای سرطان معده میتواند شامل موارد زیر باشد:
- مشکلات پوستی، از قرمزی گرفته تا تاول و پوسته پوسته شدن پوست در مناطقی که تشعشع از آن عبور میکند.
- تهوع و استفراغ
- اسهال
- خستگی
- تعداد کم سلولهای خونی
این عوارض معمولاً ظرف چند هفته پس از پایان درمان از بین میروند.
هنگامی که پرتو درمانی همراه با شیمی درمانی برای فرد انجام میشود، عوارض جانبی اغلب بدتر میشوند.
ممکن استربرخی از افراد در طول درمان و پس از آن، در خوردن غذا و نوشیدن مایعات کافی دچار مشکل شوند. برخی ممکن است نیاز به تزریق مایعات به ورید (IV) یا قرار دادن یک لوله تغذیه برای دریافت مواد غذایی در طول درمان داشته باشند. اگر لوله فقط برای مدت کوتاهی مورد نیاز باشد، میتوان آن را از بینی و گلو عبور داده و به معده یا رودع رساند. اگر لوله برای مدت طولانی تری مورد نیاز باشد، میتوان آن را از طریق پوست در شکم و در طی یک عمل جراحی وارد روده کرد. این لوله به عنوان لوله ژژنوستومی یا لوله J شناخته میشود. سپس مواد غذایی مایع را میتوان مستقیماً در لوله وارد کرد.
حتماً هر گونه عوارض جانبی را به پزشک خود اطلاع دهید زیرا اغلب راههایی برای تسکین آنها وجود دارد.
همچنین ممکن است تشعشع به اندامهای مجاور آسیب برساند. این پدیده میتواند منجر به بروز مشکلاتی مانند آسیب قلبی یا ریوی یا حتی افزایش خطر ابتلا به سرطان دیگری در آینده شود. پزشکان تمام تلاش خود را برای جلوگیری از این امر با استفاده از تنظیم دوز مورد نیاز اشعه، کنترل دقیق محل قرارگیری پرتوها و محافظت از قسمتهای خاصی از بدن در برابر تشعشعات در طول درمان انجام میدهند.
مطالعه صدها مطلب علمی در حوزه بیولوژی
آرشیو جدیدترین خبرهای روز دنیای بیولوژی
مترجم: فاطمه فریادرس