اطلاعات عمومی,ویکی ژن
رتروویروس (Retrovirus): ساختار، تکثیر،انواع و کاربردها
رتروویروس چیست؟
رتروویروس نوعی ویروس است که یک کپی از ژنوم RNA خود را وارد DNA سلول میزبانی میکند که به آن حمله میکند، بنابراین ژنوم آن سلول را تغییر میدهد. هنگامی که ویروس وارد سیتوپلاسم سلول میزبان میشود، از آنزیم ترانس کریپتاز معکوس (reverse transcriptase enzyme) خود برای تولید DNA از ژنوم RNA خود استفاده میکند؛ برعکس الگوی معمول، بنابراین به شکل رترو (به سمت عقب) است.
سپس DNA جدید توسط یک آنزیم اینتگراز (integrase enzyme) به ژنوم سلول میزبان وارد میشود، در این مرحله DNA رتروویروسی به عنوان یک پروویروس (provirus) نامیده میشود. سپس سلول میزبان با DNA ویروسی به عنوان بخشی از ژنوم خود رفتار میکند و ژنهای ویروسی را همراه با ژنهای خود سلول رونویسی و ترجمه میکند و بنابراین پروتئینهای مورد نیاز برای جمع آوری نسخههای جدید ویروس تولید میشوند.
اگرچه رتروویروسها زیر خانوادههای مختلفی دارند اما دارای سه گروه اصلی هستند: انکورتروویروسها (رتروویروسهای انکوژن یا oncoretroviruses)، لنتیویروسها (رتروویروسهای آهسته یا lentiviruses) و اسپوماویروسها (ویروسهای کف آلود یا spumaviruses). انکورتروویروسها میتوانند در برخی از گونهها سرطان ایجاد کنند، لنتیویروسها میتوانند باعث نقص شدید ایمنی و مرگ در انسان و سایر حیوانات شوند اما اسپوماویروسها خوشخیم بوده و به هیچ بیماری در انسان یا حیوانات مرتبط نیستند.
بسیاری از رتروویروسها باعث ایجاد بیماریهای جدی در انسان، پستانداران دیگر و پرندگان میشوند. رتروویروسهای انسانی شامل HIV-1 و HIV-2، عامل بیماری ایدز هستند. همچنین ویروس T-لنفوتروپیک انسانی (HTLV) باعث بیماری در انسان میشود. ویروسهای لوسمی موشی (MLVs) باعث ایجاد سرطان در میزبان موش میشوند. رتروویروسها ابزارهای تحقیقاتی ارزشمندی در زیست شناسی مولکولی هستند و با موفقیت در سیستمهای انتقال ژن مورد استفاده قرار گرفتهاند.
ساختار رتروویروس
ویریونها (Virions) – ویروسهایی که به شکل ذرات مستقلی از رتروویروسها هستند – از ذرات پوششدار با قطر حدود 100 نانومتر تشکیل شدهاند. پوشش لیپیدی خارجی از گلیکوپروتئین (glycoprotein) تشکیل شده است. ویریونها همچنین حاوی دو مولکول RNA تک رشتهای یکسان به طول 7-10 کیلو باز هستند. این دو مولکول به صورت یک دایمر وجود دارند که از جفت شدن بازها بین توالیهای مکمل تشکیل میشوند.
محلهای برهمکنش بین دو مولکول RNA به عنوان “حلقه ساقه بوسیدن (kissing stem-loop)” شناسایی شده است. اگرچه ویریونهای رتروویروسهای مختلف، مورفولوژی یا زیست شناسی یکسانی ندارند اما همه اجزای ویریونها بسیار مشابه هستند.
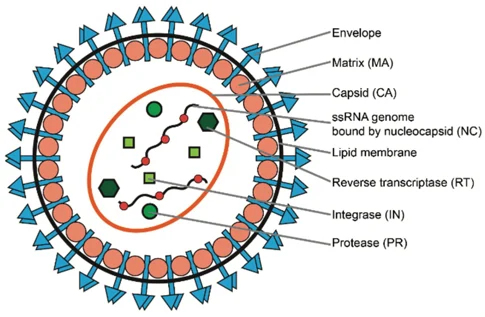
اجزای اصلی یک ویریون عبارتند از:
- پوشش (Envelope): از لیپیدها (که از غشای پلاسمایی میزبان در طی فرآیند جوانه زدن به دست میآید) و همچنین گلیکوپروتئین کد گذاری شده توسط ژن env تشکیل شده است. پوشش رتروویروسی سه عملکرد متمایز را انجام میدهد: محافظت از محیط خارج سلولی از طریق دولایه لیپیدی، امکان ورود یا خروج رتروویروس به سلولهای میزبان از طریق trafficking غشای اندوزومال و توانایی ورود مستقیم به سلولها از طریق ترکیب شدن با غشای آنها.
- RNA: از یک RNA دایمر تشکیل شده است. دارای کلاهکی در انتهای ‘5 و دم poly(A) در انتهای ‘3 است. RNA ژنومی (gRNA) در نتیجه فعالیت RNA پلیمراز II میزبان (Pol II) تولید میشود و با افزودن یک کلاهک متیل ‘5 و یک دم پلی-A به سمت ‘3 به عنوان mRNA میزبان پردازش میشود. ژنوم RNA همچنین دارای نواحی غیر کد کننده انتهایی است که در همانند سازی مهم هستند و نواحی داخلی که پروتئینهای ویریون را برای بیان ژن کد میکنند.
انتهای ‘5 شامل چهار ناحیه است که عبارتند از R، U5، PBS، و L. ناحیه R یک توالی کوتاه تکراری در هر انتهای ژنوم است که در طول رونویسی معکوس برای اطمینان از انتقال صحیح از سر به انتها در طی طویل شدن زنجیره استفاده میشود.
از سوی دیگر، U5 یک توالی منحصر به فرد کوتاه بین R و PBS است. PBS (محل اتصال پرایمر) شامل 18 باز است که مکمل انتهای ‘3 پرایمر tRNA هستند. ناحیه L یک ناحیه رهبر ترجمه نشده است که سیگنال بسته بندی یا پکیجینگ RNA ژنوم را میدهد. انتهای ‘3 شامل سه ناحیه است که عبارتند از PPT (دستگاه پلی پورین)، U3، و R. U3 دنبالهای بین PPT و R است که به عنوان سیگنالی عمل میکند که پروویروس میتواند در رونویسی از آن استفاده کند. R دنباله تکرار شده پایانی در انتهای ‘3 است.
- پروتئینها: متشکل از پروتئینهای gag، پروتئاز (PR)، پروتئینهای pol و پروتئینهای env.
- پروتئینهای آنتی ژن مخصوص گروه (gag) اجزای اصلی کپسید ویروسی (viral capsid) هستند که حدود 2000 تا 4000 کپی از آنها در هر ویریون موجود است. Gag دارای دو حوزه اتصال اسید نوکلئیک است، از جمله ماتریکس (matrix یا MA) و نوکلئوکپسید (nucleocapsid یا NC).
- به طور خاص، شناسایی، اتصال و بسته بندی RNA ژنومی رتروویروسی در مونتاژ ویریونها یکی از عملکردهای مهم پروتئین Gag است. فعل و انفعالات گگ با RNAهای سلولی نیز مراحل مونتاژ و ساخت (assembly) را تنظیم میکند. بیان گگ به تنهایی باعث تجمع ذرات ویروس مانند نابالغی میشود که از غشای پلاسمایی جوانه میزنند. در همه رتروویروسها، پروتئین Gag پیشساز پروتئین ساختاری داخلی است.
- پروتئاز (pro) در ویروسهای مختلف به طور متفاوتی بیان میشود. این ماده در جداسازیهای پروتئولیتیک در طول بلوغ ویریون عمل میکند تا پروتئینهای گگ و پل بالغ را بسازد. پروتئینهای رتروویروسی Gag مسئول هماهنگی بسیاری از جنبههای مونتاژ و ساخت ویریون هستند.
- پروتئینهای Pol مسئول سنتز DNA ویروسی و ادغام آن در DNA میزبان پس از عفونت هستند.
- پروتئینهای Env در ارتباط و ورود ویریونها به سلول میزبان نقش دارند. داشتن یک کپی عملکردی از یک ژن env چیزی است که رتروویروسها را از عناصر retroelement متمایز میکند.
- توانایی رتروویروس برای اتصال به سلول میزبان هدف خود با استفاده از گیرندههای سطح سلولی خاص توسط جزء سطحی (SU) پروتئین Env ناشی میشود، در حالی که توانایی رتروویروس برای ورود به سلول از طریق همجوشی غشایی توسط جزء غشایی ترانس لنگر (TM) غشاء ایجاد میشود. بنابراین این پروتئین Env است که رتروویروس را قادر میسازد تا عفونی شود.
- چندین گونه پروتئینی با RNA در ویریون رتروویروس مرتبط هستند: پروتئین نوکلئوکپسید (NC) فراوان ترین پروتئین است که RNA را میپوشاند. در حالی که سایر پروتئینها در مقادیر بسیار کمتری وجود داشته و فعالیت آنزیمی دارند.
برخی از فعالیتهای آنزیمی که در ویریون رتروویروس وجود دارند شامل DNA پلیمراز وابسته به RNA (ترانس کریپتاز معکوس؛ RT)، DNA پلیمراز وابسته به DNA، ریبونوکلئاز H (RNase H) اینتگراز و پروتئاز است. نشان داده شده است که RNaseهای رتروویروسی H کد گذاری شده توسط همه رتروویروسها، از جمله HIV، سه حالت مختلف برش را نشان میدهند: داخلی، به سمت انتهایی ′3 DNA و به سمت انتهایی ′5 RNA. هر سه حالت برشی نقشی در رونویسی معکوس دارند. بنابراین، فعالیت RNase H در چندین جنبه از رونویسی معکوس ضروری است.
استفاده از یک فعالیت RNase H در طول تکثیر ویروسی یک استراتژی منحصر به فرد برای کپی کردن ژنوم RNA تک رشته ای در یک DNA دو رشته ای را نشان میدهد زیرا DNA تک رشتهای مکمل یکدیگر هستند و باعث جفت شدن بازها با ژنوم رتروویروس در اولین چرخه از سنتز DNA میشوند. فعالیت ریبونوکلئاز RNase H نیز در چرخه زندگی رتروویروسی مورد نیاز است زیرا آغازگرهای ضروری (primers essential) توسط ترانس کریپتاز معکوس (RT) برای شروع سنتز DNA را تولید و حذف میکند. رتروویروسهایی که فاقد فعالیت RNase H هستند غیرعفونی میباشند.
ساختار ژنومی رتروویروس
ژنوم رتروویروسی به صورت ذرات ویروسی بسته بندی میشود. این ذرات ویروسی دایمرهای مولکولهای خطی RNA تک رشتهای با بار مثبت هستند.
رتروویروسها (و به طور کلی اورترویروسها (orterviruses)) از طرح (gag–pro–pol–env–3-‘5) در ژنوم RNA پیروی میکنند. gag و pol پلی پروتئینها را کد میکنند و هر کدام کپسید و همانند سازی را مدیریت میکنند. ناحیه pol آنزیمهای لازم برای تکثیر ویروسی مانند ترانس کریپتاز معکوس، پروتئاز و اینتگراز را کد میکند. بسته به نوع ویروس، ژنها ممکن است روی هم قرار بگیرند یا به زنجیرههای پلی پروتئینی بزرگتری تبدیل شوند.
برخی از ویروسها حاوی ژنهای اضافی هستند. جنس لنتی ویروس، جنس اسپوماویروس، جنس HTLV یا ویروس لوسمی گاوی (BLV)، و جنس ویروس ماهی که به تازگی شناخته شده، رتروویروسهایی هستند که به عنوان أنواع پیچیده طبقه بندی میشوند. این ویروسها علاوه بر ژنهای gag، pro، pol و env، دارای ژنهایی به نامهای جانبی هستند. ژنهای جانبی بین pol و env، در پایین دست از env، از جمله ناحیه U3 LTR، یا در قسمتهای env و همپوشانی (overlapping portions) قرار دارند.
در حالی که ژنهای کمکی نقشهای کمکی دارند، بیان ژن ویروسی را نیز هماهنگ و تنظیم میکنند. علاوه بر این، برخی از رتروویروسها ممکن است حامل ژنهایی به نام انکوژن یا ژنهای onc از کلاس دیگری باشند. رتروویروسهای دارای این ژنها (که ویروسهای تبدیلکننده (transforming viruses) نیز نامیده میشوند) به دلیل تواناییشان در ایجاد سریع تومور در حیوانات و تبدیل سلولها در محیط کشت به حالت انکوژنیک (oncogenic) شناخته شدهاند.
پلی پروتئینها به پروتئینهای کوچک تری تقسیم میشوند که هر کدام عملکرد خاص خود را دارند. نوکلئوتیدهایی که آنها را کد میکنند به عنوان زیر ژن یا ساب ژن (subgenes) شناخته میشوند.
تکثیر رتروویروس
هنگامی که رتروویروسها ژنوم خود را در سلولهای زایا (germ line) ادغام کردند، ژنوم آنها به نسل بعدی منتقل میشود. این رتروویروسهای درونزا (ERV یا endogenous retroviruses)، در تضاد با ویروسهای اگزوژن، اکنون 5 تا 8 درصد از ژنوم انسان را تشکیل میدهند. بیشتر اینسرشنها (ورود ماده ژنتیکی اضافی به ژنوم یا insertions) عملکرد شناخته شدهای ندارند و اغلب به عنوان “DNA ناخواسته (junk DNA)” نامیده میشوند.
با این حال، بسیاری از رتروویروسهای درونزا نقش مهمی در زیست شناسی میزبان دارند، مانند کنترل رونویسی ژن، همجوشی سلولی در طول رشد جفت در طول رشد و تکثیر جنین و مقاومت در برابر عفونت رتروویروسی خارجی. رتروویروسهای درونزا نیز در تحقیقات پاتولوژیهای مرتبط با ایمونولوژی، مانند بیماریهای خود ایمنی مانند مولتیپل اسکلروزیس (multiple sclerosis)، توجه ویژهای به خود جلب کردهاند، اگرچه رتروویروسهای درونزا هنوز هیچ نقشی در این دسته از بیماریها بازی نمیکنند
در حالی که به طور کلاسیک تصور میشد که رونویسی فقط از DNA به RNA رخ میدهد، رونویسی معکوس RNA را به DNA رونویسی میکند. اصطلاح “رترو” در رتروویروس به این معکوس کردن (ساخت DNA از روی RNA) جهت معمول رونویسی اشاره دارد. این روش هنوز هم از dogma اصلی زیست شناسی مولکولی پیروی میکند که بیان میکند اطلاعات را میتوان از اسید نوکلئیک به اسید نوکلئیک منتقل کرد اما نمیتوان آن را از پروتئین به پروتئین یا اسید نوکلئیک بازگرداند.
فعالیت ترانس کریپتاز معکوس خارج از رتروویروسها تقریباً در تمام یوکاریوتها یافت شده است که امکان تولید و قرار دادن نسخههای جدیدی از رتروترانسپوزونها (retrotransposons) را در ژنوم میزبان فراهم میکند. این اینسرشنها توسط آنزیمهای میزبان به مولکولهای RNA جدیدی که وارد cytosol شده اند، رونویسی میشوند. بعد، برخی از این مولکولهای RNA به پروتئینهای ویروسی ترجمه میشوند.
پروتئینهای کد گذاری شده توسط ژنهای gag و pol از mRNAهای بدست آمده از طول ژنوم به پلی پروتئینهای Gag و Gag-Pol ترجمه میشوند. به عنوان مثال، برای ژن gag به مولکولهای پروتئین کپسید و برای ژن pol به مولکولهای ترانس کریپتاز معکوس ترجمه میشود. رتروویروسها به مقدار بسیار بیشتری از پروتئینهای Gag نسبت به پروتئینهای Pol نیاز دارند و سیستمهای پیشرفتهای را برای سنتز مقدار مورد نیاز هر کدام توسعه دادهاند.
به عنوان مثال، پس از سنتز Gag، تقریباً 95 درصد از ریبوزومها (ribosomes) به ترجمه پایان میدهند، در حالی که سایر ریبوزومها به ترجمه برای سنتز Gag-Pol ادامه میدهند. در شبکه آندوپلاسمی زبر، گلیکوزیلاسیون شروع میشود و ژن env از mRNAهای متصل شده در این شبکه آندوپلاسمی، به مولکولهای پروتئین پوششی ترجمه میشود.
هنگامی که مولکولهای پروتئین پوششی به دستگاه گلژی منتقل میشوند، توسط یک پروتئاز میزبان به گلیکوپروتئین سطحی و گلیکوپروتئین گذرنده تقسیم میشوند. این دو فرآورده گلیکوپروتئینی در وابستگی و نزدیک یکدیگر باقی میمانند و پس از گلیکوزیلاسیون به غشای پلاسمایی منتقل میشوند.
توجه به این نکته مهم است که یک رتروویروس باید ترانس کریپتاز معکوس خود را همراه با کپسید خود “بیاورد”، در غیر این صورت به دلیل ماهیت غیر عادی تولید DNA از RNA، قادر به استفاده از آنزیمهای سلول آلوده برای انجام کار خود نیست.
داروهای صنعتی که به عنوان مهارکنندههای پروتئاز و ترانس کریپتاز معکوس طراحی میشوند، به گونهای ساخته میشوند که مکانها و توالیهای خاصی را در آنزیمهای مربوطه خود هدف قرار میدهند. با این حال، این داروها به دلیل این واقعیت که توالیهای ژنی که پروتئاز و ترانس کریپتاز معکوس را کد میکنند به سرعت میتوانند تغییر کنند، بی اثر میشوند. این تغییرات در بازها باعث میشود کدونها و مکانهای خاصی همراه با آنزیمها تغییر کنند و در نتیجه ویروس با از دست دادن مکانهایی که دارو در واقع هدف قرار میدهد، از هدفگیری توسط دارو جلوگیری میکند.
از آن جایی که رونویسی معکوس فاقد تصحیح معمول (usual proofreading) در همانند سازی DNA است، یک رتروویروس اغلب دچار جهش میشود. این جهشها ویروس را قادر میسازند تا به سرعت در برابر داروهای ضد ویروسی مقاوم شده و مانع از توسعه واکسنها و مهار کنندههای مؤثر برای رتروویروس شود.
یکی از مشکلاتی که در برخی از رتروویروسها مانند RETEROVIRUS Moloney وجود دارد، نیاز به تقسیم فعال سلولها برای انتقال است. در نتیجه سلولهایی مانند نورونها در برابر عفونت و انتقال توسط رتروویروسها بسیار مقاوم هستند. این پدیده نگرانی را ایجاد میکند که جهش زایی اضافه شدن (insertional mutagenesis) به دلیل ادغام در ژنوم میزبان ممکن است منجر به بروز سرطان یا لوسمی (leukemia) شود. این کار برخلاف لنتی ویروسها – یک جنس از Retroviridae – است که میتوانند RNA خود را در ژنوم سلولهای میزبان غیر قابل تقسیم نیز ادغام کنند.
نوترکیبی (Recombination)
دو ژنوم RNA در هر ذره رتروویروسی بسته بندی (packaging) میشوند اما پس از عفونت، هر ویروس تنها یک PROVIRUS را تولید میکند. پس از عفونت، رونویسی معکوس رخ میدهد و این فرآیند با نوترکیبی همراه است. نوترکیبی شامل تغییر رشته الگو بین دو نسخه ژنوم (بازترکیب انتخابی کپی یا copy choice recombination) در طول رونویسی معکوس است. 5 تا 14 رویداد نوترکیبی در هر ژنوم در هر چرخه همانند سازی رخ میدهد. به نظر میرسد نوترکیبی ژنتیکی برای حفظ یکپارچگی ژنوم و به عنوان یک مکانیسم ترمیمی برای نجات ژنومهای آسیب دیده ضروری باشد.
پروویروس (Provirus)
DNA تشکیل شده پس از رونویسی معکوس (پروویروس) طولانی تر از ژنوم RNA است زیرا هر یک از پایانهها دارای توالیهای U3 – R – U5 هستند که به آن تکرار طولانی ترمینال (LTR یا long terminal repeat) میگویند.
بنابراین، ترمینال 5 دارای دنباله U3 اضافی است، در حالی که ترمینال دیگر دارای دنباله U5 است. LTRها میتوانند سیگنالهایی را برای کارهای حیاتی مانند شروع تولید RNA یا مدیریت سرعت رونویسی ارسال کنند. به این ترتیب، LTRها میتوانند تکثیر و از این رو، کل پیشرفت چرخه ویروسی را کنترل کنند. اگرچه cDNA رتروویروسی غیر یکپارچه در هسته قرار دارد اما یک بستر بسیار ضعیف برای رونویسی است. به همین دلیل، یک پروویروس یکپارچه برای بیان دائمی و مؤثر ژنهای رتروویروسی ضروری است.

این DNA میتواند به عنوان یک پروویروس در ژنوم میزبان گنجانده شود که میتواند به سلولهای نتاج یا دختری منتقل شود. DNA رتروویروس به طور تصادفی در ژنوم میزبان قرار میگیرد. به همین دلیل، میتوان آن را به انکوژنها وارد کرد. به این ترتیب برخی از رتروویروسها میتوانند سلولهای طبیعی را به سلولهای سرطانی تبدیل کنند. برخی از پروویروسها قبل از اینکه با تغییر محیط سلول فعال شوند، برای مدت طولانی در سلول پنهان میمانند.
تکامل اولیه
مطالعات رتروویروسها منجر به اولین سنتز DNA از الگوهای RNA شد، یک روش اساسی برای انتقال مواد ژنتیکی که هم در یوکاریوتها و هم در پروکاریوتها وجود دارد. حدس زده شده است که فرآیندهای رونویسی RNA به DNA که توسط رتروویروسها استفاده میشود ممکن است ابتدا باعث شده باشد که DNA به عنوان ماده ژنتیکی استفاده شود. در این مدل، فرضیه دنیای RNA (the RNA world hypothesis)، موجودات سلولی زمانی که رتروویروسها برای ایجاد DNA از الگوهای RNA تکامل یافتند، DNA پایدارتر از نظر شیمیایی را اتخاذ کردند.
تخمینی از تاریخ تکامل رتروویروسهای درونزای کف مانند (foamy-like endogenous retroviruses)، زمان آخرین جد مشترک را بیش از 450 میلیون سال پیش نشان میدهد.
ژن درمانی (Gene therapy)
ناقلهای گامارتروویروسی (Gammaretroviral) و لنتیویروسی برای ژن درمانی ایجاد شدهاند که به شکل واسطه برای اصلاح ژنتیکی پایدار سلولهای تیمار شده را با ادغام کروموزومی ژنومهای ناقل منتقل شده عمل میکنند. این فناوری نه تنها برای اهداف تحقیقاتی، بلکه برای ژن درمانی بالینی با هدف اصلاح طولانی مدت نقایص ژنتیکی- به عنوان مثال، در سلولهای بنیادی (stem cell) و پیش ساز (progenitor cells) – مورد استفاده قرار میگیرد.
ذرات ناقل رتروویروسی با تروپیسم (tropism) برای سلولهای هدف مختلف طراحی شده است. ناقلهای گامارتروویروسی و لنتیویروسی تاکنون در بیش از 300 کارآزمایی بالینی مورد استفاده قرار گرفتهاند که به گزینههای درمانی برای بیماریهای مختلف میپردازند. جهشهای رتروویروسی را میتوان برای ساخت مدلهای تراریخته (transgenic) موش برای مطالعه سرطانهای مختلف و مدلهای متاستاتیک (metastatic) آنها ایجاد کرد.
سرطان
رتروویروسهایی که باعث رشد تومور میشوند عبارتند از: ویروس سارکوم روس (Rous sarcoma virus) و ویروس تومور پستانی موش (mouse mammary tumor virus). سرطان میتواند توسط پروتوآنکوژنهایی (proto-oncogenes) که به اشتباه در DNA پروویروسی گنجانده شدهاند یا با اختلال در پروتوآنکوژنهای سلولی ایجاد شود. ویروس سارکوم روس حاوی ژن src است که باعث تشکیل تومور میشود.
بعدها مشخص شد که یک ژن مشابه در سلولها در سیگنال دهی سلولی نقش دارد که به احتمال زیاد همراه با DNA پروویروسی جدا شده است. ویروسهای غیر تبدیل شونده میتوانند به طور تصادفی DNA خود را وارد پروتوآنکوژنها کنند و بیان پروتئینهایی را که چرخه سلولی را تنظیم میکنند، مختل کنند. پروموترDNA provirus همچنین میتواند باعث بیان بیش از حد ژنهای تنظیم کننده شود.
رتروویروسها میتوانند باعث ایجاد بیماریهایی مانند سرطان و نقص ایمنی شوند. اگر DNA ویروسی در کروموزومهای میزبان ادغام شود، میتواند منجر به بروز عفونتهای دائمی گردد. بنابراین مهم است که پاسخ بدن به رتروویروسها را کشف کرده و این مکانیسمها را بشناسیم. رتروویروسهای اگزوژن به ویژه با بیماریهای بیماری زا مرتبط هستند. به عنوان مثال، موشها دارای ویروس تومور پستان موش (MMTV) هستند که یک رترو ویروس است.
این ویروس از طریق شیر مادر به موشهای تازه متولد شده منتقل میشود. موشهای حامل این ویروس در سن 6 ماهگی به دلیل وجود رتروویروس به سرطان پستان مبتلا میشوند. علاوه بر این، ویروس لوسمی I (HTLV-1) که در سلول T انسانی یافت میشود، سالهاست در ما وجود دارد.
تخمین زده میشود که این رتروویروسها در سنین 40 و 50 سالگی باعث سرطان خون میشوند. این ویروس ساختاری قابل تکرار و تکثیر دارد که میتواند باعث ایجاد سرطان شود. علاوه بر توالی ژنی معمولی رتروویروسها، HTLV-1 حاوی ناحیه چهارمی به نام PX است. این ناحیه پروتئینهای تنظیم کننده Tax، Rex، p12، p13 و p30 را کد میکند. پروتئین Tax فرآیند لوسمی را آغاز کرده و رونویسی همه ژنهای ویروسی را در DNA پروویروسی HTLV سازماندهی میکند.
طبقه بندی
رتروویروسهای اگزوژن، ویروسهای عفونی حاوی RNA یا DNA هستند که از ارگانیسمی به موجود دیگر منتقل میشوند. در سیستم طبقه بندی بالتیمور (Baltimore classification) که ویروسها را بر اساس روش سنتز RNA پیامرسان (messenger RNA) گروه بندی میکند، این ویروسها به دو گروه تقسیم میشوند:
گروه VI: ویروسهای RNA تک رشتهای با واسطه DNA در چرخه زندگیشان و گروه VII: ویروسهای DNA دو رشتهای با یک واسطه RNA در چرخه زندگی خود.
ویروسهای گروه VI
همه اعضای گروه VI از ترانس کریپتاز معکوس رمز گذاری شده ویروسی، یک DNA پلیمراز وابسته به RNA، برای تولید DNA از ژنوم اولیه RNA ویریون استفاده میکنند. این DNA اغلب در ژنوم میزبان ادغام میشود – مانند رتروویروسها و شبهویروسها (pseudoviruses) – جایی که میتواند توسط میزبان تکثیر و رونویسی میشود.
گروه ششم (VI) شامل:
- Order Ortervirales
- خانواده Belpaoviridae
- خانواده Metaviridae
- خانواده Pseudoviridae
- خانواده Retroviridae – رتروویروسها، به عنوان مثال: HIV
- خانواده Caulimoviridae – خانواده ویروس گروه VII
خانواده Retroviridae قبلا به سه زیرخانواده (Oncovirinae، Lentivirinae و Spumavirinae) تقسیم میشد اما اکنون به دو گروه تقسیم میشود: Orthoretrovirinae و Spumaretrovirinae.
اصطلاح oncovirus در حال حاضر معمولاً برای توصیف یک ویروس ایجاد کننده سرطان استفاده میشود. این خانواده اکنون شامل جنسهای زیر میباشد:
- زیر خانواده Orthoretrovirinae:
- جنس آلفارتروویروس (Alpharetrovirus)؛ از جمله ویروس لوکوز پرندگان (Avian leukosis virus) و ویروس سارکوم روس
- جنس بتارتروویروس (Betaretrovirus)؛ از جمله ویروس تومور پستانی موش
- جنس گامارتروویروس (Gammaretrovirus)؛ از جمله ویروس لوسمی موشی (Murine leukemia virus) و ویروس لوسمی گربه (Feline leukemia virus)
- جنس دلتارتروویروس (Deltaretrovirus)؛ از جمله ویروس لوسمی گاوی (Bovine leukemia virus) و ویروس T-لنفوتروپیک عامل سرطان انسانی (cancer-causing Human T-lymphotropic virus)
- جنس اپسیلون رتروویروس (Epsilonretrovirus)
- جنس لنتی ویروس؛ از جمله ویروس نقص ایمنی انسانی 1 و ویروسهای نقص ایمنی سیمیان (Simian) و گربه
- زیرخانواده Spumaretrovirinae:
- جنس Bovisspumavirus
- جنس Equispumavirus
- جنس Felispumavirus
- جنس Prosimiispumavirus
- جنس Simiispumavirus
توجه داشته باشید که طبق ICTV 2017، جنس Spumavirus به پنج جنس تقسیم شده است و نوع سابق آن ویروس فومی سیمیان (Simian foamy virus)، اکنون با حداقل 14 گونه، از جمله گونه جدید، از جمله گونه جدید ویروس فومی سیمان شامپانزه شرقی (Eastern chimpanzee simian foamy virus)، به سرده Simiispuma ارتقا یافته است.
ویروسهای گروه VII
هر دو خانواده در گروه VII دارای ژنوم DNA موجود در ذرات ویروس مهاجم هستند. ژنوم DNA به هر دو شکل mRNA برای استفاده به عنوان رونوشت در سنتز پروتئین و RNA پیش ژنومی برای استفاده به عنوان الگو در طول همانند سازی ژنوم رونویسی میشود. ترانس کریپتاز معکوس کد گذاری شده ویروسی از RNA پیش ژنومی به عنوان الگویی برای ایجاد DNA ژنومی استفاده میکند.
گروه هفتم (VII) شامل:
- خانواده Caulimoviridae – به عنوان مثال: ویروس موزاییک گل کلم (Cauliflower mosaic virus)
- خانواده Hepadnaviridae – به عنوان مثال: ویروس هپاتیت B (Hepatitis B virus)
- خانواده Nackednaviridae – به عنوان مثال: سیکلید ناکدناویروس آفریقایی (ACNDV یا African cichlid nackednavirus) که قبلاً ویروس هپاتیت B سیکلید آفریقایی (ACHBV) نامیده میشد.
خانوادههای Belpaoviridae، Metaviridae، Pseudoviridae، Retroviridae، و Caulimoviridae راسته Ortervirales را تشکیل میدهند.
ویروسهای درون زا (Endogenous)

رتروویروسهای درونزا به طور رسمی در این سیستم طبقه بندی گنجانده نشدهاند و به طور کلی بر اساس ارتباط با جنسهای برونزا به سه دسته طبقه بندی میشوند:
- کلاس I بیشتر شبیه به گامارتروویروسها است.
- کلاس II بیشتر شبیه به بتاتروویروسها و آلفارتروویروسها هستند.
- کلاس III بیشتر شبیه اسپوماویروسها است.
روشهای درمانی
داروهای ضد رتروویروسی داروهایی برای درمان عفونت توسط رتروویروسها، در درجه اول HIV – هستند. طبقات مختلف داروهای ضد رتروویروسی در مراحل مختلف چرخه زندگی HIV عمل میکنند. ترکیبی از چندین (معمولاً سه یا چهار) داروی ضد رتروویروسی به عنوان درمان ضد رتروویروسی بسیار فعال (HAART یا highly active anti-retroviral therapy) شناخته میشود.
همچنین بخوانید:
- روتاویروس چیست؟ ساختار، ژنوم، اپیدمیولوژی و علائم
- کشت ویروس: تکنیک ها، اصول و اهداف
- ویروس نیپا (NiV):ساختار، انتقال، تکثیر و تظاهرات بالینی
- ویروس چیست؟ پیدایش، ساختار، زیستگاه، شکل و اندازه
مترجم: فاطمه فریادرس





من مبتلا به رترو ویروسم دکتر رفتم بعد 5 روز، پدرم سرطان کیسه صفرا داشتن فوت شدن، به نظرتون برای چکاب برم پیش متخصص سرطان
بله از پزشک مشورت بگیرید