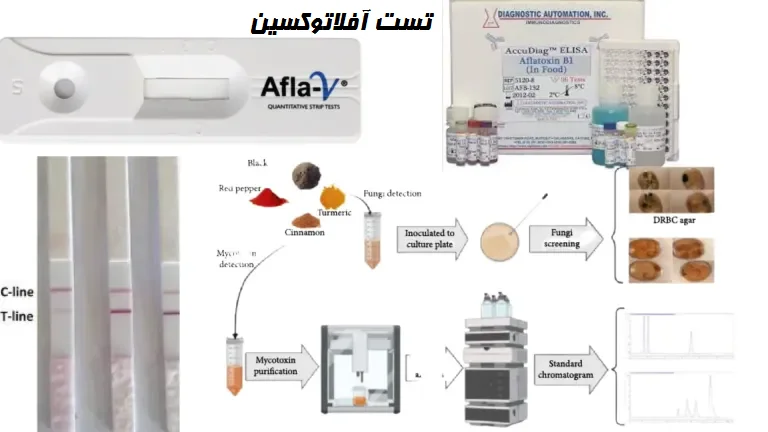
مقدمهای بر تست آفلاتوکسین
مایکوتوکسینها (Mycotoxin) (متابولیتهای ثانویه مربوط به قارچها) ترکیبات سمی برای حیوانات و انسانها هستند (مایکوتوککسیکوز (Mycotoxicosis)). 25 درصد از محصولات کشاورزی در سراسر جهان به مایکوتوکسینها آلوده میشوند. مصرف مایکوتوکسینها باعث ایجاد اثرات بیولوژیکی حاد و مزمن مختلف از جمله کارسینوما (Carcinoma)، جهش، تغیررات ژنتیکی و تاثیرات ایمونولوژیکی میشود.
آفلاتوکسینها گروهی از 16 مایکوتوکسین مرتبط از نظر ساختاری هستند که کارسینوژنیک، تراتوژنیک (Teratogenic) و سرطانزا برای کبد هستند. روشهایی که عموماً برای تشخیص و کمیسازی آفلاتوکسینها استفاده میشوند عبارتند از: تکنیکهای تحلیلی، کروماتوگرافی (Chromatographic)، ایمونوشیمیایی (Immunochemical)، حسگرهای ایمنی (Immunosensor) و طیفسنجی (Spectroscopic).
آفلاتوکسین (AF)

- منابع آفلاتوکسین: کپکهایی مانند آسپرژیلوس فلاووس (Aspergillus flavus)، آسپرژیلوس فومیگاتوس ( fumigatus)، آسپرژیلوس پارازیتیکوس (A. parasiticus)، پنیسیلیوم پوبرکولوم (Penicillium puberculum) ، پنیسیلیوم سیترینین (P. citrinin) و پنیسیلیوم اکسپانسوم (P. expansum) این سموم را در غذاهایی مانند ذرت، بادام زمینی و غیره تولید میکنند.
- عوامل موثر در تولید: دما و رطوبت دانه.
- انواع آفلاتوکسینها: B1، B2، G1، G2، M1 و M2 از خانواده آفلاتوکسینهای موجود در غذا هستند. سم B1 قویترین ماده سرطانزای طبیعی است. نوع B دارای یک حلقه E سیکلوپنتان (Cyclopentane E-ring) است و نوع G به جای سیکلوپنتان یک حلقه گزانتون (Xanthone) دارد. AFM1 و AFM2 متابولیتهای AFB1 و AFB2 هستند. اگر یک گاو شیر ده خوراک آلوده به B1 مصرف کند، دفع M1 در شیر اتفاق میافتد.
- مکانیسم اثر: آفلاتوکسینها تجزیه چربیها را در کبد مختل میکنند. کبد چرب یا استئاتوز (Steatosis) یک وضعیت کوتاه مدت یا طولانی مدت مسمومیت با آفلاتوکسین است. آفلاتوکسین همچنین با اتصال به گوانین (Guanine) موجود در DNA، سنتز mRNA را مهار میکند و منجر به سرطان میشود.
- سمیت: AF در کودکان سمیتر از بزرگسالان است. حساسیت به آن در هنگام کمبود تغذیه افزایش مییابد.
علائم بالینی:
- سرعت رشد را کاهش میدهد.
- این سم بازدهی تغذیه را کاهش میدهد.
- بروز کم خونی خفیف.
- افزایش حساسیت به بیماریهای عفونی.
درمان:
- سمزدایی با استفاده از سدیم کلسیم آلومینوسیلیکات (Sodium calcium aluminosilicate (HSCAS)).
- ویتامین E و سلنیوم (Selenium) به عنوان مکمل ارائه میشوند.
پیشگیری:
- مهار رشد کپک.
- اعمال آمونیاک بیآب به غلات برای مدت 10 تا 14 روز.
مواد مورد نیاز برای تست آفلاتوکسین
آفلاتوکسین موجود در مواد غذایی پس از مصرف به دلیل سمیت شدید آن، خطر قابل توجهی برای سلامتی دارد. بنابراین، تست آفلاتوکسین در غذاها بسیار مهم است. به دلیل غلظت کم، روشهای تحلیلی مانند کروماتوگرافی، طیفسنجی، حسگرهای الکتروشیمیایی و تکنیکهای ایمونوشیمیایی ترجیح داده میشوند. نمونه شامل مواد غذایی مشکوک است.
مواد مورد نیاز برای تست آفلاتوکسین به روشهای مورد استفاده برای استخراج، تشخیص و تعیین کمیت بستگی دارد. مواد مورد نیاز به شرح ذیل میباشد:
برای استخراج و خالصسازی
- یک حلال آلی مانند متانول (Methanol)، استون (Acetone) یا استونیتریل (Acetonitrile) که با آب مخلوط شده یا مخلوط نشده است.
- ماتریس جامد و روش / مخلوط آب و استونیتریل
- فلاسک، لوله سانتریفیوژ یا ویال و حمام اولتراسونیک (Ultrasonic bath)
- سیال فوق بحرانی (Supercritical fluid) (CO2)
- ستون ایمونوافینیتی (Immunoaffinity) برای خالصسازی
روش کروماتوگرافی
- فرتس (Frits)
- ستونها
- جریانهای سلول (Flow cell)
- پمپها
- آشکارسازها
- کالکتورها (Collector)
- سیلندر با گاز (کروماتوگرافی گازی)
- سیلیکاژل (Silica gel)، فویل آلومینیوم، حلال (کروماتوگرافی لایه نازک)
- حلال (کروماتوگرافی مایع با کارایی بالا)
آنالیز طیفسنجی
- اسپکتروفتومتر (Spectrophotometer)
تشخیص ایمونولوژیک
- پیپت (Pipette)
- برای الایزا (ELISA) (آزمایش ایمونوسوربنت (Immunosorbent) متصل به آنزیم): پلیت (Plate) پوشش داده شده با 96 خانه، ریدر (Reader)، کونژوگه (Conjugate)، کونژوگهها و محلول متوقف کننده (stop solution).
- برای RIA (رادیوامونواسی (Radioimmunoassay)): کیت جریان جانبی (Lateral flow)
تشخیص حسگر ایمنی
- سنسور QCM (میکروبالانس کریستال کوارتز (Quartz crystal microbalance)).
- سنسور SPR (رزونانس پلاسمای سطحی (Surface plasma resonance)).
- ایمونوسنسور الکتروشیمیایی
روشهای تست آفلاتوکسین

اولین مرحله تست آفلاتوکسین استخراج است. سپس خالصسازی و تغلیظ را به دنبال دارد. مرحله نهایی نیز تشخیص و کمیسازی است.
استخراج و خالصسازی (پاکسازی)
استخراج برای تشخیص و کمیسازی بهتر آفلاتوکسین در نمونههای مواد غذایی کلیدی است. استخراج و خالصسازی آفلاتوکسین میتواند به روشهای زیر انجام شود:
- استخراج مایع-مایع (Liquid-liquid extraction (LLE)): آفلاتوکسین در محلولهای قطبی-پروتیک (Polar-protic) مانند استون، کلروفرم، متانول و استونیتریل بسیار قابل حل است. این محلولها را میتوان با آب مخلوط کرد یا در حالت خالص استفاده کرد. این روش آنالیت (Analyte) خالص تولید نمیکند.
- استخراج مایع- جامد (Liquid-solid extraction (LSE)): مقدار ثابتی از ذرات غذای جامد با استفاده از نیروی گریز از مرکز (میکسر یا ورتکس (Vortex)) با یک شناساگر استخراج (یا استونیتریل/آب یا متانول/آب) در نسبتهای مختلف مخلوط میشود. این رویه رایجترین روش است و پس از آن روش خالصسازی مانند IAC (ستون ایمونوافینیتی (Immunoaffinity column)) قرار میگیرد.
- استخراج اولتراسوند (Ultrasound): نمونه مخلوط شامل LSE حاوی فلاسک، لوله سانتریفیوژ یا ویال در حمام اولتراسونیک با آب غوطهور میشود. اولتراسوند به انتقال سریع سم از نمونه به شناساگر استخراج کمک میکند.
- استخراج سیال فوق بحرانی (Supercritical fluid extraction (SFE)): استفاده از سیال فوق بحرانی CO2 برای استخراج آفلاتوکسین آپولار (Apolar) نتایج امیدوارکنندهای از خود نشان داده است. با این حال این روش برای آفلاتوکسینهای قطبی ایدهآل نیست، زیرا بازیابی سم پایینی داشته و غلظت بالاتری از عصارههای مشترک دارد.
- استخراج فاز جامد (SPE): این متد یک روش محبوب برای پاکسازی یا تصفیه است و از یک ستون C-18 (اکتادسیلسیلان) استفاده میکند. کاربرد آن در ستون پاکسازی ایمونوافینیتی (IAC) و SPME است. SPME با تکنیکهای کروماتوگرافی سازگار است و IAC دارای ستونهایی با آنتیبادیهای مخصوص سموم است. SPME دارای اختصاصیت بالایی در غذاهایی مانند آجیل، ادویهجات، میوههای خشک و غلات است. در مقابل، IAC در شیر پاستوریزه مفید است. در طول IAC، نمونه خام استخراج متصل شده در ستون اعمال میشود. آفلاتوکسین به آنتیبادی خاصی که در ستون تثبیت شده است، میشود. یک مرحله شستشو بعد از IAC لازم است.
تشخیص و کمیسازی
روشهای مختلفی برای تشخیص و کمیسازی آفلاتوکسینهای استخراجشده و خالصشده به کار گرفته شدهاند. آنها شامل تکنیکهای کروماتوگرافی (TLC، HPLC و GC)، تکنیکهای طیفسنجی (طیفسنجی فلورسانس و مادون قرمز)، تکنیکهای ایمونولوژیک (RIA، ELISA و ایمونواسی جریان بعدی (Later flow immunoassay))، و حسگرهای ایمنی (الکتروشیمیایی، نوری و QMC) هستند.
تکنیکهای کروماتوگرافی
تکنیکهای کروماتوگرافی شامل برهمکنش بین یک فاز متحرک و ساکن است. فاز متحرک معمولاً یک مایع، گاز یا سیال فوق بحرانی است که در اطراف فاز ساکن (جامد یا مایع) حرکت میکند. مخلوط با اجزای مورد نظر بین دو فاز (متحرک و ساکن) توزیع میشود. روش کلی عبارت است از حل کردن مخلوط در فاز متحرک و استفاده از آن به عنوان یک اسپات (Spot) در فاز ساکن. فاز متحرک، مخلوط را در امتداد فاز ساکن حمل میکند و سرعت اجزای مختلف مخلوط متفاوت است که این امر اساس جداسازی است.
تکنیکهای کروماتوگرافی که معمولاً مورد استفاده قرار میگیرند عبارتند از کروماتوگرافی لایه نازک (Thin-layer chromatography (TLC))، کروماتوگرافی گازی (Gas chromatography (GC)) و کروماتوگرافی مایع با کارایی بالا (High-performance liquid chromatography (HPLC)).
کروماتوگرافی لایه نازک (TLC)
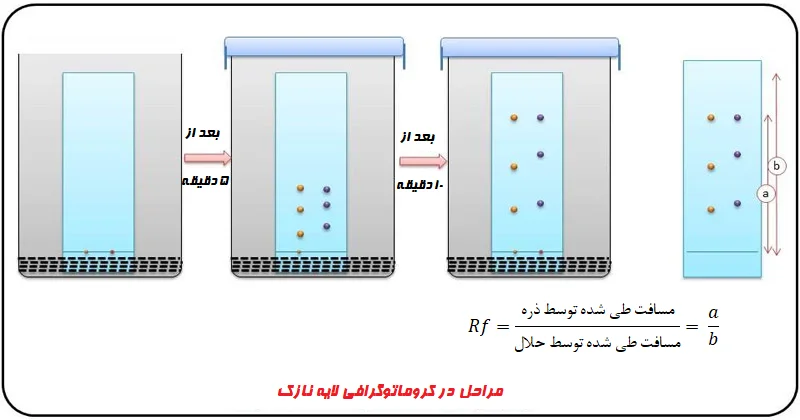
TLC به طور گستردهای در شناسای آفلاتوکسین در مواد غذایی استفاده میشود و آفلاتوکسینها را به میزان 1 تا 20 ppb (قسمت در میلیارد) پیدا میکند. فاز ساکن آن شامل سیلیس (Silica)، آلومینا (Alumina) یا سلولز (Cellulose) تثبیت شده در شیشه یا پلاستیک است.
فاز متحرک مورد استفاده برای جداسازی آفلاتوکسینها شامل مخلوطی از نمونه با استونیتریل، متانول و آب است. تفاوت در حلالیت آفلاتوکسینها، زمان برهمکنش بین فاز متحرک و ساکن را تعیین میکند. بسته به زمان برهمکنش و وزن مولکولی سم، به فاز ساکن یا متحرک میچسبد.
هر چه بیشتر به فاز ساکن بچسبد دیرتر از مخلوط جدا میشود و بالعکس. TLC به تشخیص انواع مختلف سموم در یک تک آزمایش کمک میکند. اگرچه این روش حساس است، اما به متخصصان بسیار آموزش دیده نیاز دارد و به دلیل استفاده از نمونهها، آمادهسازی پلیت و اشتباهات تفسیری، دقت کافی را ندارد.
HPTLC (کروماتوگرافی لایه نازک با کارایی بالا) به منظور بهبود محدودیت TLC توسعه یافته است. HPTLC یک فرآیند خودکار است که در آن به کارگیری نمونه، آمادهسازی پلیت و تفسیر خودکار است. HPTLC در حال حاضر دقیقترین و کارآمدترین تکنیک برای تعیین مایکوتوکسینها است.
کروماتوگرافی مایع با کارایی بالا (HPLC)
HPLC رایجترین روشی است که برای جداسازی اجزای مواد آلی استفاده میشود. این روش دارای یک جاذب در داخل یک لوله شیشهای یا پلاستیکی (ستون) به عنوان فاز ساکن و یک حلال آبی/آلی به عنوان فاز متحرک میباشد. نمونه به فاز ساکن تزریق میشود و با کمک فاز متحرک از آن عبور میکند.
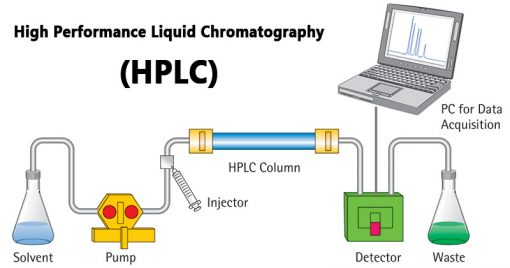
یک پمپ فشار بالایی را برای حرکت سریع فاز متحرک از طریق ستون (فاز ساکن) فراهم میکند. جدایی به دلیل میل ترکیبی متفاوت اجزا به فاز ساکن و متحرک رخ میدهد. هر چه میل ترکیبی بیشتر باشد، آنالیت بیشتری با آن فاز خاص واکنش میدهد. اگر یک آنالیت بیشتر با فاز متحرک برهمکنش داشته باشد، سریعتر جدا میشود.
زمان صرف شده برای شستشوی (جداسازی و به دنبال آن جابجایی از محل قرار داده شده) آنالیتها (مخلوط)، زمان بازداری (Retention Time) نامیده میشود. زمان بازداری با استفاده از آشکارسازهای UV، فلورسنت یا آرایه دیودی (Diode array) شناسایی میشود. HPLC به طور گستردهای در شناسایی آفلاتوکسینها استفاده میشود.
با این حال، به دلیل استفاده از اشعه ماوراء بنفش جهت شناسایی، به خالصسازی دقیق نمونه با استفاده از ستونهای ایمونوافینیتی و افتراق پرزحمت قبل و بعد از ستون برای تشخیص AFB1 و AFG1 نیاز دارد. از این رو برای غلبه بر این افتراق، HPLC با طیفسنجی جرمی که اندازه نمونه را برای تولید اطلاعات ساختاری محدود میکند، ترکیب شده است. اما فرایند انجام HPLC-MS/MS بزرگ است و فقط در محیطهای آزمایشگاهی مناسب است.
کروماتوگرافی گازی (GC)
در GC، فاز متحرک، گاز حامل است و فاز ساکن، مایع پوشش داده شده روی ذرات جامد خنثی که در یک لوله بلند فولادی ضد زنگ یا شیشهای (ستون) محصور شده، میباشد. فاز ساکن نیاز به حفظ دمای مناسب برای جداسازی دارد. نمونه به حالت گازی خود تبخیر و توسط گاز حامل در طول فاز ساکن حمل میشود.
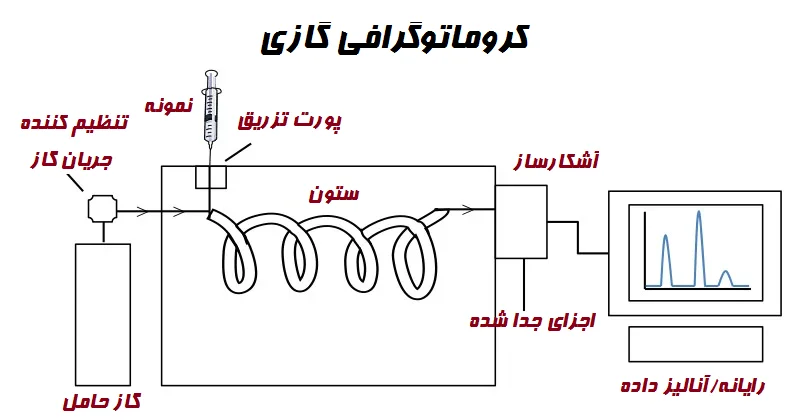
مانند تمام تکنیکهای کروماتوگرافی، اساس جداسازی اجزاء، توزیع آنها در بین دو فاز است. حرکت نمونه به میل ترکیبی اجزا با فاز ساکن بستگی دارد. هر چه این میل ترکیبی بیشتر باشد، حرکت کندتر و زمان بیشتری برای جدا شدن طول میکشد و بالعکس. هنگامی که جداسازی کامل شد، ذرات جدا شده با استفاده از FID (آشکارساز یونش شعله (Flame ionization detector))، یا آشکارساز ربایش الکترون (electron capture detector (ECD)) و یک طیفسنج جرمی شناسایی میشوند. از آنجایی که آفلاتوکسینها غیرفرار هستند، ممکن است برای شناسایی نیاز به افتراق داشته باشند و کمتر مورد استفاده قرار میگیرند.
تکنیکهای طیفسنجی
طیفسنجی فلورسانس (Fluorescence spectroscopy)
آفلاتوکسینها ترکیبات فلورسنتی هستند که پس از جذب نور، آن را با طول موجهای مختلف ساطع میکنند. روش فلورومتری (Fluorometric) به تعیین کمیت آفلاتوکسینها در محدوده بین 5 تا 5000 ppb کمک میکند. با این حال، افتراق برای آنالیز بهتر مورد نیاز است، و محدوده برای تشخیص، کمی بالاتر از حد 4 میکروگرم بر کیلوگرم که توسط استانداردهای اروپایی تعیین شده، میباشد.

طیفسنجی مادون قرمز (Infrared spectroscopy)
طیفسنجی مادون قرمز به تفاوت ارتعاشات مولکولی پس از تابش با مادون قرمز بستگی دارد. اندازه اتمی، طول پیوند و استحکام از یک مولکول به مولکول دیگر متفاوت است. میزان جذب تابش مادون قرمز توسط یک پیوند خاص به نوع پیوند و حالت ارتعاشات بستگی دارد. بنابراین، طیفهای فرکانسی مختلف پرتو مادون قرمز در طول آنالیز ترکیبات با استفاده از یک طیف سنج مادون قرمز از نمونه عبور میکنند.
سپس انرژی تابشی جذب شده توسط هر پیوند مولکول نمونه، اندازه گیری میشود. این اندازه گیری به ساخت نمودار طیف کمک میکند و هیچ دو مولکول آلی طیف یکسانی ندارند که این امر به شناسایی ترکیب آلی کمک میکند. این طیفسنجی در شناسایی آفلاتوکسین در بادام زمینی، کیک بادام زمینی و دانههای ذرت استفاده شده است.
تکنیکهای ایمونولوژیک
تکنیکهای ایمونولوژیک شامل اتصال خاص آنتیبادیها و آنتیژنها است. روشهای ایمونولوژیک مختلفی بر اساس اختصاصی بودن و برهمکنش با میل ترکیبی بالا بین آنتیبادیها و آنتیژنها ایجاد شدهاند و این روشها به روش اتصال لیگاند گیرنده (Receptor-ligand) توسعه یافتهاند. این برهمکنشها را میتوان با استفاده از جذب فوتونهای انرژی نوری توسط اسپکتروفتومتر اندازهگیری کرد.
راههای دیگر تشخیص و کمیسازی عبارت است از برچسب گذاری با رادیو ایزوتوپها (Radioisotope)، فلوروفورها (Fluorophore) و آنزیمها. روشهای ایمونوشیمیایی که معمولاً مورد استفاده قرار میگیرند عبارتند از: رادیوامونواسی (Radioimmunoassay (RIA))، سنجش ایمونوسوربنت متصل به آنزیم (ELISA)، حسگرهای ایمنی، و ICA (آزمایش ستون ایمنی (Immunocolumn assay)).
رادیوایمونواسی (RIA)
RIA بر اتصال رقابتی آنتیژنهای نشاندار شده با رادیواکتیو و آنتیژنهای نشاندار نشده با رادیواکتیو به آنتیبادیهای موجود متکی است. آنتیژن نشاندار نشده با آنتیژن رادیواکتیوی برای اتصال به تعداد ثابتی از آنتیبادیها رقابت میکند. مقدار آنتیژن و آنتیبادی نشاندار شده با رادیواکتیو مشخص است، در حالی که مقدار آنتیژنهای نشاندار نشده مشخص نیست، اما مقدار آن با مقدار آنتیژنهای نشاندار شده با رادیواکتیو نسبت معکوس دارد.
RIA در تعیین کمی و کیفی آفلاتوکسینها استفاده میشود. اگرچه RIA میتواند چند نمونه را به طور همزمان آنالیز کند، اما این روش به آنتیژن در حالت خالص نیاز دارد و ایزوتوپ رادیواکتیو خطرناک بوده و دفع و ذخیره آن سخت است.
الایزا (ELISA)
روش ایمونوشیمیایی دیگری که بر محدودیت خطرناک RIA غلبه میکند، الایزا است که در آن یک آنتیژن یا آنتیبادی به آنزیمها متصل میشود. اساس روش الایزا مشابه روشهای دیگر ایمونوشیمیایی است که بر اتصال خاص آنتیژن- آنتیبادی و افزایش حساسیت به دلیل آنتیژن یا آنتیبادی متصل به آنزیمی که با یک بستر خاص ترکیب میشود، متکی است.

ELISA به صورت کیت موجود است و به راحتی میتواند آفلاتوکسینها را در محصولات کشاورزی شناسایی کند. اگرچه به مراحل شستشوی زیادی نیاز دارد، اما مقرون به صرفه است، میتواند 96 نمونه را به طور همزمان آنالیز کند و هیچ خطری برای سلامتی ندارد.
دستگاههای جریان جانبی (کیت)
دستگاههای جریان جانبی، سنجشهای ایمونوکروماتوگرافی هستند. اصول این دستگاهها بر اساس برهمکنش آنتیژن-آنتیبادی میباشد. این اصول شامل یک غشای متخلخل برای نمونههای در حال جریان، یک پد جاذب برای افزایش حجم مایع در حال جریان و یک پد نمونه برای اطمینان از تماس بین نمونه مایع و غشاء هستند.
این دستگاهها از طلای کلوئیدی (Colloidal gold) یا آنتیبادیهای پوشیده شده با طلا برای تشخیص نواحی اتصال قرمز رنگ استفاده میکنند. نمونه به دلیل فعالیت کپیلاری (Capillary) از طریق پد نمونه حرکت میکند. هنگامی که نمونه با آفلاتوکسینها به ذرات طلا میرسد، آفلاتوکسینها به این ذرهها متصل و خط قرمز رنگی ایجاد میکنند.
دستگاهی که توسط Delmulle و همکارانش ساخته شده است، میتواند 5 میکروگرم/کیلوگرم AFB1 را در خوراک خوک، ظرف 10 دقیقه تشخیص دهد. استفاده از این دستگاهها آسان است، هزینه کمتری دارند و تشخیص سریع در محل را ارائه میدهند.
تکنیکهای حسگر ایمنی برای شناسایی
ایمونوسنسورها حسگرهای زیستی هستند که از آنتیژنها یا آنتیبادیها به عنوان اجزای شناسایی کننده همراه با مبدلهای سیگنال مانند گرافیت، طلا یا کربن استفاده میکنند. حسگرهای ایمنی به تشخیص اتصال بین گونههای مکمل کمک میکنند. بر اساس ترارسانی پیام (Signal transduction) مورد استفاده، حسگرهای ایمنی سه نوع هستند: پیزوالکتریک (Piezoelectric)، اپتیکال (Optical) و الکتروشیمیایی.
حسگرهای ایمنی الکتروشیمیایی
این دستگاهها از آنتیبادیهای اضافهشده در یک لایه تشخیص زیستی (Biorecognition) برای تولید سیگنالهای الکترواکتیو (Electroactive) استفاده میکنند که توسط مبدلها قابل شناسایی هستند و در نتیجه سیگنالهای قابل اندازهگیری تولید میشوند. آنالیز آفلاتوکسین را میتوان با استفاده از انواع مختلفی از حسگرهای ایمنی الکتروشیمیایی انجام داد.
رایجترین نوع آن شامل آنتیبادیهایی است که روی سطح الکترود کربن شیشهای تثبیت شدهاند و یک آنزیم که یک جزء بیولوژیکی مورد استفاده است. با این حال، همچنین امکان ساخت حسگرهای ایمنی الکتروشیمیایی غیر آنزیمی با استفاده از کیتوزان (Chitosan)، ذرات طلا، ضد آفلاتوکسین B1 و Fe3O4 به عنوان الکترود وجود دارد.
حسگرهای ایمنی اپتیکال
رزونانس پلاسمون سطحی (Surface plasmon resonance (SPR)) یک حسگر ایمنی اپتیکال است که برای شناسایی آفلاتوکسینها استفاده میشود. این شناسایی به اندازه گیری ضریب شکست تولید شده پس از اتصال آنالیت با شریک زیست اختصاصی آن (آنتیبادیهای اختصاصی) که در سطح حسگر تثبیت شده است، بستگی دارد.
این روش در AFB1 شناسایی شده با استفاده از آنتیبادیهای مونوکلونال (Monoclonal) یا پلیکلونال (Polyclonal) مربوط به AFB1 استفاده میشود. OWLS (طیفسنجی حالت نوری موجبر اپتیکال (Optical waveguide light-mode spectroscopy)) یکی دیگر از حسگرهای زیستی بدون برچسب است که برای اندازهگیری رویدادهای اتصال در سطح موجبر به تحریک فلورسانس متکی است. OWLS آفلاتوکسینها و اکراتوکسینها (Ochratoxin) را شناسایی میکند. محدوده تشخیص بین 0.5 تا 10 نانوگرم در میلیلیتر در آرد گندم و جو است.
QCMهای (میکروبالانسهای کریستال کوارتز) پیزوالکتریک

این دستگاهها، دستگاههای بدون برچسب هستند که در شناسایی آنتیژنها استفاده میشوند و به تغییر جرم الکترود در هنگام واکنش آنتیژنها با آنتیبادی تثبیت شده در سطح کریستال کوارتز بستگی دارند. تفاوت جرم متناسب با غلظت کمپلکس آنتیبادی-آنتیژن است. سنسور QCM برای شناسایی آفلاتوکسین B1 در محدوده 0.5 تا 10 ppb، با طلا پوشانده شده است.
همچنین بخوانید:
- تکنیک الایزا و انواع آن
- طیف سنجی مادون قرمز (Infrared Spectroscopy): تعریف، اصول، تجهیزات و موارد استفاده
- کروماتوگرافی گازی (Gas Chromatography): تعریف، اصول، اجزا، مراحل و موارد استفاده
- کروماتوگرافی مایع با عملکرد بالا (HPLC) چیست؟
- کروماتوگرافی لایه نازک (Thin Layer Chromatography): اصول، اجزا، مراحل و موارد استفاده
مترجم: صادق حسینیکیا




اگر سم آفلاتوکسین وارد بدن شد آیا روشی هست که مقدار آن تست شود و دارویی یا چیزی هست که بتوان این سم را از بدن پاکسازی کرد و از بین برد
اگر آفلاتوکسین وارد بدن شود:
🔹 آزمایش تشخیص:
– Aflatoxin M1 در ادرار
– Aflatoxin B1–albumin در خون
(در ایران بهندرت انجام میشود)
🔹 پاکسازی و درمان حمایتی:
– سیلیمارین (خار مریم) برای محافظت کبد
– NAC (N-acetylcysteine) سمزدا و آنتیاکسیدان
– ویتامین C و E برای کاهش آسیب اکسیداتیو
– نوشیدن زیاد آب و مصرف میوهها و سبزیجات تازه
🔹 زغال فعال: فقط در چند ساعت اول مصرف موثر است.
🔹 اگر علائم کبدی مثل تهوع، زردی یا درد شکم دارید → فوراً به پزشک مراجعه کنید.
درود.آیا برای تست آفلاتوکسین میشود از دستگاه vicam استفاده کرد؟
✅ بله، دستگاه VICAM یکی از روشهای استاندارد و قابل اعتماد برای اندازهگیری آفلاتوکسین است.
✅ مناسب برای صنایع غذایی، کشاورزی و آزمایشگاههای کنترل کیفیت.
✅ سرعت بالا، دقت قابل قبول و تأییدیههای بینالمللی از مزایای این روش هستند.
من چطوری می تونم درصدر آفلاتوکسین محصول را آزمایش کنیم.شما انجام میدین
در ادامه، روشهایی برای آزمایش میزان آفلاتوکسین در محصولات ارائه شده است:
1. نمونهبرداری
ابتدا باید نمونهبرداری دقیقی از محصول انجام شود. اهمیت دارد که نمونهبرداری به گونهای باشد که نماینده کل محموله یا مخزن باشد، زیرا آفلاتوکسینها ممکن است به طور نامنظم در محصول توزیع شده باشند.
2. آمادهسازی نمونه
نمونهها باید تحت فرآیندهایی مانند خرد کردن یا آسیاب کردن قرار گیرند تا همگن شوند. این کار موجب میشود که تستها دقیقتر و نتایج قابل اعتمادتر باشند.
3. استفاده از کیتهای تست آفلاتوکسین
کیتهای تجاری برای تست آفلاتوکسین در دسترس هستند که معمولاً شامل روشهای ELISA (آنزیم-لینکد ایمونوسوربنت آسی) یا تستهای سریع مبتنی بر فلوئورسانس هستند. این کیتها برای استفاده آسان طراحی شدهاند و میتوانند نتایج دقیقی را در زمان کوتاهی ارائه دهند.
4. کروماتوگرافی مایع با کارایی بالا (HPLC)
این روش یکی از دقیقترین روشها برای تعیین میزان آفلاتوکسین در نمونهها است. HPLC قادر است میزان آفلاتوکسینهای B1, B2, G1, و G2 را با دقت بالا اندازهگیری کند. این روش نیاز به تجهیزات پیچیده و دانش فنی دارد و معمولاً در آزمایشگاههای تخصصی انجام میشود.
5. تایید نتایج
برای اطمینان از دقت نتایج، ممکن است لازم باشد تستها چندین بار تکرار شوند و یا با استفاده از روشهای مختلف تایید شوند. همچنین، مقایسه نتایج با استانداردهای موجود و آستانههای قانونی اهمیت دارد.