دستهبندی نشده
بازدید از آزمایشگاه کشت سلول
بازدید از آزمایشگاه کشت سلول
آزمایشگاه های کشت سلول جانوری کمی متفاوت تر از آزمایشگاه های دیگر بوده و به دلیل حساسیت بالای سلول های جانوری، آزمایشگاه های کشت سلول عموما در سطوح بالاتر ایمنی قرار می گیرند. زمانی که سلول ها از یک بافت جانوری جدا می شوند، به دور از میزبان خود شرایط جدیدی برای رشد را تجربه خواهند کرد.
به عنوان مثال اگر یک تک سلولی مانند باکتری را در نظر گرفت، می توان آن را به عنوان یک موجود زنده کامل در نظر گرفت. به طوری که هر سلول باکتری به تنهایی یک موجود کامل را تشکیل داده و تمامی وظایف سلولی بر عهده همان باکتری می باشد. اما زمانی که یک بخشی از بافت خاص از یک موجود زنده پرسلولی جدا شده و سلول های آن کشت داده می شوند، شرایط فرق می کند. چرا که در موجودات پرسلولی در اثر تکوین هر بافت و اندامی وظایفی خاصی را بر عهده گرفته و مجموعا با همکاری یکدیگر یک سیستم زنده را شکل می دهند.
به عنوان مثال سیستم خون رسانی در پستانداران وظیفه رساندن مواد غذایی، اکسیژن و تأمین ایمنی را بر عهده دارند. لذا زمانی که بخشی از بافت یک جاندار پرسلولی جدا می شود از حساسیت بالایی برخوردار بوده و برای کشت آن باید شرایطی شبیه به بدن میزبان فراهم نمود. فراهم آوری چنین شرایطی موجب می گردد کشت سلول های جانوری و مخصوصا پستانداران کمی دشوار به نظر آید.
در راستای همین مسئله، سیستم های اتاق کشت جدا از مجموعه آزمایشگاهی ساخته شده و در بخش ورودی واجد Clean Room می باشند. افراد قبل از ورود به اتاق کشت از اتاق تمیز (Clean Room) عبور کرده و پس از تعویض روپوش خود، همچنین استفاده از کلاه مخصوص و دستکش وارد اتاق کشت شده و مشغول به کار می شوند.
همچنین جهت جلوگیری از بوجود آمدن انواع آلودگی ها الکل کشی به کررات در اتاق کشت انجام می شود. اتاق کشت آزمایشگاه ژنیران براساس اصول تأیید شده جهانی اتاق های کشت، ساخته شده و تمام اصول ایمنی مربوطه در آن رعایت می گردد. کارآموزان دوره کشت سلول، در ابتدای دوره با سیستم اتاق کشت آزمایشگاه ژنیران آشنا شده و از ابزار و تجهیزات مورد استفاده بازدید می کنند.
همچنین ظروف مخصوص کشت سلول جانوری را مشاهده کرده و به بررسی سلول های از قبل کشت داده شده درون فلاسک های مخصوص کشت سلول زیر میکروسکوپ اینورت فلوئورسنت می پردازند.
آشنایی با انواع محیط های کشت، سرم ها، supplements و آنتی بیوتیک ها
آشنایی با انواع محیط های کشت :
در سیستم کشت سلول های جانوری، به دلیل کشت سلول های جدا شده از یک میزبان پرسلولی، به وجود آوردن شرایط یکسان با هومئوستازی میزبان بسیار حائز اهمیت می باشد. باید توجه داشت که در پستانداران سیستم گوارشی با هضم مواد غذایی کمپلکس، ترکیبات ساده قابل جذب برای سلول ها فراهم کرده و توسط سیستم گردش خون این ترکیبات را در سراسر بدن در معرض سلول ها قرار می دهد.
محیط کشت کامل مخصوص سلول های جانوری عموماً از بخش های ثابتی تشکیل شده است. دو بخش عمده تشکیل دهنده یک محیط کشت کامل، محیط کشت پایه (Basal Media) و سرم می باشد. برخی اوقات برای رشد رده های سلولی خاص، مواد مغذی (Supplements) مخصوصی مورد نیاز است.
محیط کشت پایه (Basal Media) محیطی را فراهم می آورد تا سلول ها بتوانند درون آن محیط و در pH مناسب رشد کنند. انواع محیط های پایه نسبت به ترکیباتی که دربر می گیرند با هم تفاوت داشته و برای کشت هر رده سلولی انواع خاصی از آن به کار گرفته می شود. همچنین محیط کشت پایه جهت ثابت نگه داشتن pH شامل یک سیستم بافری بوده و همچنین معرفی رنگی فنول رد (Phenol Red) جهت نشان دادن تغییرات pH در آن وجود دارد.
سیستم بافری محیط کشت پایه جهت حفظ تعادل نیاز به حضور کربن دی اکسید کربن داشته و به کمک آن سیستم کربنات/بیکربنات را شکل می دهند. همانطور که مشخص است سلول ها به واسطه متابولیسم خود با تولید پروتون محیط را اسیدی کرده و تحت چنین شرایطی مولکول های بیکربنات حاصل گشته از سیستم بافری محیط کشت پایه و کربن دی اکسید، با پروتون ایجاد شده واکنش داده و اسید کربنیک بوجود می آورند. اسید کربنیک نیز به راحتی تجزیه شده و به مولکول های آب و دی اکسید کربن تبدیل می شود.
سرم ها نیز مخلوطی از انواع مواد غذایی مانند پروتئین ها، ویتامین ها و فاکتور های رشد می باشد. عموماً در کشت سلول های جانوری از سرم جنین گاوی (FBS) استفاده می شود. سرم جنین گاوی (FBS)نسبت به سایر سرم ها غنی تر بوده و فاکتور های رشد بیشتری را شامل می شود. البته از طرفی سرم جنین گاوی (FBS) ایمونوگلوبین های کمتری را در خود دارد.
سرم نیز به نوبه خود سیستم بافری محیط کشت پایه را تقویت نموده و از تغییرات pH جلوگیری می کند. مواد مغذی (Supplements) نیز در شرایط خاصی مورد استفاده قرار می گیرد. برخی اوقات رده های سلولی خاص جهت رشد علاوه بر ترکیبات و مواد غذایی موجود در محیط کشت پایه و سرم، نیاز به ترکیبات خاصی دارد که درون محیط کشت کامل وجود ندارد. در چنین مواردی بسته به ماده مغذی مورد نیاز، تهیه شده و به محیط کشت کامل اضافه می گردد.
باید توجه داشت که سیستم محافظتی در بدن پستانداران توسط سلول های ایمنی خون حاصل گشته و در کشت سلول های پستانداران دیگر سیستم ایمنی به جهت محافظت از سلول ها وجود ندارد! لذا علاوه بر بالابردن سطح ایمنی اتاق کشت، باید شرایط دیگری فراهم نمود تا احتمال آلودگی سلول ها توسط پروکاریوت ها و یوکاریوت های میکروسکوپی به حداقل برسد.
بدین جهت آنتی بیوتیک های مناسب به محیط کشت کامل اضافه می شود. البته باید توجه کرد آنتی بیوتیک خود به تنهایی در غلظت های بالا موجب کاهش رشد سلول های جانوری شود. لذا باید در تهیه محیط کشت کامل به همراه آنتی بیوتیک، به غلظت آن درون محیط کشت توجه ویژه نمود.
برای یادگیری کامل آشنایی با انواع محیط های کشت و همچنین تئوری و عملی کشت سلولی اینجا کلیک کنید.
Cryopreservation: An Overview of Principles and Cell-Specific Considerations
انجماد یا فریز: مروری بر اصول و ملاحظات خاص سلول
منشا تحقیقات ذخیره سازی بافت در دمای پایین به اواخر دهه 1800 برمیگردد. بیش از نیم قرن بعد، مشخص شد که تنش اسمزی عامل اصلی مرگ سلولی در طول انجماد است. در نتیجه، افزودن عوامل انجمادی (CPAs یا cryoprotective agents) مانند دیمتیلسولفوکسید (DMSO)، گلیسرول (GLY)، اتیلنگلیکول(EG)، یا پروپیلنگلیکول(PG) اگرچه برای سلولها در غلظتهای بالا سمی است، به عنوان یک مرحله ضروری برای محافظت در برابر مرگ سلولی در طول انجماد شناخته شد.
علاوه بر تنش اسمزی، سرعت سرد شدن و ذوب نیز تأثیر قابل توجهی بر بقای سلول در طول ذخیره سازی در دمای پایین دارد. به طور کلی، حفظ موفقیت آمیز سلول در دمای پایین شامل: افزودن یک CPA (معمولاً 10% تا 5% DMSO) به تنهایی یا در ترکیب با عوامل نفوذ کننده یا غیر نفوذکننده، نرخ کاهش دما (تقریباً 1 درجه سانتیگراد در دقیقه)، و ذخیره سازی در مایع نیتروژن یا فاز بخار مایع نیتروژن است. علاوه بر ملاحظات کلی، توصیههای اختصاصی برای سلولهای کبدی، جزایر پانکراس، اسپرم، تخمکها و سلولهای بنیادی باید برای به حداکثر رساندن بازده رعایت شود.
برای مثال، کاهش دما سریع با نتایج انجماد بهتر برای تخمکها، جزایر پانکراس و سلولهای بنیادی جنینی همراه است در حالی که کاهش دما آهسته برای انجماد سلولهای کبدی، سلولهای بنیادی خونساز و سلولهای بنیادی مزانشیمی توصیه میشود. با اجرای مراحل اضافی قبل از کرایو مانند: از قبل انکوبه کردن با گلوکز و آنتی اکسیدانها، کپسوله کردن آلژینات، و انتخاب سلولها در محدوده سنی و توانایی عملکردی بهینه، بازده را میتوان بیشتر کرد. در نهایت، سنجش زندهمانی و عملکردی، مراحل حیاتی در تعیین کیفیت سلولها پس از ذوب و بهبود کارایی روشهای انجماد فعلی هستند.
منشا تحقیقات ذخیرهسازی بافت در دمای پایین به اواخر دهه 1800 برمیگردد. از آن زمان، پیشرفتهای متعددی در رابطه با حفظ انجماد انجامشدهاست و بهینهسازی پروتکل همچنان یک حوزه تحقیقاتی فعال است. انجماد اجازه میدهد تا تعداد زیادی از سلولها و بافتها را که میتوان برای تحقیقات علمی و کاربردهای پزشکی از جمله پیوند سلولهای کبدی و جزایر پانکراس، انتقال خون، پیوند مغز استخوان، لقاح مصنوعی، و لقاح آزمایشگاهی مورد استفاده قرار داد را ذخیرهسازی کرد.
با این حال، برای موفقیتآمیز بودن این روشهای درمانی، مقادیر زیادی از نوع سلول موردنظر باید در حالت آمادهباش نگه داشته شود و برای استفاده در صورت تقاضا دردسترس باشد که از طریق فرآیند انجماد امکانپذیر میشود.
تاریخچه انجماد(Cryopreservation)
پس از کشف میکروسکوپ، اسپالانزانی(Spallanzani) در سال 1776 مشاهده کرد که اسپرم میتواند تحرک خود را حتی در شرایط دمای سرد حفظ کند. تحقیقات در مورد اثرات انجماد بر بافت زنده ریشه در اواخر دهه 1800 داشت، زمانی که دانشمندان از این فناوری برای حفظ اسپرم و سلولهای خونی قرمز(RBCs) استفاده کردند.
در این مدت، تحقیقات نقاط ضعفی را در این فرآیند نشان داد که باعث نتایج متناقض و ناباروری مکرر ناشی از مرگ زودهنگام جنینی شد. در دهه 1950 زمانی که جیمز لاولاک (James Lovelock) کشف کرد که فرآیند انجماد با انجماد فوری مایع که مستقیماً به تشکیل کریستالهای یخ در RBC کمک میکند، باعث ایجاد استرس اسمزی در سلول میشود، پیشرفتی رخ داد.
در سال 1963، مازور(Mazur) توانست این فرآیند را مشخص کندکه سرعت تغییر دما در یک محیط حاوی سلول، حرکت آب را در طول غشای سلولی و در نتیجه درجه انجماد درون سلولی را کنترل میکند. این با هم به بهبود درک کلی مکانیسم مرتبط با فرآیند محافظت در برابر سرما کمک کرد. در طول دهه 1980، تحقیقات پیرامون فرآیند انجماد نشان داد که سرعتی که در آن فرآیند انجماد و ذوب رخ میدهد، مهمترین عامل در تعیین بقای سلولها است.
نشان داده شد که افزایشهای کوچک و آهسته در هر دو فرآیند انجماد و ذوب از تشکیل سریع کریستالهای یخ جلوگیری میکند که املاح متصل به غشاء و مرتبط با مرگ زودرس سلول را افزایش میدهد. یکی دیگر از پیشرفتهای اولیه در انجماد در اواخر دهه 1940 رخ داد، زمانیکه محققان دریافتند که استفاده از گلیسرول به عنوان یک محیط، بقای اسپرم را در دمای زیر انجماد (70- درجه سانتیگراد) افزایش میدهد.
گلیسرول به عنوان یک محیط، به طور موثری برای محافظت از سلولها در برابر تشکیل سریع کریستال یخ در طول فرآیند نگهداری عمل کرد. یک عامل دیگر محافظ سرمایی که در حال حاضر استفاده میشود دیمتیلسولفوکسید (DMSO) است که قبل از فرآیند انجماد به محیط سلولی اضافه میشود.DMSO هنگامی که به محیط سلولی، معمولاً در غلظت 2 مولار اضافه میشود،
تخلخل غشای سلولی را افزایش میدهد، که به آب اجازه میدهد آزادانهتر از طریق غشاء جریان یابد. علاوه بر این، مانند گلیسرول، DMSO نیز با افزایش غلظت املاح درون سلولی، به جلوگیری از تشکیل کریستالهای آب کمک میکند و در نتیجه به انجماد آب در دماهای پایین کمک میکند.
اصول انجماد
به منظور درک کامل نقش عوامل محافظتکننده در برابر سرما (CPAs) ابتدا باید اثرات دماهای زیر صفر بر بافت سالم را درک کنیم. قراردادن سلولها در دمای کمتر از 0 درجه سانتیگراد بدون کمک محافظ انجمادها معمولاً کشنده است. از آنجایی که آب تقریباً 80 درصد از توده بافت را تشکیل میدهد، انجماد آب، چه درون و چه خارج سلولی، بیشترین تأثیر را بر تغییرات مضر بیوشیمیایی و ساختاری دارد که تصور میشود منجر به آسیب انجماد محافظت نشده شود. دو نظریه مستقل وجود دارد که تلاش میکنند اثرات مضر انجماد را بر سلولها توضیح دهند:
(1) کریستالهای یخ به طور مکانیکی یکپارچگی غشاهای سلولی را مختل میکنند و بنابراین دستیابی به سلولهای سالم از لحاظ ساختاری پس از ذوبشدن یا دیفریز را غیرممکن میسازند.
(2) افزایشی کشنده در غلظت املاح در فاز مایع باقیمانده رخ میدهد زیرا بلورهای یخ در داخل سلول در طول کاهش دما تشکیل میشوند. چه اثرات مکانیکی یا اسمزی انجماد غالب باشد، نتیجه نهایی یکسان است. کاهش دما و ذوب بدون محافظت سلولها فرآیندی ناسازگار با زندگی است. برای کاهش این اثرات، دو اقدام حفاظتی باید انجام شود: استفاده از یک محافظ برودتی، و انتخاب سرعت کاهش دما و ذوب مناسب.
عوامل نفوذ کننده (Permeating Agents)
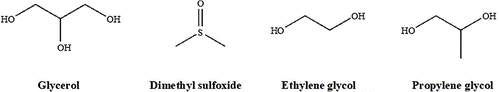
تعدادی از عوامل نفوذ کننده (PAs) در حال حاضر وجود دارند مانند گلیسرول (اولین عامل کشف شده)، دی متیل سولفوکسید (DMSO) اتیلن گلیکول (EG) و پروپاندیول (پروپیلن گلیکول). توانایی هر یک از این ترکیبات برای محافظت از سلول در برابر اثرات مکانیکی و اسمزی انجماد به چندین ویژگی بستگی دارد. عوامل نفوذ کننده باید در دماهای پایین بسیار محلول در آب باشند، بتوانند به راحتی از غشاهای بیولوژیکی عبور کنند و در حالت ایدهآل، حداقل سمی باشند.
ساختار چهار عامل نفوذکننده رایج از 100 مورد که شناخته شدهاند در (شکل 1) نشان داده شده است. اندازه نسبتا کوچک آنها (معمولاً کمتر از 100 دالتون) و ماهیت تا حدی آمفیفیلیک آنها اجازه میدهد تا به راحتی به غشای سلولی نفوذ کنند جایی که میتوانند اثرات خود را اعمال کنند. توانایی سازهها در پیوند هیدروژنی با آب، بخش بزرگی از اثرات محافظتی آنها را تشکیل میدهد.
به طور معمول، با یخ زدن آب، ساختار بلوری در حال گسترش، مانع تشکیل املاح به فرم شبکهای میشود. املاح به فاز مایع در حال کاهش منتقل میشوند که به طور موثر غلظت املاح را به سطوح کشنده در سلول افزایش میدهد. از آنجایی که عوامل نفوذکننده از طریق پیوند هیدروژنی با آب برهمکنش قوی دارند، نقطه انجماد آب کاهش مییابد و مولکولهای آب کمتری برای برهمکنش با خودشان برای تشکیل هستههای حیاتی مورد نیاز برای تشکیل کریستال دردسترس هستند.
تشکیل آب جامد با ساختار نامنظم و بیشکل به عنوان انجماد شناخته میشود و با استفاده از یک محافظ برودتی همراه با سرعت کاهش دما مناسب حاصل میشود. برای به حداقل رساندن سمیت، مخلوطی از هر دو عامل نفوذکننده و غیرنفوذکننده اغلب به صورت مرحلهای در دمای نزدیک به صفر درجه سانتیگراد اضافه میشوند. بنابراین، افزودن عوامل نفوذ کننده در این شرایط امکان ذخیره موفقیت آمیز سلولها را در فاز جامد در دمای فوقالعاده پایین موردنیاز برای توقف فرآیندهای بیوشیمیایی بدون تشکیل یخ فراهم میکند.
شکل 1. چهار محافظ متداول در برابر سرما: گلیسرول (GLY) دی متیل سولفوکسید (DMSO) اتیلن گلیکول (EG) و پروپیلن گلیکول (PG).
علاوه بر اجازه انجماد، برخی از PAها مانند DMSO تصور میشود که نفوذپذیری سلولی را با تأثیرگذاری بر دینامیک غشاء به روشی وابسته به غلظت افزایش میدهند. در غلظتهای پایین (5%)، شواهد نشان میدهد که DMSO ضخامت غشا را کاهش میدهد و به نوبه خود، نفوذپذیری غشا را افزایش میدهد. در غلظتهای رایج (10%)، تشکیل منافذ آب در غشاهای بیولوژیکی القا میشود.
تشکیل منافذ میتواند سودمند باشد زیرا آب درونسلولی را میتوان به آسانی با محافظهایی که باعث افزایش انجماد میشوند جایگزین کرد. با این حال، در غلظتهای سمی بالاتر (40%)، دولایههای لیپیدی شروع به تجزیه شدن میکنند. بدیهی است که انتخاب یک غلظت مناسب برای محافظت از سرما برای یکپارچگی ساختاری و در نتیجه زندهمانی سلولها پس از انجماد حیاتی است.
عوامل غیر نفوذکننده (Non-permeating agents)
دسته دوم از انجمادها، عوامل غیرتراوا یا غیرنفوذکننده(NPAs) هستند. همانطور که از نام آن پیداست، آنها به داخل سلول نفوذ نمیکنند و بنابراین تأثیر محافظتی خود را در خارج از سلول اعمال میکنند. آنها معمولاً بزرگتر هستند و به صورت کووالانسی به عنوان پلیمر، دایمر یا تریمر به هم متصل میشوند. برخی از عوامل رایج در این کلاس عبارتند از: پلیاتیلنگلیکول (PEG) پلیوینیلپیرولیدون (PVP)، رافینوز، ساکارز و ترهالوز. عوامل غیرتراوا با همان مکانیسم عوامل نفوذکننده اما خارج سلولی و به میزان کمتری انجماد را القا میکنند.
ترهالوز: ساختار و پیامدهای منحصر به فرد
برخلاف پلیمرهای غیرتراوا، CPA های دیساکارید به طور طبیعی وجود دارند. ترهالوز، یک قند کمتر شناخته شده، توسط ارگانیسمهای مختلف از جمله باکتریها، قارچها، مخمرها، حشرات، گیاهان و برخی از بیمهرگان تولید میشود. اگرچه عملکردهای زیادی دارد، اما ثابت شدهاست که به عنوان وسیلهای برای مقاومت در برابر انجماد در این موجودات عمل میکند.
ساختار ترهالوز خواص مفیدی به آن میدهد. این یک دایمر گلوکز است که از طریق یک پیوند α-1,1-glycosidic متصل شده است. پیوند استالی آن از کاهش C-1 در هر مونومر جلوگیری میکند که باعث افزایش پایداری آن در دماهای شدید و کاهش حساسیت آن به هیدرولیز اسید در شرایط pH پایین میشود. ساختار ترهالوز در شکل 2 نشان داده شده است: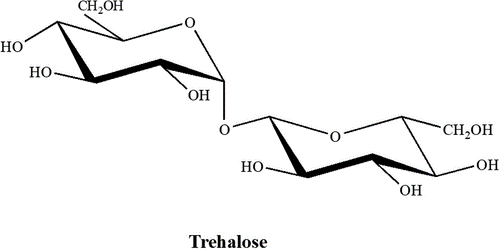
شکل 2. دی ساکارید ترهالوز طبیعی. پیوند منحصر به فرد α-1,1-glycosidic از هیدرولیز C-1 جلوگیری میکند و پایداری را در شرایط دمایی و شرایط pH پایین افزایش میدهد.
ترکیب هر دو عامل
هر دو عامل نفوذکننده و غیرتراوا میتوانند در غلظتهای بالاتر برای سلولها سمی باشند، اگرچه عوامل غیرتراوا در درجه پایینتری نسبت به نفوذکنندهها سمی هستند. این ویژگی نامطلوب CPA ها باعث افزایش مرگ سلولی و کاهش زندهمانی میشود. از آنجایی که هم PAها و هم NPAها مکانیسم انجماد یکسانی دارند، میتوان عوامل غیرتراوا را به محلول اضافه کرد تا یه ترکیب محافظ انجمادی موفق اما با غلظتهای پایینتر از عوامل نفوذکننده، فراهم شود.
این مزیت باعث کاهش سمیت ناشی از PA و افزایش زندهمانی سلولی پس از ذوب است. روش دیگری که کاهش سمیت ناشی از CPA را نشان داد توسط Kojayan و همکارانش بود که در آن ترکیبات چند مولاری از غلظتهای کاهشیافته EG و DMSO برای انجماد سلولهای انسان و موش استفاده شد. آنها پیشنهاد کردند که کاهش اثرات نامطلوب احتمالاً به دلیل کاهش قرارگرفتن در معرض هر یک از CPA است، اگرچه اسمولالیته کلی ترکیبات مختلف با یک محلول استاندارد مولار 2 از DMSO قابل مقایسه بود.
مطالعات دیگر نشاندادهاند که ترکیبی از ساکارز، پروپاندیول و DMSO در حمایت از بقای بلاستوسیستهای خوک پس از گرم شدن مؤثر است. اگرچه استفاده مجزا از EG و DMSO از اواسط دهه 1900 الگویی در انجماد بوده است، تحقیقات جدیدتر نشان میدهد که ترکیبی از این و سایر CPAها بالاترین قابلیت زندهمانی سلولی را پس از انجماد ارائه میدهد.
نرخ های کاهش دما و ذوب کردن
دومین اقدامی که باید در طول فرآیند انجماد انجام شود، انتخاب نرخ کاهش دما و ذوب شدن است. از آنجایی که موفقیت محافظت در برابر سرما به اجتناب از تشکیل یخ درون سلولی بستگی دارد، باید توجه دقیقی به حرکت آب در طول غشاها در طول این فرآیند صورت گیرد. Mazur وابستگی بقا به سرعت کاهش دما سلول های مختلف را نشان داد. به طور خاص، او شواهدی ارائه کرد مبنی بر اینکه سرعت کاهش دما، متناسب با احتمال تشکیل یخ درون سلولی است و بنابراین با بقای آن نسبت معکوس دارد.
برای کاهش احتمال تشکیل یخ درون سلولی، با کاهش دمای سلول، آب باید از سلول خارج شود. نیروی محرکه مسئول حرکت آب به بیرون، اختلاف فشار ناشی از کاهش دمای بسیار زیاد آب درون سلولی است. این آب زیر صفر درجه سانتیگراد در فاز مایع باقی میماند؛ پدیدهای که با کاهش نقطه انجماد ناشی از حضور CPA ها افزایش مییابد. آب خیلی سرد در سیتوپلاسم دارای فشار بخار نسبتاً بالایی در مقایسه با آب در محیط خارجی است. اختلاف فشار حاصله باعث حرکت خالص آب به خارج از سلول میشود و باعث دهیدراته شدن میشود.
یک اختلاف فشار برای حرکت آب ضروری است، اما این تنها عامل دخیل نیست. مقدار آب باقیمانده در سلول در زمان انجماد تحت تأثیر سرعت خروج آب در مرحله کاهش دما است. سه متغیری که بر این سرعت تأثیر میگذارند عبارتند از، نسبت سطح سلول به حجم (SA: V) نفوذپذیری غشاء به آب و سرعت خنکشدن.
SA: V تابعی از اندازه ذاتی یک سلول است و قابل تغییر نیست. با این حال، مهم است که اذعان کنیم، پیامدهای مهمی وجود دارد. یعنی دهیدراته شدن سلولهای بزرگتر در مقایسه با دهیدراته شدن سلولهای کوچکتر ذاتاً کند است. با توجه به این موضوع، تنظیمات در طول انجماد باید بر اساس اندازه سلول در نظر گرفته شود تا اجازه خروج حجم کافی از آب قبل از انجماد را بدهد. برای جبران اندازه سلولهای بزرگ، به عنوان مثال در سلولهای کبدی که قطر آنها 30-20 میکرومتر است، دو متغیر باقیمانده را میتوان تغییرداد.
ابتدا، همانطورکه قبلاً در مورد آن صحبت شد، میتوان نفوذپذیری غشاء را با افزودن برخی از عوامل انجمادی نفوذی مانند DMSO افزایش داد. دوم، سرعت کاهش دما را میتوان کاهش داد. رابطه بین کم آبی و سرعت کاهش دما کمتر مشهود است اما با این وجود حیاتی است. با کاهش دما، انرژی جنبشی درون سلولی نیز کاهش مییابد. کاهش دما سریع، زمان کافی را برای خروج آب قبل از وقوع انجماد باقی نمیگذارد، بنابراین محتوای آب درون سلولی بالا باقی میماند و احتمال کریستالیزاسیون بیشتر است.
برای اطمینان از حداکثر بقا، سرعت کاهش دما تقریباً ۱ درجه سانتیگراد در دقیقه معمولاً برای اکثر سلولها به جز سلولهای بسیار بزرگ مناسب است. این فعل معمولاً با استفاده از فریزرهایی با نرخ کنترل شده به دست میآید که دمای محفظه را از طریق برنامه های کاهش دما پیچیده تعدیل میکنند تا oC/min1 افت ثابت محتوای ویال را حفظ کنند. پس از انجماد یا فریز موفقیت آمیز، انتظار میرود که سلولها برای استفاده بعدی ذخیره و ذوب شوند.
با این حال، در مقایسه با کاهش دما، به شرایط ذخیرهسازی و ذوب سلولی یا دیفریز توجه کمتری شده است. حدس و گمان در مورد اینکه چرا این مورد منجر به چندین نتیجه ممکن میشود: تئوری پیرامون شرایط ذخیرهسازی و سرعت ذوب در حال حاضر به خوبی در جامعه علمی جاافتادهاست، و انتظار میرود که سلولهای اولیه به مدت طولانی در دمای 140- تا 196- درجه سانتیگراد ذخیره شوند. همچنین ذکر این نکته مهم است که نوع ذخیرهسازی میتواند بر سلامت و بازیابی سلول تأثیر بگذارد.
به عنوان مثال، ذخیره سلولهای کبدی اولیه در فاز بخار مخزن LN2 (نیتروژن مایع) در دمای 140- درجه سانتیگراد نسبت به مخازن استاندارد LN2 مایع در دمای 196- درجه سانتیگراد ترجیح داده میشود. نشان داده شده است که ذخیرهسازی فاز بخار LN2 امکان بازیابی بسیار بیشتر سلولهای کبدی زنده را فراهم میکند و عملکرد متابولیک کبد را حفظ میکند.
ذوب و گرم شدن سلولها به اندازه کاهش دما در فریز نقش حیاتی ندارد. تئوری رایج این است که سلولها باید به سرعت گرم شوند تا از ایجاد کریستال یخ جلوگیری شود. منطق این ایده براساس اصول ترمودینامیکی است و به شرح زیر است: آب منجمدشده در حالت انرژی بالاتر در مقایسه با شکل کریستال آن وجود دارد.
این فقط شبه پایدار است و بنابراین میتواند خود را به یک ساختار کریستالی با ثباتتر و کمانرژی در طول ذوب مجددا بازآرایی کند. با این حال، هنگام اندازهگیری تأثیر سرعت گرم شدن بر زندهمانی، مهم است که به یاد داشته باشید که دو مرحله همیشه قبل از ذوب شدن است: افزودن مواد محافظ انجماد و متعاقباً سرعت کاهش دما سلولها.
هر دوی اینها تأثیر قابل توجهی بر زندهمانی دارند و میتوانند بقای سلولها پس از گرمشدن را مخدوش کنند. با این وجود، پروتکلهای پذیرفته شده فعلی پیشنهاد میکنند که کریوویالها روی بخار LN2 (نه روی یخ یا یخ خشک) به آزمایشگاه منتقل شوند و به سرعت در حمام آب 37 درجه سانتیگراد به مدت 90 تا 120 ثانیه گرم شوند تا حداکثر زندهمانی حاصل شود.
این عمل به یک نرخ تقریبی گرمایش 45-70 درجه سانتیگراد در دقیقه، بین 140- درجه سانتیگراد و صفر درجه سانتیگراد ترجمه میشود، اگرچه نرخ گرمشدن به دلیل ماهیت غیرخطی آن در خارج از این دامنه و کم و بیش سریع است. با این حال، حداقل یک مطالعه، شواهدی را ارائه کرد که نشان میدهد گرم شدن سلولها در هر نقطه بین 2 درجه سانتیگراد در دقیقه تا 100 درجه سانتیگراد در دقیقه، هیچ تأثیری بر زندهمانی پس از ذوب ندارد.
اگر درست باشد، نمونهها را میتوان با سرعتهای آهستهتری مانند آنچه با ذوب در دمای هوا به دست میآید (6.2 ± 0.5 درجه سانتیگراد در دقیقه) ذوب کرد. با این رویکرد، زندهمانی نمونهها برابر با نمونههایی است که تحت پروتکلهای استفاده از حمام آب و ذوب سریع قرار میگیرند. با این حال، کاهش استفاده از حمام آب نیز مزیت بیشتری برای افزایش استریل بودن خواهد داشت زیرا آنها یکی از رایج ترین منابع آلودگی در آزمایشگاه هستند.
در نهایت، توجه به این نکته ضروری است که مهم نیست که سلولها چقدر خوب ذخیره میشوند یا چگونه ذوب میشوند؛ کاهش زندهمانی پس از ذوب اجتنابناپذیر است.
انجماد سلولهای کبدی، جزایر پانکراس، گامتها و سلولهای بنیادی
پاسخهای کرایوبیولوژیکی بسته به نوع سلول به دلیل تغییرات در ترکیب سلولی و بافتی میتواند بسیار متفاوت باشد. بنابراین، ویژگیهای بیوفیزیولوژیکی و بیولوژیکی اختصاصی سلول باید در طول انجماد در نظر گرفته شود تا بقای پس از کرایو برای هر نوع سلول به حداکثر برسد. بخشهای زیر ملاحظات انجماد اختصاصی سلول، از جمله سرعت کاهش دما و ذوب بهینه، و انتخاب CPA مناسب برای سلولهای کبدی، جزایر پانکراس، اسپرم، تخمکها و سلولهای بنیادی را مورد بحث قرار میدهند.
سلول های کبدی(Hepatocytes)
پیوند هپاتوسیت، که شامل تزریق سلولهای کبدی بالغ در سیستم پورتال گیرنده است، یک رویکرد درمانی جدید است که میتواند برای درمان انواع مختلف بیماریهای کبدی استفاده شود. انجماد هپاتوسیت یک مرحله حیاتی در این روش درمانی است زیرا اغلب یک تاخیر ضروری بین جداسازی سلول اولیه و فرآیند پیوند بیمار وجود دارد. علاوه بر این، اکثر بیماران به چندین پیوند سلولی در یک دوره طولانی نیاز دارند که بهینهسازی تکنیکهای انجماد برای کمک به حفظ عملکرد سلول مهمتر میشود.
عوامل متعددی بر نتایج انجماد تأثیر میگذارند، از جمله: کیفیت بافتی که سلولهای کبدی از آن مشتق شدهاند، خود روش استخراج، محیط نگهداری و نرخ انجماد/ذوب. کیفیت سلولهای کبدی تحت تأثیر وجود بافتهای استئاتوتیک یا سایر بافتهای بیمار و همچنین زمانهای ایسکمی طولانیمدت قرار میگیرد، که هر دو میتوانند کیفیت سلولهای کبدی استخراج شده را به خطر بیندازند. در مرحله بعد، روش استخراج سلولی خود میتواند استرس اکسیداتیو را القا کند که به نوبه خود بر نتایج انجماد تأثیر منفی میگذارد.
پیشنهاد شده است که قبل از انکوبهکردن در شرایط کشت معلق در محیطهای حاوی 2 میلی مولار Nاستیلسیستئین (یک آنتی اکسیدان) و 15 میلی مولار گلوکز میتواند پس از استخراج محافظت آنتیاکسیدانی ایجاد کند و نتایج پس از انجماد از جمله زندهمانی سلول را بهینه کند. محیط انجماد همچنین میتواند بر نتایج ذخیرهسازی تأثیر بگذارد و دانشگاه ویسکانسین (UW) در حال حاضر محیط استاندارد برای حفظ سلولهای کبدی در نظر گرفته میشود.
به عنوان جایگزینی برای محلول UW، محلول انجماد HypoThermosol (HTS) همراه با 10٪ DMSO در دمای 4 درجه سانتیگراد نشان داده شده است که زندهمانی سلولی بالا، عملکرد طولانی مدت هپاتوسیت و پاسخ با کیفیت خوب به سیتوکین پس از ذوب را ایجاد میکند. علاوه بر این، ترکیب NPA مانند ترهالوز و CPA مانند DMSO به طور قابل توجهی زندهمانی سلولهای کبدی انسان و موش را پس از ذوب افزایش میدهد.
نرخ ذوب و انجماد نیز نقش مهمی در تعیین نتیجه انجماد دارد. سرعت کاهش دما آهسته بهترین تکنیک برای انجماد سلولهای کبدی جدا شده بالغ است. در مطالعات مختلفی که از DMSO به عنوان CPA خود استفاده کردهاند، نرخهای کاهش دما مختلفی را پیشنهاد کردهاند که از0C/MIN 5- تا 1- تا 80- تا 40- درجه سانتیگراد در دقیقه قبل از ذخیرهسازی در دمای ºC 196 – در نیتروژن مایع متغیر است. ذوب سریع در دمای 37 درجه سانتیگراد برای جلوگیری از تشکیل یخ درون سلولی، به حداقل رساندن آسیب سلولی و افزایش زنده مانی پس از ذوب توصیه می شود.
پس از ذوب، ارزیابی قابلیت زندهمانی و عملکرد سلول های کبدی منجمد شده مهم است. اتصال سلولهای کبدی پس از ذوب به پلیت های پوشش داده شده با کلاژن، اندازهگیری سریع و کیفی زندهمانی سلولی را فراهم میکند و سنجشهایی مانند رنگ آمیزی تریپانبلو، آزادسازی لاکتاتدهیدروژناز، عملکرد میتوکندری و اندازهگیری نشانگرهای نکروزه یا آپوپتوز امکان ارزیابی کمی زندهمانی و عملکردی را میدهد.
سنجشهایی که عملکرد آنزیم CYP450 پس از ذوب را ارزیابی میکنند، مانند سنجشهای 7-ethoxyresorufin-O-deethylase و تستوسترون، و همچنین متابولیسم فاز II از طریق کونژوگاسیون رزوروفین نیز میتوانند مورد استفاده قرار گیرند. این سنجشها را میتوان برای تعیین اینکه آیا قابلیت های متابولیسم دارویی سلولهای کبدی پس از ذوب دست نخورده باقی میماند یا خیر استفاده کرد.
سلولهای کبدی برای افزایش بیشتر عملکرد و زنده مانی، همچنین میتوانند برای محافظت در برابر عوامل استرسزای مکانیکی در طول انجماد، کپسوله شوند. یک مطالعه، تفاوت معنیداری را بین زندهمانی قبل و بعد از انجماد زمانی که سلولهای کبدی انسان با میکروکپسولهای آلژینات/پلی-ال-لیزین کپسوله شدند گزارش نکرد. کپسوله کردن سلولهای کبدی همچنین محافظت در برابر دفاع ایمنی میزبان را ارائه میکند که یک ویژگی جذاب برای سلولهایی است که برای پیوند پس از انجماد قرار میگیرند.
جزایر پانکراس (Pancreatic islets)
پیوند جزایر یک درمان موثر برای درمان بیماران مبتلا به دیابت شیرین نوع I پیچیده است. پیشرفتهایی در استخراج و پیوند جزایر بالینی از زمان توسعه پروتکل ادمونتون در سال 2000 صورت گرفته است. گزارش شده است که پیوند جزایر بالینی میتواند انسولین را تا 5 سال پس از پیوند با حداقل عوارض ایجاد کند.
با این حال، در دسترسبودن محدود اهداکننده پانکراس و جزایر مناسب برای پیوند همچنان یک چالش باقیماندهاست. بانکداری انجمادی سلولهای پانکراس از اهداکنندگان متعدد امکان ذخیرهسازی طولانیمدت جزایر را فراهم میکند و به موضوع در دسترس بودن اهداکننده برای پیوند جزایر میپردازد. جزایر را میتوان در دمای 80- تا 196- درجه سانتیگراد با DMSO انجماد کرد.
نرخ انجماد و ذوب میتواند بر مورفولوژی و عملکرد جزایر تأثیر بگذارد. یک نرخ انجماد بهینه باید عملکرد و زندهمانی بالایی را فراهم کند و در عین حال مولکولهای تحریککننده ایمنی را پایین نگه دارد. فورمن(Foreman) و همکارانش گزارش دادند که انجماد سریع با سرعت 20 درجه سانتیگراد در دقیقه و 70 درجه سانتیگراد در دقیقه زمانی که جزایر در 1 مولار DMSO به مدت 30 دقیقه در دمای اتاق کشت داده شدند و به دنبال آن قرار گرفتن در معرض 2 مولار DSMO به مدت 10 دقیقه در دمای 0 درجه سانتیگراد، توانایی ترشح انسولین در سلول های جزایر پس از ذوب در شرایط آزمایشگاهی را بهبود بخشید.
پروتکلهای استاندارد فعلی ذوب جزایر شامل ذوب سریع در دمای 150-200 درجه سانتیگراد در دقیقه در حمام آب 37 درجه سانتیگراد است. شواهد نشان میدهد که قرارگرفتن در معرض 50٪ اکسیژن در طول فرآیند ذوب میتواند آسیب جزایر انسانی را کاهش دهد. گلیسرول یا DMSO را میتوان به عنوان CPA برای ذخیرهسازی طولانی مدت سلول های جزایر در دمای زیر صفر (معمولاً کمتر از 100- درجه سانتی گراد) استفاده کرد.
چاندراوانشی(Chandravanshi) استفاده از مکمل های دوکوزاهگزانوئیک اسید (DHA)، ایکوزاپنتانوئیک اسید (EPA) و متفورمین را پیشنهاد کرد که میتواند بازیابی جزایر بیشتری را از ذخیرهسازی 196- درجه سانتیگراد فراهم کند و امکان بانکداری مناسب جزایر را فراهم کند. علاوه بر انتخاب CPA ها و بهینه سازی نرخ انجماد و ذوب، روشهای دیگری برای بهبود نتایج انجماد جزایر توسعه داده شده است.
کپسوله کردن آلژینات جزایر قبل از انجماد نشان داده است که یک رویکرد امیدوارکننده برای پیوندهای آینده است. یک مطالعه نشان داد که در مقایسه با جزایر یخ زده کپسوله نشده، جزایر کپسوله شده در 1.75 درصد آلژینات، بقا و عملکرد بالاتری پس از ذوب و همچنین پاسخ پیوند بهبود یافته بهتری داشتند.
بقای جزایر پس از ذوب را میتوان با روشهای متعددی از جمله فلورسیندیاستات (FDA)، کلسین AM، یا رنگآمیزی SYTO Green به همراه رنگآمیزی یدیدپروپیدیوم (PI) یا رنگ اتیدیومبروماید (EtBr) ارزیابی کرد. علاوه بر این، آسیب پس از ذوب به سلامت کلی جزایر پایه میتواند از طریق کمیسازی رونوشتهای mRNA مبتنی بر PCR از جمله: HIF1A (فعالشده در شرایط هیپوکسیک)، SLC2A1 (انتقالدهنده GLUT1)، و ACTB (بتا اکتین/اسکلت سلولی) پایش شود.
اختلال در توانایی متابولیک و عملکرد جزایر را میتوان از طریق مقایسه دقیق میزان مصرف اکسیژن پس از ذوب (OCR) و تولید انسولین (GSIR) با سطوح پایه قبل از کرایو ارزیابیکرد. در نهایت، بهینهسازی پارامترهای انجماد میتواند شکاف بین پیوند از اهداکننده به گیرنده را کاهش دهد و پیوند بالینی سلولهای جزایر را برای درمان دیابت نوع I بیشتر پیش ببرد.
اسپرم
انجماد اسپرم یک روش موثر برای حفظ باروری در انسان است و به ویژه برای بیماران قبل از درمان سرطان و سایر پستانداران از جمله گونههای در معرض خطر مفید است. اسپرمها به قدری از این روش ذخیرهسازی پیروی میکنند که یک مطالعه گزارش داد که دستهای از سلولها که به مدت 21 سال نگهداری میشدند برای بارور کردن موفقیتآمیز یک تخمک که در نهایت منجر به تولد زنده میشد، استفاده شد.
نگهداری طولانی مدت این سلولها معمولا شامل گلیسرول و یا زرده تخم مرغ به عنوان CPA است و افزایش غلظت گلیسرول با سرعت کاهش دما ثابت باعث افزایش نرخ بقای اسپرم میشود. برای انجماد سلولهای اسپرم انسانی، سرعت خنکسازی اولیه ºC/min 0.5-1 هنگام انجماد سلولها از دمای اتاق تا ºC 5 توصیه میشود.
پس از آن، افزایش نرخ انجماد به 10 درجه سانتیگراد در دقیقه هنگام سرد شدن از 5 تا 80- درجه سانتیگراد برای به حداکثر رساندن انجماد اسپرم توصیه میشود. هنگام ذوب نمونهها، نرخهای 43.5 درجه سانتیگراد در دقیقه در هوای 20 درجه سانتیگراد یا 55.2 درجه سانتیگراد در دقیقه در هوای 35 درجه سانتیگراد روی سطح خشک پیشنهاد میشود تا منجر به زندهماندن و تحرک مطلوب اسپرم پس از ذوب شود.
به طورکلی، آسیب های رایج پس از ذوب اسپرم شامل کاهش یکپارچگی آکروزوم، تحرک، قابلیت لقاح، و کاهش کلی در زندهمانی بدون در نظر گرفتن گونه منشا میباشد. به طورخاص، اختلال کروماتین از طریق جابجایی های پروتامین، تکه تکه شدن DNA و ضایعات به ژنهای دخیل در قابلیت لقاح و رشد جنینی (ADD1، ARNT، PEG1/MEST، SNORD116/PWSAS) از پیامدهای شناخته شده فرآیند انجماد هستند.
اگرچه مکانیسم دقیق ناشناخته است، تصور میشود که استرس اکسیداتیو رایج در طول فرآیند کرایو باعث افزایش تکه تکه شدن DNA در اسپرم انسان میشود و در نتیجه منجر به کاهش بازده و زندهمانی نهایی میشود. Yeste و همکارانش مکمل محیط های انجمادی با ویتامین E، هیپوتورین یا سایر آنتی اکسیدانهای طبیعی برای کمک به کاهش اثرات اکسیداتیو را پیشنهاد کرده است. درحالی که تغییرات ژنتیکی ناشی از سرما در اسپرم مستند شده است، دادههای مربوط به تغییرات اپی ژنتیکی بالقوه ناشی از انجماد محدود است و نیاز به مطالعه بیشتر دارد.
علاوه بر این، تحرک و زندهمانی اسپرم قبل از کرایو میتواند به پیشبینی نتایج پس از ذوب و بقای سرما کمک کند. Degl’Innocenti و همکارانش این ویژگیها را در نمونه هایی از بیماران مبتلا به الیگواسپرمی، سرطان و سایر آسیب شناسیها ارزیابی کردند. آنها گزارش دادند که کمترین میزان بهبودی زمانی رخ میدهد که تعداد، تحرک و زندهمانی قبل از کرایو به کمتر از سطح پنجم سازمان جهانی بهداشت (WHO) برسد.
مقادیر مرجع صدک (39 × 106 اسپرم در هر انزال، تحرک کل: 40٪، تحرک پیشرونده: 32٪، و زندهمانی: 58٪). علاوه بر ویژگی ذاتی و کیفیت نمونه اسپرم، دوره نگهداری مایع اسپرم قبل از انجماد حیاتی است. برای تحرک مطلوب پس از ذوب، توصیه میشود که نمونه باید ظرف یک ساعت پس از انزال پردازش شود. عوامل دیگری که باید در نظر گرفته شوند عبارتند از تحرک اولیه اسپرم حداقل 55 درصد در یک ساعت پس از انزال با اکثر سلولها در حرکت رو به جلو، کمتر از 15 درصد کاهش در تحرک اسپرم و عدم کاهش قابل توجه حرکت رو به جلو 4 ساعت پس از انزال.
تخمک
انجماد تخمک یک روش قابل اعتماد برای حفظ باروری در زنانی است که تحت درمان برای شرایط پزشکی مانند سرطان یا بیماریهای خودایمنی هستند. درمان این بیماریها میتواند منجر به نارسایی تخمدان شود که نشان دهنده اهمیت حفظ باروری است. نگرانی های اخلاقی و قانونی در مورد انجماد جنین منجر به پیشرفتهای تحقیقاتی در انجماد تخمک در چند سال گذشته به عنوان یک رویکرد جایگزین شده است.
انجماد تخمکها استقلال را برای زنان فراهم میکند زیرا امکان حفظ باروری انتخابی را در مقایسه با حفظ جنین فراهم میکند. علاوه بر این، انجماد تخمک به زنانی که نگرانی در مورد کاهش باروری مرتبط با افزایش سن دارند، گزینهای برای به تاخیر انداختن بارداری را ارائه میدهد.
انجماد تخمکهای انسانی تقریباً به طور انحصاری در مرحله متافاز II انجام میشود، زمانی که بلوغ هستهای و سیتوپلاسمی کامل شده است. اندازه بزرگ، محتوای آب بالا و ترکیب درون سلولی منحصر به فرد تخمکها، انجماد را چالش برانگیز میکند، با این حال آسیب به دوکهای میوز، رشته های اکتین، و DNA علاوه بر پراکندگی کروموزوم، پلیمریزاسیون میکروتوبولی و افزایش نرخ پلیاسپرم از جمله چالشهای خاصی هستند که با حفظ تخمک ایجاد میشوند.
به نظر میرسد مانند اسپرم، تخمکها نیز به تغییرات اپیژنتیکی در نتیجه ذخیره سازی در دمای پایین حساس هستند، اگرچه تحقیقات در این زمینه ادامه دارد.
در حال حاضر دو رویکرد برای انجماد تخمک غالب است. آنها شامل کاهش دما آهسته (پروتکلهای انجمادی تعادلی) و انجماد سریع (سرد شدن فوق سریع یا پروتکلهای غیرتعادلی) میشوند. کاهش دما آهسته شامل دهیدراتهشدن تدریجی سلول با افزودن غلظتهای پایین یک عامل نفوذکننده مانند DMSO (معمولاً M 1.5) و یک عامل غیرنفوذکننده (معمولاً ساکارز یا ترهالوز، ≤ M 0.3) با سرعت کاهش دما آهسته کنترلشده است.
پس از سردشدن تا دمای 150- درجه سانتیگراد، سلولها در نیتروژن مایع در دمای 196- درجه سانتیگراد ذخیره میشوند تا زمانی که برای استفاده مورد نیاز باشند. بقای انجماد تخمکها با بهبود پروتکلهای کاهش دما آهسته، به ویژه با نقش غلظت ساکارز بیش از 0.1 مولار در طول دهیدراته شدن قبل از انجماد افزایش یافته است. با این حال، شواهد حاصل از تمرین گسترده نشان میدهد که نرخ بقا با این روش حدود 70 تا 80 درصد است.
با این حال، پروتکلهای منجمدسازی در حال حاضر بهترین روش برای انجماد تخمکها در نظر گرفته میشوند. رایجترین روش منجمدسازی شامل افزودن گام به گام CPAs در کرایومدیا است. در مرحله اول تعادل، تخمکها به مدت 5 تا 15 دقیقه به محلولی حاویv/v 7.5% از EG و v/v 7.5% از DMSO اضافه میشوند.
سپس سلولها در معرض محلول انجماد با v/v15% از EG و 15% v/v از DMSO، به اضافه 0.5 مولار ساکارز قرار میگیرند. پس از یک انکوباسیون کوتاه (≤ 1 دقیقه)، سلولها در نیتروژن مایع در دمای 196- درجه سانتیگراد ذخیره میشوند. گرمکردن باید به سرعت انجام شود تا از تشکیل کریستال یخ جلوگیری شود و پس از حذف تدریجی CPA، سلولها باید تا زمان استفاده در محیط کشت انکوبه شوند. یک بررسی سیستماتیک گزارش داد که میزان بقا و لقاح تخمک در تخمکهای منجمد شده به روش کاهش دما سریع بیشتر از تخمکهای با روش کاهش دما آهسته بود.
انجماد سریع همچنین منجر به یک جنین با کیفیت بالاتر (22.4٪ در مقابل 8.0٪) و نرخ تقسیم بالاتر (در روز 2: 64.6٪ در مقابل 47.7٪) در مقایسه با کاهش دما با سرعت آهسته شد. علاوه بر این، میزان حاملگی در حال انجام، جنین با کیفیت بالا، تقسیم جنینی و لقاح بین تخمکهای منجمدشده و تازه تفاوت معنا داری نداشت. این یافتهها نشان میدهند که کاهش دما سریع روش بهتری برای انجماد تخمک است.
سلولهای بنیادی
توانایی سلولهای بنیادی برای تمایز به فنوتیپهای سلولی مختلف، پایهای را برای سلولدرمانیهای بازسازیکننده از جمله درمان بیماریهای دژنریتیو و آسیبهای تروماتیک فراهم میکند. درمانهای مبتنی بر سلولهای بنیادی امکان ترمیم ساختار بافت و بازیابی عملکردی را فراهم میکند. علاوه براین، بیومولکولهای سنتز شده توسط سلولهای بنیادی میتوانند به ترمیم بافت کمک کنند.

سلولهای بنیادی خونساز (HSCs) را میتوان برای درمان بیماریهای هماتولوژیک و همچنین بیماریهای غیرهماتولوژیک استفاده کرد. خواص تعدیلکننده ایمنی و سرکوبکننده سیستم ایمنی سلولهای بنیادی مزانشیمی (MSCs) این نوع سلول را برای پیوند آلوژنیک ایدهآل میکند. علاوه بر کاربردهای بالینی آنها در بازسازی و پیوند بافت، سلولهای بنیادی جنینی انسان (ESCs) در تحقیقات برای مطالعه فرآیندهای رشد اولیه و مسیرهای سیگنالینگ سلولی استفاده میشوند.
به منظور گسترش بیشتر کاربردهای بالینی سلولهای بنیادی، باید از پروتکلهای بانکداری کرایوژنیک طولانی مدت پیروی کرد که برای هر نوع سلول بنیادی مناسب باشد. پروتکلهای انجماد برای HSCها و MSCها از روشهای کاهش دما آهسته سنتی پیروی میکنند، در حالی که پروتکلهای ESC از رویکرد کاهش دما سریع پیروی میکنند.
رویکرد استاندارد برای حفظ انجماد HSCها شامل استفاده از DMSO به عنوان CPA، نرخ کنترلشده انجماد در 1 تا 2 درجه سانتیگراد در دقیقه و ذوب سریع است. سلولهای بنیادی مزانشیمی را میتوان به طور مشابه با استفاده از پروتکلهای انجماد آهسته و DMSO به عنوان CPA، انجماد کرد.
روشهای مرسوم (DMSO و کاهش دما آهسته)، با این حال، راندمان پایینی را برای انجماد ESCs نشان دادهاند. در نتیجه، پروتکلهای انجماد برای انجماد ESCs توسعه داده شده است. نرخ بازیابی بالاتری برای ESCهای منجمدشده با کاهش دما سریع در مقایسه با سلولهایی که با پروتکلهای کاهش دما آهسته منجمد شدهاند گزارش شده است (۷۵٪ در مقایسه با حدود ۵٪).
یک پروتکل دقیق برای انجماد ESCهای انسانی شرح داده شده است. به طور خلاصه، ESC های انسانی در معرض افزودن گام به گام دو محلول انجماد با افزایش غلظت CPA قرار میگیرند. اجزای مشترک هر دو محلول شامل DMSO و EG است. ترکیب محلول میتواند با تفاوت در غلظت ساکارز و وجود یا عدم وجود سرم و بافر مورد استفاده متفاوت باشد.
کلنیهای ESC انسانی به ترتیب به مدت 60 و 25 ثانیه در دمای اتاق یا 37 درجه سانتیگراد در معرض دو محلول انجماد قرار میگیرند. علاوه بر این، پیشنهاد شده است که نرخ کاهش دما بالاتر در فرآیندهای انجماد غیرتعادلی میتواند اجازه استفاده از غلظت کل کمتری از CPA را بدهد و ترکیبی از CPA میتواند به کاهش اثرات سمی آنها کمک کند. Reubinoff و همکارانش ترکیبی از DMSO 20% ، EG 20% و 0.5 مولار ساکارز با سرعت کاهش دما سریع را پیشنهاد کردند.
مانند سلولهای کاملاً تمایزیافته، سلولهای بنیادی در معرض تغییرات نامطلوب در ساختار و عملکرد پس از انجماد قرار میگیرند. یک مرور سیستماتیک اخیر ارزیابیهای پس از ذوب سلولهای بنیادی مزانشیمی مشتق از مغز استخوان را در ده گونه از 41 مطالعه جداگانه مقایسه کرد. نویسندگان یک توافق کلی را گزارش کردند که مورفولوژی، ایمونوفنوتیپ، تمایز و پتانسیل تکثیر تا حد زیادی تحت تأثیر انجماد قرار نگرفتند، اما دو سوم آزمایشها کاهش فعالیت متابولیکی را پس از انجماد گزارش کردند.
بعلاوه، تغییرات گزارش شده در زندهمانی متفاوت بود به طوری که تقریباً 43٪ از مطالعات بدون تغییر گزارش کردند و 27٪ گزارش دادند که زنده مانی به طور قابل توجهی کاهشیافتهاست. کاهش زندهمانی پس از کرایو و فعالیت متابولیک اغلب نتیجه آسیب سلولی فیزیکی و مولکولی است. صدمات فیزیکی شامل تشکیل یخ درون سلولی، اثرات محلول، سمیت محلول کرایو و آسیب مولکولی است که به صورت تغییرات در بیان ژن، القای پاسخ استرس و تغییرات اپیژنتیکی ظاهر میشود.
مکانیسمهای مولکولی پشت پاسخهای ژنتیکی به انجماد در سلولهای بنیادی، دقیقاً مانند پاسخهای گامتتیک، کاملاً شناخته شده نیستند و هنوز حوزهای برای تحقیقات فعال هستند. در نهایت، چندین سنجش برای ارزیابی بقای سلول پس از انجماد وجود دارد که شامل تست یکپارچگی غشاء، سنجش فعالیت متابولیکی و مکانیکی، و سنجش فعالیت میتوزی میشود. برای تعیین عملکرد درون تنی سلولهای منجمد شده، سنجشهای لقاح و رشد و همچنین سنجشهای پیوند را میتوان انجام داد.
عوامل جدید، و بیومواد برای بهبود زندهمانی
رویکردهای جدیدتر برای حفظ انجماد سلولی افزایش زندهمانی و بازدهی پس از ذوب را هنگامی که سلولها قبل از انجماد کپسوله میشوند، نشان میدهد. یکی مثال استفاده از کپسولهسازی آلژینات سلولهای کبدی برای افزایش موفقیت در انجماد است. در ترکیب با محلول دانشگاه ویسکانسین10٪ DMSO +(UW) + 5٪گلوکز، میکروبیدهای سلولی کپسوله شده پس از ذوب زندهمانی بهتری نسبت به سلولهای غیرکپسوله شده نشان دادند.
همین رویکرد را میتوان بر روی انواع دیگر سلولها برای بهبود عملکرد انجماد آزمایش کرد. این اثر با استفاده از بازدارنده پان کاسپاز (benzyloxycarbonyl-Val-Ala-dl-Asp-fluoromethylketone [ZVAD]) بیشتر بهبود مییابد. یک مطالعه جدیدتر نیاز به آلژینات را دور میزند، به جای آن، سلولهای کبدی را به صورت قطرات در مخلوط CPA منجمد میکند (UW مکمل با 2 میلیگرم در میلیلیتر BSA، V/V DMSO 32.5٪ ، V/V EG 32.5٪ ، و 800 میلیمولار ساکارز).
قطرات به سرعت در نیتروژن مایع منجمد شدند، که در مقایسه با انجماد آهسته که معمولاً برای انجماد استفاده میشود، غیرمعمول است. سلولهای کبدی منجمد شده با قطرات حجیم، زندهمانی، مورفولوژی بهتر و فعالیت متابولیکی بالاتری نسبت به سلولهای کبدی منجمد غیرقطرهای داشتند. جدای از تغییر تکنیکهای انجماد، افزودن سیگنال بقای سلول، مانند میریستین (مهارکننده پروتئین کیناز 4 فعال شده با میتوژن MKK4) در کشت پس از ذوب سلولهای کبدی منجمد شده، هم به بقای سلول در شرایط آزمایشگاهی و هم پس از پیوند در موشهای دارای نقص ایمنی کمک میکند.
عوامل جدید برای بهبود بازیابی سلولها پس از فریز
تلاش زیادی برای حفظ عملکرد و زندهمانی سلول در طول فرآیند انجماد انجام میشود زیرا هر مرحله، جداسازی سلولی اولیه، خالصسازی اولیه، کشت، انتخاب CPA و نرخهای انجماد و ذوب پتانسیل آسیب رساندن به سلولها و کاهش عملکرد کلی سلول را به همراه دارد. علیرغم این تلاشها، سلولهای انجماد شده همواره کاهش قابلیت زنده مانی پس از ذوب را تجربه میکنند.
استراتژیهای فعلی برای شناسایی سلولهایی که پس از نگهداری زنده میمانند، استفاده از فلوروفورهای آلی و رنگها است. و همانطور که قبلاً بحث شد، گرادیانهای چگالی را میتوان برای افزایش تراکم سلول زنده استفاده کرد، اگرچه این روش اغلب شامل قراردادن سلولها در معرض سانتریفیوژ اضافی و بالقوه مضر است. روشهای درگیرتر برای جداسازی سلولهای زنده و مرده شامل جداسازی سلولهای میل مغناطیسی (MACS) و مرتبسازی سلولی فعال شده با فلورسانس (FACS) است، اگرچه هزینه و عملی بودن گاهی اوقات کاربرد آنها را محدود میکند.
حوزه نوظهور علم نانو میتواند با ارائه روشهای جایگزین غیرمخرب طبقهبندی سلولی و تصویربرداری سلولهای زنده، گام بعدی را در کرایوبیولوژی ارائه کند. یک مطالعه اخیر از نانوذرات مغناطیسی کونژوگه با انکسین V برای غنیسازی محتوای اسپرم زنده در مایع منی گراز از طریق اتصال انتخابی به فسفاتیدیلسرین موجود در سلولهای آپوپتوز استفاده کرد. این طرح مرتبسازی میتواند بهعنوان یک جایگزین ساده با توان بالا برای غنیسازی زندهمانی سلولهای پس از ذوب در مجموعهای از انواع سلولها مورد استفاده قرار گیرد.
نتیجه گیری
پیشرفتهای قابل توجهی در درک ما از اصول و تکنیکهای انجماد برای ذخیرهسازی طولانیمدت و انجماد سلولها از اواخر دهه 1800، زمانی که تحقیقات در مورد تأثیر انجماد بر بافت زنده برای اولین بار آغاز شد، ایجاد شد. ذخیرهسازی طولانی مدت سلولها در دمای 196- درجه سانتیگراد متابولیسم سلولی را متوقف میکند که منجر به تغییرات اجتنابناپذیر در لیپیدها و پروتئینها میشود که میتواند عملکرد و ساختار سلول را مختل کند.
در حالت ایدهآل، غلظت بالاتر CPA میتواند به سلولها اجازه دهد تا به خوبی حفظ شوند. با این حال، افزایش غلظت CPA ها نیز میتواند به سلولها آسیب برساند. DMSO یک CPA استاندارد طلایی برای بسیاری از انواع مختلف سلول باقی مانده است. تکنیکهای جدید مانند ترکیبی از CPA ها یا استفاده از CPA های جدید برای رسیدگی به اثر سمیت برخی از عوامل شناخته شده بررسی شده است.
علاوه بر این، کپسولهسازی آلژینات سلولها قبل از انجماد نشان داده است که بازده حفظ را از طریق روشهای غیرشیمیایی بهبود میبخشد. صرف نظر از نوع سلول، موفقیت هر پروتکل انجماد با انتخاب دقیق چند متغیر متداول تعیین میشود: نوع عامل محافظت کننده در برابر سرما شامل عوامل نفوذکننده و غیرنفوذکننده یا ترکیبی از هر دو، و همچنین سرعت کاهش دما و ذوب مناسب.
رویکردهای جدیدتر مانند کپسولهسازی آلژینات و مرتبسازی سلولی مبتنی بر فناوری نانو ممکن است قابلیت زندهمانی پس از انجماد را افزایش دهد و در نهایت میتواند به بخشی از محیط استاندارد انجماد تبدیل شود. درک اصول شیمی و بیولوژی فرآیندهای انجماد و ذوب میتواند به توسعه روشهای کارآمدتر برای حفظ انجماد سلولها اجازه دهد و کاربردهای بالینی آنها را بیشتر گسترش دهد.
https://journals.sagepub.com/doi/full/10.1177/0963689721999617




درک اصول شیمی و بیولوژی فرآیندهای انجماد و ذوب میتواند به توسعه روشهای کارآمدتر برای حفظ انجماد سلولها اجازه دهد و کاربردهای بالینی آنها را بیشتر گسترش دهد.
سیستم های اتاق کشت جدا از مجموعه آزمایشگاهی ساخته شده و هر کدوم مجهز به امکانات اصلی خود هست
سلام دوست عزیز . ممنون از دیدگاهتون
ببخشسد دوره ها چن وقتی به چن وقت ثبتنام دارند؟
سلام دوست عزیز . لطفا تقویم رو نگاه کنید و با ازمایشگاه تماس بگیرید