اطلاعات عمومی,ویکی ژن
ایمنی سلولی: انواع سلولهای T و عملکرد آنها
مقدمهای بر ایمنی سلولی (Cell-Mediated Immunity – CMI)
ایمنی سلولی یکی از دو شاخه ایمنی تطبیقی است؛ شاخه دیگر، ایمنی هومورال یا ایمنی وابسته به پادتن میباشد.
ایمنی سلولی (CMI) مجموعهای پیچیده از رویدادها است که در آن سلولهای لنفوسیت T فعال شده و عوامل بیماریزا (پاتوژنها) حذف میشوند.
سیستم ایمنی میزبان، پس از مواجهه با عوامل بیماریزای داخلسلولی یا زمانی که بدن تلاش میکند سلولهای خودیِ تغییریافته مانند سلولهای توموری را از بین ببرد، ایمنی سلولی را فعال میکند.
CMI دارای ویژگیهایی همچون اختصاصی بودن و تنوع، حافظه، تخصصگرایی، خود-محدودکنندگی و عدم واکنش به خود میباشد.
سلولهای درگیر در ایمنی سلولی (CMI)
در ایمنی سلولی، هم سلولهای اختصاصی آنتیژن و هم سلولهای غیر اختصاصی مشارکت دارند.
سلولهای اختصاصی آنتیژن همان سلولهای T هستند، در حالی که سلولهای غیر اختصاصی شامل ماکروفاژها، نوتروفیلها و سلولهای کشنده طبیعی (Natural Killer Cells) میباشند.
اجزای اصلی ایمنی سلولی عبارتاند از:
-
سلول T
سلولهای T در پایش ایمنی بدن در برابر سرطان نقش اساسی دارند، مسئول بیشتر بیماریهای خودایمنی هستند و در رد پیوند اعضا نیز مشارکت دارند.
سلولهای T در مغز استخوان تولید میشوند اما در تیموس بالغ میگردند.
در تیموس، سلولهای T از دو مرحله مهم انتخاب عبور میکنند:
- انتخاب مثبت (Positive Selection): در این مرحله، تیموسیتهایی که گیرنده سلولی (TCR) آنها توانایی اتصال به مولکولهای MHC خودی را دارند، انتخاب میشوند. نتیجه این فرایند، ایجاد محدودیت به MHC (MHC Restriction) است.
- انتخاب منفی (Negative Selection): در این م
رحله، تیموسیتهایی که گیرندههای آنها با میل اتصال بالا به MHC خودی یا به آنتیژنهای خودی ارائهشده توسط MHC خودی متصل میشوند، حذف میگردند. نتیجه این مرحله، ایجاد تحمل نسبت به خود (Self-Tolerance) است.
محدودیت MHC و انتخاب کلونی
سلولهایی که به آنتیژنهای خودی واکنش نشان میدهند، از طریق مرگ برنامهریزیشده سلولی از بین میروند.
در مقابل، سلولهای T منتخب دچار تکثیر سریع کلونی شده و جمعیت بزرگی از لنفوسیتهای T اختصاصی آنتیژن را تشکیل میدهند. این فرآیند منجر به تولید زیرجمعیتهای متمایزی از سلولهای T بالغ میشود.
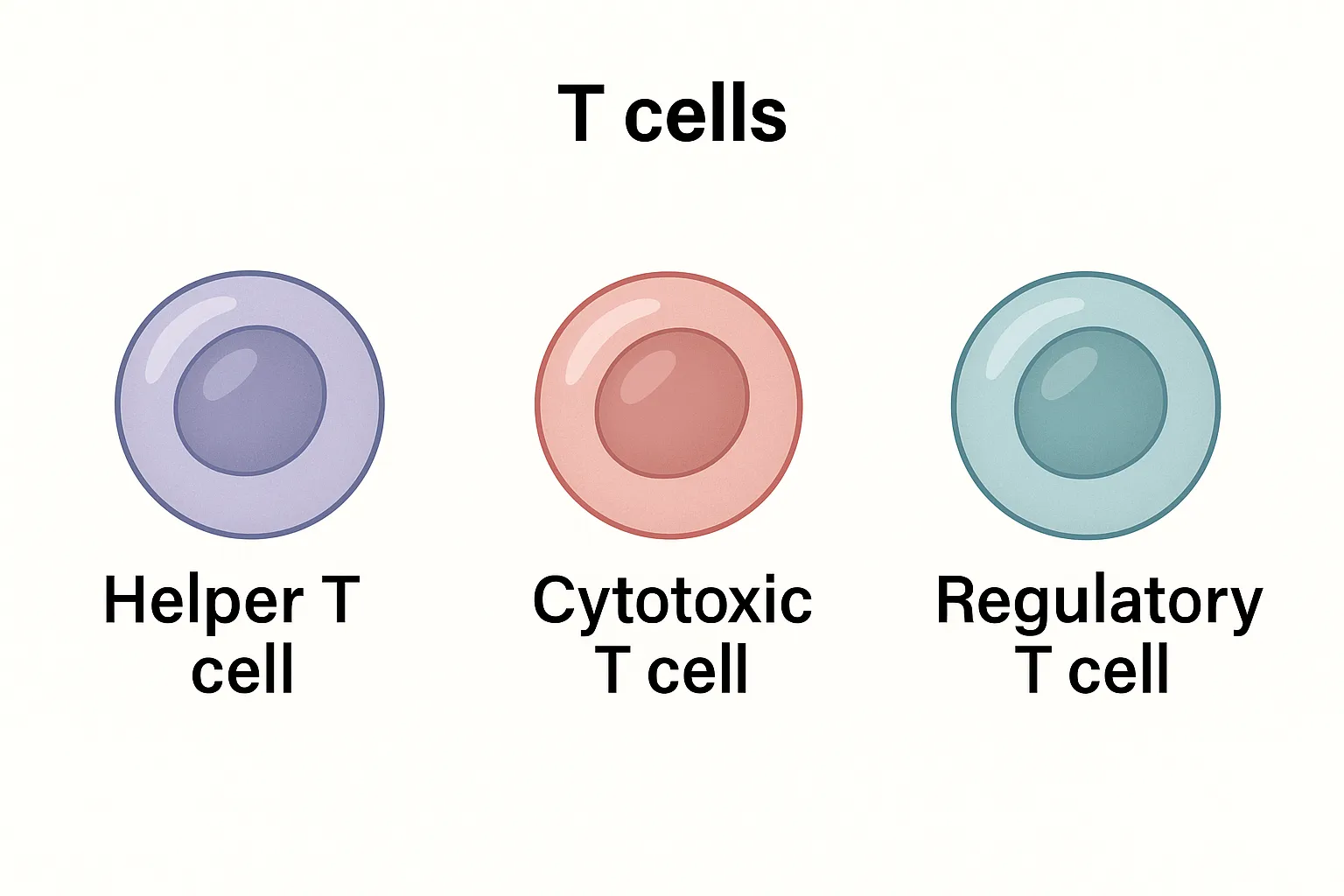
انواع سلولهای T
سلولهای T کمککننده (Helper T Cell – TH):
- سلولهای TH که با عنوان CD4+ T Cells نیز شناخته میشوند، دارای گیرندههای CD4 هستند.
- سلول T کمککننده در مرکز ایمنی تطبیقی قرار دارد و تمام مکانیسمهای ایمنی دیگر را هماهنگ میکند.
- این سلول از طریق سیتوکینها (Cytokines) با سلولهای T سیتوتوکسیک، با ایمنی هومورال از طریق سلولهای B، و با ایمنی ذاتی از طریق نوتروفیلها و ماکروفاژها ارتباط برقرار میکند.
- سلولهای TH سلولهای هدف خود را از طریق برهمکنش گیرنده CD4 با مولکولهای MHC کلاس II بر سطح سلول هدف شناسایی میکنند.
-
سلولهای T سیتوتوکسیک (Cytotoxic T Cell – Tc):
- سلولهای CD8+ یا سلولهای سیتوتوکسیک T دارای گیرندههای CD8 هستند.
- این سلولها بازیگران اصلی ایمنی سلولی محسوب میشوند.
- سلولهای Tc با آزاد کردن سموم، مستقیماً عوامل بیماریزا یا سلولهای میزبان سرطانی را از بین میبرند.
- این سلولها آنتیژنهای موجود بر سطح سلولهای آلوده به ویروس، سلولهای توموری و سلولهای پیوندی بیگانه (Allograft Cells) را از طریق شناسایی مولکولهای MHC کلاس I تشخیص داده و سلول هدف را نابود میکنند.
-
سلولهای T تنظیمی/سرکوبگر (Regulatory/Suppressor T Cell):
- در مواقعی که پاسخ ایمنی دیگر مورد نیاز نیست، این نوع سلولها با کاهش تکثیر سلولهای T مؤثر (Effector T Cells) باعث تنظیم پاسخ ایمنی میشوند.
- همچنین این سلولها در تمایز بین آنتیژنهای خودی و غیرخودی نقش دارند و از بروز خودایمنی جلوگیری میکنند.
عملکرد سلولهای T
۱. عملکردهای مؤثر سلولهای (Effector Functions of T Cells) T
- سیتوتوکسیسیته (Cytotoxicity):
سلولهای T سیتوتوکسیک (CD8⁺) با استفاده از چندین مکانیسم سلولهای آلوده یا غیرخودی را از بین میبرند:
- با وارد کردن پروفورینها (Perforins) و گرانزیمها (Granzymes)، که آنزیمهای تخریبکننده هستند، به درون سلول آلوده و القای مرگ برنامهریزیشده سلولی (Apoptosis).
- از طریق برهمکنش بین مولکول Fas و لیگاند آن (Fas–Fas Ligand, FasL) که مسیر مرگ سلولی را فعال میکند.
- بهوسیله مکانیسم سیتوتوکسیسیته وابسته به آنتیبادی (Antibody-Dependent Cellular Cytotoxicity – ADCC) که در آن سلولهای ایمنی با شناسایی آنتیبادیهای متصل به سطح سلول هدف، آن را نابود میسازند
- حاسیت تأخیری (Delayed Hypersensitivity):
یکی از عملکردهای کلیدی سلولهای T در پاسخ ایمنی تأخیری است، که در آن سلولهای T کمککننده (TH1) از طریق ترشح سیتوکینهایی مانند اینترفرون گاما (IFN-γ) و فاکتور نکروز تومور (TNF) موجب فعالسازی ماکروفاژها میشوند تا عوامل بیماریزای درونسلولی (مانند Mycobacterium tuberculosis) را از بین ببرند.
این نوع پاسخ معمولاً طی ۲۴ تا ۷۲ ساعت پس از مواجهه با آنتیژن بروز میکند.
۲. عملکردهای تنظیمی سلولهای T
- تنظیم تولید آنتیبادی (Regulation of Antibody Production):
سلولهای T کمککننده (TH2) از طریق ترشح سیتوکینهایی مانند IL-4، IL-5 و IL-6، سلولهای B را تحریک کرده و تولید آنتیبادی اختصاصی را تقویت میکنند.
- تحریک سلولهای T کمککننده و سیتوتوکسیک برای مشارکت در CMI:
سلولهای T با ترشح سیتوکینهایی مانند IL-2، تکثیر سایر سلولهای T (اعم از CD4⁺ و CD8⁺) را تحریک کرده و پاسخ ایمنی سلولی را تقویت میکنند.
- سرکوب پاسخهای ایمنی خاص (Suppression of Specific Immune Responses):
سلولهای T تنظیمی (Treg) از طریق ترشح IL-10 و TGF-β یا از طریق تماس مستقیم سلولی، از فعالسازی بیشازحد سیستم ایمنی جلوگیری کرده و مانع از بروز آسیبهای بافتی و بیماریهای خودایمنی میشوند.
کمپلکس سازگاری بافتی اصلی و سلولهای ارائهدهنده آنتیژن (MHC and Antigen-Presenting Cells)
تمام سلولهای هستهدار بدن – بهجز سلولهای اسپرم و نورونها – دارای مولکولهای کمپلکس سازگاری بافتی اصلی (Major Histocompatibility Complex – MHC) بر سطح خود هستند.
MHC به دو رده تقسیم میشود:
- کلاس (MHC Class I) I: در تمام سلولهای هستهدار وجود دارد.
- کلاس (MHC Class II) II: تنها در سلولهای ارائهدهنده حرفهای آنتیژن (Professional Antigen-Presenting Cells – APCs) مانند ماکروفاژها، سلولهای دندریتیک (Dendritic Cells) و سلولهای B یافت میشود.
سلولهای T تنها زمانی قادر به شناسایی آنتیژنها هستند که آنها بهصورت پپتید و در ارتباط با مولکولهای MHC ارائه شده باشند.
قانونی به نام «قاعده هشت (Rule of Eight)» وجود دارد:
- سلولهای CD4⁺ (Helper T Cells) آنتیژن را در ارتباط با MHC کلاس II شناسایی میکنند ← (4 × 2 = 8)
- سلولهای CD8⁺ (Cytotoxic T Cells) آنتیژن را در ارتباط با MHC کلاس I شناسایی میکنند ← (8 × 1 = 8)
به این پدیده « محدودیت (MHC Restriction) MHC » گفته میشود، زیرا هر نوع سلول T تنها آنتیژنی را شناسایی میکند که با کلاس خاصی از مولکول MHC ارائه شده باشد.
محدودیت MHC نتیجه فرآیند انتخاب مثبت تیموسی است و بهوسیله نواحی اتصال اختصاصی در گیرنده سلول T (TCR) و نیز پروتئینهای CD4 یا CD8 که به نواحی ویژهای از مولکولهای MHC متصل میشوند، میانجیگری میگردد.
گیرنده سلول T
- ویژگی اصلی سلول T وجود گیرنده اختصاصی (TCR) بر سطح آن است.
- TCR آنتیژنهای خاصی را که توسط سلولهای ارائهدهنده آنتیژن (APC) ارائه میشوند، شناسایی میکند.
- هر لنفوسیت T بهصورت ژنتیکی برنامهریزی شده است تا از طریق بازآرایی ژنها (Gene Rearrangement) گیرندهای منحصربهفرد تولید کند که با اپیتوپ خاصی سازگار باشد.
- این بازآرایی ژنی و بیان نشانگرهای سطحی مختلف باعث ایجاد تنوع و اختصاصی بودن سلولهای T میشود.
- بیشتر گیرندههای سلول T از دو زنجیره تشکیل شدهاند:
- زنجیره آلفا (α)
- زنجیره بتا (β)
- TCR تنها با آنتیژنهایی واکنش نشان میدهد که به مولکولهای MHC متصل شده باشند؛ بهعبارتی، واکنش TCR تنها زمانی رخ میدهد که پپتید مکملشکل درون مولکول MHC قرار گرفته باشد.
سیتوکینها (Cytokines)
سیتوکینها مواد شیمیایی هستند که توسط سلولهای T برای ارتباط، تنظیم و القای مرگ سلولهای آلوده به پاتوژنها ترشح میشوند.
آنها پروتئینها و گلیکوپروتئینهای پیامرسان هستند که میتوانند پاسخ ایمنی را فعال یا غیرفعال کنند.
ایمنی سلولی (CMI) سلولها را تحریک میکند تا سیتوکینهایی ترشح کنند که سیگنالهای هماهنگی بین اجزای ایمنی ذاتی و تطبیقی را منتقل نمایند.
نمونههایی از سیتوکینها عبارتاند از:
- اینترلوکینها (Interleukins)
- اینترفرونها (Interferons)
- فاکتورهای رشد (Growth Factors)
هر دو نوع سلولهای اختصاصی آنتیژن و غیر اختصاصی در ایمنی سلولی برای انجام عملکرد خود به سیتوکینها نیاز دارند.
اجزای تکمیلی
- ماکروفاژها و سلولهای دندریتیک: میکروبها را فاگوسیتوز کرده و آنتیژنهای آنها را به سلولهای T ارائه میدهند.
- سلولهای کشنده طبیعی (Natural Killer – NK Cells): با استفاده از گیرندههای ذاتی خود سلولهای آلوده به ویروس یا سلولهای سرطانی را شناسایی و نابود میسازند.
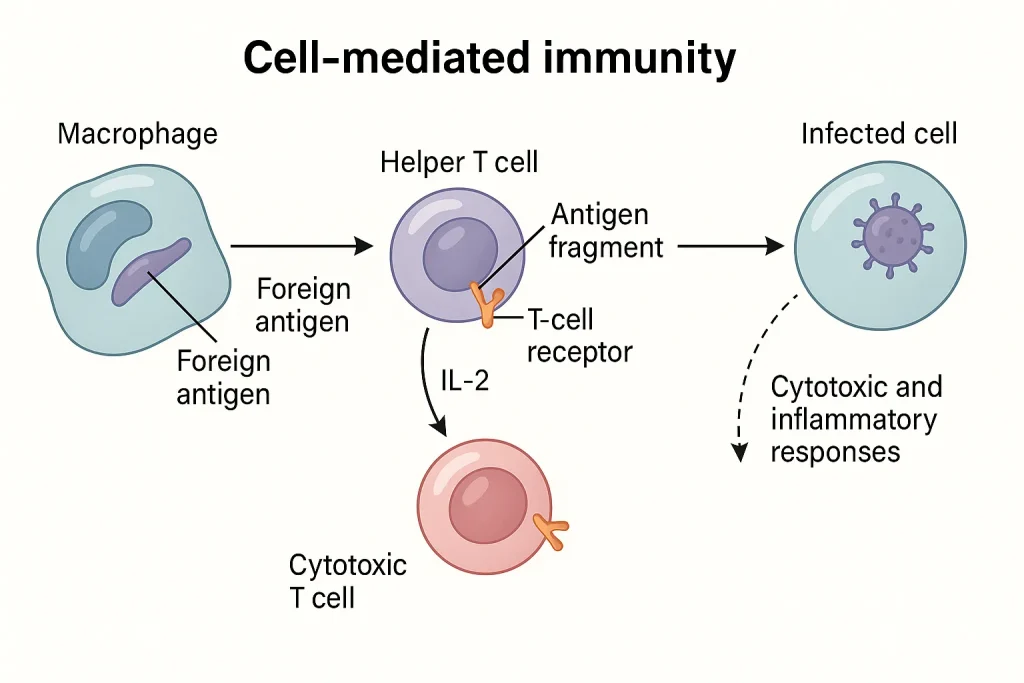
مکانیسم ایمنی سلولی (Mechanism of Cell-Mediated Immunity – CMI)
ایمنی سلولی برای پاسخ به آنتیژنهای درونسلولی، نیازمند تماس مستقیم سلول با سلول یا تحریک شیمیایی از طریق سیتوکینها است.
مکانیسم CMI را میتوان در قالب چند مرحله اصلی بهتر درک کرد:
-
شناسایی آنتیژنهای بیگانه
تعداد زیادی از لنفوسیتهای T توانایی شناسایی و واکنش به تعیینکنندههای آنتیژنی خاص (Antigenic Determinants) را دارند.
هنگامی که آنتیژنی وارد بدن میشود، تنها آن کلونی از سلولهای T که گیرنده آنها مکمل همان آنتیژن است فعال میگردد؛ این فرآیند را انتخاب کلونی (Clonal Selection) مینامند.
در نتیجه، از میان میلیونها لنفوسیت T موجود، تنها یک جمعیت خاص بهطور اختصاصی تکثیر یافته و پاسخ ایمنی را آغاز میکند.
-
فعالسازی T
فعالسازی سلولهای T مستلزم تماس با میکروارگانیسمها یا آنتیژنهای درونسلولی است. در عین حال، ایمنی ذاتی (Innate Immunity) با تولید سیتوکینها و سیگنالهای التهابی، این فرآیند را تقویت میکند.
هنگامی که ماکروفاژ آنتیژنی را بلعیده و هضم میکند، بخشی از آن را بهصورت پپتیدی بر سطح خود در قالب MHC کلاس II نمایش میدهد.
در این مرحله، برهمکنش بین پروتئینهای سطحی ماکروفاژ و سلول T کمککننده (TH) رخ میدهد که منجر به فعالسازی سلول T کمککننده میشود.
سلولهای TH فعالشده، سیتوکینها را ترشح کرده و به نوبه خود باعث فعالسازی سلولهای T سیتوتوکسیک (CD8⁺)، سلولهای B، ماکروفاژها و سلولهای کشنده طبیعی (NK Cells) میشوند.
سلولهای TH پس از فعالسازی به دو زیرجمعیت اصلی تمایز مییابند:
- TH1:
که سیتوکینهایی مانند IFN-γ، IL-2 و TNF را ترشح کرده و موجب فعالسازی سلولهای T سیتوتوکسیک و ماکروفاژها میشود. - TH2:
که سیتوکینهایی مانند IL-4، IL-5 و IL-10 را ترشح کرده و تکثیر و تمایز سلولهای B را برای تولید آنتیبادی تحریک میکند.
بنابراین، تعامل بین TH2 و سلولهای B به تولید آنتیبادی منجر میشود، در حالی که سیتوکینهای ترشحشده توسط TH1 سلولهای سیتوتوکسیک و ماکروفاژها را فعال میکنند تا پاسخ ایمنی سلولی را هدایت کنند.
-
حذف آنتیژن از طریق مکانیسم مؤثر
در مرحله مؤثر (Effector Phase)، عوامل بیماریزا از بین میروند و سلولهای حافظه شکل میگیرند.
سلولهای T سیتوتوکسیک فعال (Tc) تکثیر یافته و به سلولهای بالغ مؤثر (Mature Effector Tc Cells) تبدیل میشوند که قادرند سلولهای آلوده را شناسایی و نابود کنند.
مولکولهای MHC کلاس I بر سطح سلولهای آلوده به گیرندههای CD8 روی سلولهای Tc متصل میشوند.
پس از این اتصال، سلول Tc پروفورین (Perforin)، گرانزیم (Granzyme) و لنفوتوکسین (Lymphotoxin) ترشح میکند که منجر به تخریب سلول آلوده یا سلولهای سرطانی میشود.
سلولهای Tc فعالشده با تکثیر کلونی، گروهی از سلولها با گیرندههای TCR مشابه ایجاد میکنند که همگی به همان آنتیژن واکنش نشان میدهند.
این سلولهای مؤثر بهطور مستقیم با سلولهای آلوده برخورد کرده و آنها را از بین میبرند.
مکانیسم مؤثر شامل فرآیندهای زیر است:
- ترشح سیتوتوکسینها
- فعالسازی لکوسیتها
- پاسخهای سیتوتوکسیک
- حساسیت تأخیری نوع چهارم
بهطور مشابه، ماکروفاژهای فعالشده و سلولهای NK نیز با تخریب عوامل بیماریزای درونسلولی در این مرحله شرکت میکنند.
-
بازگشت به حالت هموستاز
پس از حذف آنتیژنها، سیستم ایمنی باید به وضعیت پایه استراحت بازگردد.
این بازگشت به این دلیل است که بیشتر سلولهای T حاصل از تکثیر کلونی پس از پایان پاسخ ایمنی از طریق آپوپتوز (Apoptosis) از بین میروند.
این مکانیسم باعث میشود که فعالیت ایمنی پس از پایان عفونت متوقف شود و از آسیب به بافتهای سالم جلوگیری گردد.
-
حفظ حافظه ایمنی (Maintenance of Memory)
هنگامی که آنتیژن برای نخستینبار سلولهای T نابالغ (Naïve T Cells) را تحریک میکند، پاسخ ایمنی اولیه (Primary Immune Response) ایجاد میشود که در آن تکثیر کلونی سلولهای T رخ میدهد.
در این مرحله، تعداد این سلولها نسبت به سایر کلونهای T در گردش خون بهمراتب بیشتر میشود.
پس از رفع عفونت، بسیاری از این سلولهای اختصاصی آنتیژن از طریق آپوپتوز از بین میروند، اما تعدادی از آنها بهصورت سلولهای حافظه (Memory T Cells) باقی میمانند.
این سلولهای حافظه توانایی دارند که تا سالها در بدن باقی بمانند و در مواجهه مجدد با همان آنتیژن، پاسخ ایمنی را سریعتر و قویتر آغاز کنند.
سلولهای حافظه قادرند خود را از طریق تقسیم سلولی در نسلهای متعدد تکثیر کنند.
در مواجهه مجدد با آنتیژن، این سلولهای حافظه بهسرعت تکثیر یافته، تمایز یافته و به سلولهای مؤثر تبدیل میشوند تا آنتیژن را حذف کنند.
سلولهای حافظه از نظر نشانگرهای سطحی با سلولهای نابالغ یا مؤثر تازهفعال متفاوتاند؛ آنها سطوح بالاتری از مولکولهای چسبندگی (Adhesion Molecules) مانند اینتگرینها (Integrins) و CD44 دارند که باعث میشود بتوانند سریعتر به نواحی آلوده در سراسر بدن مهاجرت کنند.
سلولهای حافظه در دو نوع اصلی وجود دارند:
- سلولهای حافظه مؤثر (Effector Memory T Cells): که در خون در گردش هستند.
- سلولهای حافظه بافتی (Resident Memory T Cells): که در بافتها مستقر بوده و در صورت ورود مجدد آنتیژن، سریعاً فعال میشوند.
اهمیت ایمنی سلولی (Importance of Cell-Mediated Immunity – CMI)
- ایمنی سلولی (CMI) نقش بسیار مؤثری در از بین بردن عوامل بیماریزای درونسلولی و سلولهای تغییریافتهٔ خودی ایفا میکند. این سیستم سلولهای آلوده به ویروس، باکتریهای داخلسلولی و سلولهای سرطانی را نابود میسازد. همچنین با القای آپوپتوز (مرگ برنامهریزیشدهٔ سلولی) سلولهای معیوب و ناکارآمد را حذف میکند.
- سلولهای T تنظیمکنندهٔ اصلی سایر اجزای سیستم ایمنی هستند و تکثیر و فعالیت سلولهایی مانند سلولهای B، ماکروفاژها و نوتروفیلها را کنترل و هماهنگ میکنند.
- سلولهای T تنظیمی (Regulatory T Cells) با ایجاد تحمل ایمنی (Immune Tolerance) نقش مهمی در جلوگیری از واکنشهای ایمنی علیه میکروارگانیسمهای همزیست (Commensals)، پیوند عضو (Graft/Transplant)، حاملگی و حتی در برخی تومورها دارند.
عملکردهای ایمنی سلولی (Functions of Cell-Mediated Immunity)
-
محافظت از بدن در برابر باکتریهای درونسلولی، قارچها و انگلها:
ایمنی سلولی، میزبان را در برابر چندین گونه از باکتریهای درونسلولی مانند Mycobacterium tuberculosis، Atypical Mycobacteria، Legionella pneumophila و Listeria monocytogenes محافظت میکند.
این نوع پاسخ ایمنی در تشکیل گرانولوم (Granuloma Formation) نقش دارد — ساختاری دفاعی که در بیماریهای قارچی سیستمیک مانند کوکسیدیوئیدومایکوزیس (Coccidioidomycosis)، هیستوپلاسموزیس (Histoplasmosis) و بلاستومایکوزیس (Blastomycosis) مشاهده میشود.
-
نابودی سلولهای آلوده به ویروس و سلولهای تغییریافتهٔ خودی:
ایمنی سلولی با فعالسازی سلولهای T سیتوتوکسیک (Cytotoxic T Cells – CD8⁺) باعث تخریب سلولهای آلوده به ویروس و سلولهای توموری میشود. این سلولها با شناسایی آنتیژنهای ارائهشده بر سطح سلولهای آلوده از طریق مولکولهای MHC کلاس I، سلول هدف را از بین میبرند.
-
رد پیوند و رد تومور (Graft and Tumor Rejection):
ایمنی سلولی در شناخت و حذف سلولهای بیگانهٔ پیوندی (Allograft Rejection) و همچنین در شناسایی و تخریب سلولهای توموری نقش اساسی دارد.
-
تنظیم پاسخ آنتیبادی (Regulation of Antibody Response):
سلولهای T کمککننده (TH2) از طریق تحریک و سلولهای T تنظیمی (Treg) از طریق سرکوب پاسخهای ایمنی، تولید آنتیبادی را تنظیم میکنند تا از واکنش بیشازحد جلوگیری شود.
-
واکنشهای آلرژیک نوع تأخیری (Allergy/Hypersensitivity):
ایمنی سلولی در بروز واکنشهای آلرژیک نوع چهارم (Type IV Hypersensitivity) نقش دارد. بهعنوان مثال، واکنش آلرژیک به گیاه سمی «بلوط سمی» (Poison Oak) ناشی از همین نوع ایمنی است.
کاهش یا نقص در ایمنی سلولی (Reduced Cell-Mediated Immunity)
کاهش عملکرد ایمنی سلولی افراد را مستعد ابتلا به عفونتهای خاصی میکند، از جمله:
- Nocardia asteroides – باکتری فرصتطلبی که در افراد دارای نقص ایمنی سلولی باعث عفونت ریوی و مغزی میشود.
- Mycobacterium leprae – در بیماران مبتلا به جذام نوع لپروماتوز (Lepromatous Leprosy)، پاسخ ایمنی سلولی به این باکتری ناقص است و بیماری منتشر میشود.
- ویروس هرپس سیمپلکس (HSV): سرکوب ایمنی سلولی باعث فعالشدن مجدد ویروس و گسترش عفونت شدید میشود.
- ویروس واریسلا زوستر (VZV): کاهش ایمنی سلولی موجب فعالشدن مجدد ویروس نهفته و بروز زونا (Shingles) میشود.
- سیتومگالوویروس (CMV): سرکوب ایمنی سلولی میتواند منجر به عفونت سیستمیک و گسترده با CMV شود.
- ویروس اپشتین–بار (EBV): نقص در ایمنی سلولی میتواند باعث تکثیر کنترلنشدهٔ سلولهای آلوده به EBV گردد و زمینهساز لنفومها شود.
- عفونتهای قارچی (Fungal Infections):
سرکوب پاسخ ایمنی سلولی موجب فعالسازی مجدد عفونتهای قارچی نهفته و بروز عفونتهای فرصتطلب میشود.
برای مثال، بیماری ناشی از Cryptococcus neoformans عمدتاً در بیماران مبتلا به ایدز (AIDS) رخ میدهد.
همچنین، کاهش CMI خطر عفونت منتشرهٔ قارچهای سیستمیک مانند Histoplasma و Coccidioides را افزایش میدهد. - Toxoplasma gondii:
در بیماران دارای نقص ایمنی سلولی (مانند بیماران مبتلا به AIDS) ، توکسوپلاسموزیس مغزی (Encephalitis) میتواند رخ دهد.
ایمنی سلولی با محدود کردن گسترش فرم فعال انگل (Tachyzoite) نقش اساسی در مهار بیماری دارد.
اختلال در ایمنی سلولی
- حساسیت نوع چهارم:
این نوع واکنشها، مانند واکنش پوستی به تست توبرکولین، ناشی از فعالیت بیشازحد سلولهای T و ماکروفاژها هستند. - رد بافت و پیوند
CMI مسئول شناسایی و از بین بردن سلولهای پیوندی بیگانه است. - سوپرانتیژنها
برخی سموم باکتریایی مانند Toxic Shock Syndrome Toxin، بهطور همزمان به گیرندهٔ سلول T (TCR) و مولکول MHC متصل میشوند و موجب فعالسازی شدید و غیرکنترلشدهٔ سلولهای T و ترشح گستردهٔ سیتوکینها میگردند که برای میزبان خطرناک است (پدیدهٔ «طوفان سیتوکینی»). - بیماریهای خودایمنی :
فعالیت ناهنجار CMI میتواند موجب بروز بیماریهایی مانند دیابت نوع ۱، مولتیپل اسکلروزیس (MS) و آرتریت روماتوئید (RA) شود. - واکنشهای آلرژیک مزمن :
ایمنی سلولی ممکن است باعث ایجاد شرایطی مانند عدم تحمل گلوتن (Gluten Intolerance) یا بیماری سلیاک (Celiac Disease) گردد.
همچنین بخوانید:
- مجموعه سازگاری بافتی چیست؟
- سلولهای T تنظیمی (تنظیمکننده)
- پروتئین های سطحی دخیل در ایمنی سلولی ساختار شیمیایی و نحوه عملکرد
مترجم: محمد صادق محمودی لرد (LinkedIn) (Google Scholar)