تکنیک ها
انواع روش های هیستوتکنیک
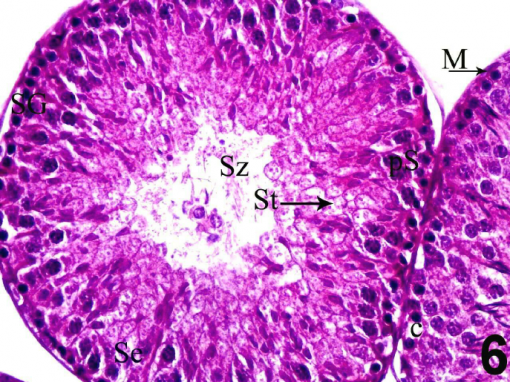
هیستوتکنیک اصطلاحی است که طی آن، اسلایدهای میکروسکوپی از نمونه های بررسی شده در آزمایشگاه آسیب شناسی گرفته می شود. برخی از روشهای هیستوتومی به شرح زیر است:
الف) بررسی اولیه برش بافتی
بافت هایی که بدست می آیند ابتدا توسط یک آسیب شناس یا پاتولوژیست بررسی می شوند. معاینه بافتی شامل شرح نمونه و قرار دادن آن در یک کاست است که سپس در آن فیکس می شود. در صورت مشکوک بودن به بدخیمی ، نمونه با جوهر پوشانده می شود تا حاشیه های آن مشخص شود. در صورت لزوم از رنگ های مختلفی برای نشانه گذاری مناطق مختلف استفاده می شود.
ب) فیکساسیون
روند تثبیت با هدف حفظ و نگهداری بافت ها به طور دائمی و با کمترین مقدار دناتوراسیون پروتئین انجام می شود. فیکساسیون در اسرع وقت و پس از برداشتن بافت از نمونه انجام می شود تا از اتولیز آن جلوگیری شود. فرمالدهید بهترین ماده ثابت کننده است اما بسته به کاربرد مورد نیاز ممکن است بتوان از فیکساتورهای مختلفی که در دسترس باشد استفاده کرد. 5 گروه اصلی فیکساتورها بر اساس مکانیسم عملکرد دسته بندی می شوند: آلدهیدها ، جیوه ، الکل ها ، مواد اکسید کننده و پیکرات ها. عواملی که ممکن است بر پروسه فیکساسیون تأثیر بگذارند شامل بافر ، مقدار نفوذ ، حجم ، دما ، غلظت و فاصله زمانی هستند.
ج) پردازش بافت
بافت های گرفته شده از نمونه باید توسط آزمایشگاه بافت شناسی پردازش شوند تا اسلایدهایی تولید شوند که بتوان آن ها را در زیر میکروسکوپ مشاهده کرد. فردی که وظیفه پردازش بافت و تولید اسلایدهای میکروسکوپی را بر عهده دارد به عنوان متخصص پاتولوژی شناخته می شوند. نمونه های دریافت شده معمولاً اطلاعات بیمار و محل برش بافت را ذکر می کنند. برای کمک به روند شناسایی نمونه ، به هر نمونه عددی داده می شود. به فرآیند وارد کردن نمونه های فیکس شده به بلوک های پارافینی ، پردازش بافت گفته می شود. گام های اصلی در این مرحله آب گیری و شفاف سازی آن است.
آب موجود در نمونه ابتدا با فرآیند آبگیری به کمک یک سری از الکل ها از بافت خارج می شود. همچنین می توان از مخلوط الکل و فرمالین استفاده کرد. اگرچه می توان از سایر مواد دهیدراته کننده نیز استفاده کرد ، اما در مقایسه با الکل و فرمالین معایب عمده ای وجود دارد. فرآیند شفاف سازی شامل حذف ماده خشک کننده با استفاده از ماده ای است که به خوبی با پارافین مخلوط می شود. متداول ترین ماده استفاده شده در این مرحله زایلن است. تولوئن نیز به خوبی کار می کند اما هزینه آن بسیار بیشتر از زایلن است. سرانجام ، بافت پارافین زدایی می شود. گزینه های جایگزین پارافین مانند پلاستیک ها، به کاربر این امکان را می دهند تا مقاطع نازک تری برش داده شوند. برخی از جایگزین های پلاستیکی عبارتند از متیل متاکریلات ، متاکریلات گلیکول ، آرالدیت و اپون. از مضرات استفاده از پلاستیک ها این است که آن ها نیازمند دترجنت های خاصی هستند تا بتوان آن ها را آب گیری و شفاف سازی کرد. این دترجنت ها غالبا موادی هزینه بر هستند.
د) برش زنی
برای برش بلوک ها ، از میکروتوم ویژه استفاده می شود. پس از برش ، نمونه بر روی یک حمام آب گرم شناور می شود و آن را بر روی یک اسلاید میکروسکوپی شیشه ای می برند. اسلایدها به مدت 15 دقیقه بر روی صفحه ای گرم قرار می گیرند تا اطمینان حاصل شود که برش به لام می چسبد.
ه) برش بافت یخ زده
این کار با استفاده از ابزاری به نام کریوستات انجام می شود. این بافت در یک مایع یا محیط سرد منجمد شده ، برش خورده و بر روی لام شیشه ای قرار می گیرد.
و) رنگ آمیزی
اسلایدها ابتدا قبل از شروع رنگ آمیزی پارافین زدایی می شوند. رنگ روتین مورد استفاده در این مرحله، هماتوکسیلین و ائوزین است.
ز) لامل گذاری
پس از رنگ آمیزی ، اسلایدها با استفاده از یک قطعه نازک پلاستیکی یا شیشه ای برای محافظت از نمونه ، لامل گذاری می شوند که علاوه بر حفظ بافت، سبب ارائه کیفیت بهتری نیز می شود.
ح) کلسیم زدایی
بافت هایی وجود دارند که حاوی رسوبات کلسیمی هستند و می توانند سبب ایجاد مشکلاتی در طی فرآیند برش زنی شوند. برای حذف کلسیم آن، می توان از اسیدهای معدنی، اسیدهای آلی و الکترولیز استفاده کرد.




روشهای به روز سیتو هیستوتکنیک چیست؟
IHC (ایمونوهیستوشیمی): تشخیص مولکولی تومورها با آنتیبادیهای اختصاصی
IF (ایمونوفلورسانس): بررسی دقیق پروتئینها با فلورسانس
ISH / FISH: شناسایی ژنها و تغییرات کروموزومی
Automated Tissue Processing & Staining: افزایش دقت و تکرارپذیری
Digital Pathology & AI: اسکن اسلاید و تحلیل هوشمند
Liquid-Based Cytology (LBC): کیفیت بالاتر نمونههای سیتولوژی
Cell Block Technique: تبدیل نمونه سیتولوژی به بلاک بافتی برای IHC
سلام. ایا شما خدمات ازمایشگاهی برای هستولوژی نجام میدهید
سلام، بله جهت اطلاعات بیشتر تماس بگیرید
بروز اشکال در کدام مرحله از روش مطالعه بافتی (هیستو تکنیک ) منجر به اتولیز سلوله ا می شود ؟
اتولیز سلولها در هیستوتکنیک، که فرآیندی است که در آن آنزیمهای داخلی سلولی بافت مرده یا آسیبدیده را تجزیه میکنند، معمولاً در مرحله نمونهبرداری یا فیکساسیون رخ میدهد. این مشکل زمانی بروز میکند که نمونه به درستی فیکس نشده باشد یا بین زمان نمونهبرداری تا فیکساسیون تأخیر افتاده باشد. فیکساسیون بهموقع و مناسب برای حفظ ساختار سلولی و جلوگیری از فعالیت آنزیمهایی که منجر به اتولیز میشوند، حیاتی است.
نمونهبرداری: اگر بین برداشتن نمونه و شروع فرآیند فیکساسیون تأخیر باشد، سلولها ممکن است شروع به تجزیه شدن کنند.
فیکساسیون ناکافی: استفاده ناکافی از مواد فیکس کننده یا فیکس نکردن نمونه برای مدت زمان کافی میتواند منجر به اتولیز شود، زیرا فیکساتیوها کارکرد آنزیمهای تجزیه کننده را مهار میکنند.
برای جلوگیری از اتولیز، توصیه میشود که نمونهها به سرعت پس از برداشتن فیکس شوند و از فیکساتیوهای مناسب و به میزان کافی استفاده شود. انتخاب فیکساتیو مناسب و مدت زمان فیکساسیون باید بر اساس نوع بافت و هدف مطالعه تعیین شود.