مقدمهای بر اندازهگیری غلظت سایتوکاینهای ترشح شده با فلوسایتومتری
فلوسایتومتری به عنوان یک روش پیشرفته و چندکاره در ایمونولوژی، امکان اندازهگیری همزمان و دقیق غلظت سایتوکاینهای ترشح شده را فراهم میکند. این تکنیک با استفاده از دو رویکرد اصلی شامل تکنیک میکروبیدی (CBA) و رنگآمیزی درونسلولی سایتوکاینها (ICS)، اطلاعات ارزشمندی درباره پاسخهای ایمنی و التهابی ارائه میدهد.
روش CBA بر پایه استفاده از میکروبیدهای فلورسنت با اندازههای مختلف کار میکند که هر کدام به آنتیبادیهای اختصاصی برای سایتوکاینهای مختلف متصل هستند. این میکروبیدها پس از انکوباسیون با نمونه و تشکیل کمپلکس ایمنی، با آنتیبادی ثانویه نشاندار شده و توسط دستگاه فلوسایتومتری خوانده میشوند. شدت فلورسانس اندازهگیری شده مستقیماً با غلظت سایتوکاین موجود در نمونه مرتبط است. این روش با حساسیت بالا در حد (pg/ml) و نیاز به حجم کم نمونه (50-100 میکرولیتر)، امکان سنجش همزمان تا 30 سایتوکاین مختلف را در یک آزمایش فراهم میکند.
مکانیسم عملکرد
سیستم CBA از مجموعهای از میکروبیدهای پلی استایرن با اندازههای مختلف (5.5 تا 7.5 میکرومتر) استفاده میکند که هر گروه با نسبتهای مشخصی از دو رنگ فلورسنت (معمولاً APC و Cy5) نشاندار شدهاند. این کدگذاری فلورسانسی به هر گروه از میکروبیدها هویت منحصر به فردی میدهد که توسط فلوسایتومتری قابل تشخیص است. هر گروه از میکروبیدها به آنتیبادیهای اختصاصی برای یک سایتوکاین خاص (مانند IL-2، IL-4، IL-6، IL-10، TNF-α و IFN-γ) متصل شدهاند.
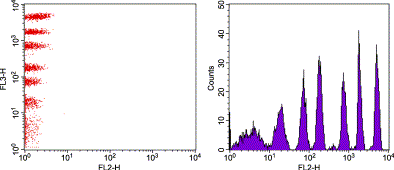
اساس کار این روش به این صورت است که ابتدا مخلوطی از میکروبیدهای کدگذاری شده با نمونه مورد آزمایش انکوبه میشوند. در صورت وجود سایتوکاینهای هدف در نمونه، این مولکولها به میکروبیدهای مربوطه متصل میشوند. سپس آنتیبادی دوم که با فلوروکروم PE نشاندار شده است اضافه میشود و کمپلکس ساندویچی تشکیل میدهد. شدت فلورسانس PE اندازهگیری شده متناسب با غلظت سایتوکاین موجود در نمونه است.
مزیت اصلی این روش امکان سنجش همزمان 15 تا 30 سایتوکاین مختلف در حجم کم نمونه (حدود 50 میکرولیتر) با حساسیت در محدوده pg/ml است. این در حالی است که روشهای سنتی مانند الایزا معمولاً فقط قادر به اندازهگیری یک سایتوکاین در هر آزمایش هستند. دقت این روش با ضریب تغییرات کمتر از 10% و محدوده دینامیکی گسترده (5/2-5000pg/ml) از دیگر ویژگیهای برجسته آن محسوب میشود.
برای انجام این آزمایش، ابتدا باید منحنی استاندارد برای هر سایتوکاین تهیه شود. سپس نمونهها با مخلوط میکروبیدها به مدت 3-2 ساعت در تاریکی انکوبه میشوند. پس از اضافه کردن آنتیبادی تشخیصی نشاندار شده و شستشو، نمونهها توسط فلوسایتومتری آنالیز میشوند. دادههای بدست آمده با استفاده از نرمافزارهای تخصصی تحلیل و غلظت سایتوکاینها محاسبه میشود.
این روش در تحقیقات ایمونولوژی، مطالعات بالینی و غربالگری بیماریهای التهابی کاربرد گستردهای دارد. از جمله میتوان به پروفایلسازی سایتوکاینها در بیماریهای خودایمنی، پایش پاسخ به درمان در سرطانها و مطالعات واکسیناسیون اشاره کرد. با این حال، هزینه نسبتاً بالا و نیاز به تخصص کافی در تفسیر دادههای چندپارامتری از محدودیتهای این روش محسوب میشوند.
توسعههای اخیر در این فناوری منجر به ایجاد سیستمهای انعطافپذیرتر مانند Flex Sets شده است که امکان طراحی پانلهای سفارشی سایتوکاین را فراهم میکند. همچنین ترکیب این روش با فناوریهای جدیدتر مانند طیفسنجی جرمی، دقت و کارایی آن را به میزان قابل توجهی افزایش داده است
در مقابل، روش ICS امکان شناسایی و بررسی تولید سایتوکاینها در سطح یک سلول را فراهم میآورد. این روش به ویژه در مطالعات ایمونولوژی برای بررسی پاسخهای سلولهای T و سایر سلولهای ایمنی بسیار ارزشمند است. اساس این تکنیک بر مبنای مهار ترشح سایتوکاینها از سلول و سپس رنگآمیزی آنها با آنتیبادیهای فلورسنت اختصاصی استوار است.
مراحل انجام ICS با تحریک سلولها آغاز میشود. برای این کار معمولاً از محرکهایی مانند PMA (فوربول استر) همراه با یونومایسین یا آنتیژنهای خاص استفاده میشود که باعث فعال شدن سلولها و شروع تولید سایتوکاینها میگردد. همزمان با تحریک، از مهارکنندههای ترشح مانند برفلدین A یا موننسین استفاده میشود که با اختلال در دستگاه گلژی، از خروج سایتوکاینها از سلول جلوگیری میکنند و آنها را در سیتوپلاسم و شبکه آندوپلاسمی تجمع میدهند.
پس از دوره تحریک (معمولاً 4-6 ساعت)، سلولها با استفاده از فرمالدهید تثبیت میشوند. این مرحله برای حفظ ساختار سلولی و جلوگیری از تخریب آنتیژنها ضروری است. سپس با استفاده از محلولهای حاوی ساپونین، غشای سلولی نفوذپذیر میشود تا آنتیبادیها بتوانند به سایتوکاینهای درون سلولی دسترسی پیدا کنند. در این مرحله، آنتیبادیهای اولیه اختصاصی علیه سایتوکاینهای مورد نظر که با فلوروکرومهای مختلف نشاندار شدهاند، به سلولها اضافه میشوند.
پس از دوره انکوباسیون و شستشو، سلولها توسط فلوسایتومتری آنالیز میشوند. در این مرحله میتوان همزمان با بررسی بیان سایتوکاینها، فنوتایپ سلولها را نیز با استفاده از مارکرهای سطحی مورد بررسی قرار داد. این ویژگی منحصر به فرد ICS، امکان شناسایی دقیق جمعیتهای سلولی تولیدکننده سایتوکاینهای خاص را فراهم میآورد.
از مزایای مهم این روش میتوان به حساسیت بالا، امکان بررسی همزمان چندین سایتوکاین و مارکرهای سطحی، و توانایی مطالعه پاسخهای ایمنی در سطح تک سلولی اشاره کرد. این تکنیک به ویژه در مطالعات تمایز سلولهای T کمکی (Th1، Th2، Th17) بررسی پاسخ به واکسنها و مطالعات بیماریهای خودایمنی کاربرد گستردهای دارد.
با این حال، روش ICS چالشهایی نیز دارد که از جمله میتوان به نیاز به کنترل دقیق شرایط آزمایش، امکان ایجاد تغییرات در فنوتایپ سلولی در اثر تحریک، و پیچیدگی در تفسیر دادهها اشاره کرد. برای دستیابی به نتایج قابل اعتماد، انجام کنترلهای مناسب از جمله نمونههای بدون تحریک و استفاده از کنترلهای ایزوتیپ ضروری است.
توسعه فلوروکرومهای جدید و پیشرفت در فناوری فلوسایتومتریها، دقت و کارایی روش ICS را به طور قابل توجهی افزایش داده است. امروزه با استفاده از فلوسایتومتری های پیشرفته، امکان بررسی همزمان 10-15 پارامتر مختلف در این روش فراهم شده است که دید جامعتری از پاسخهای ایمنی سلولی ارائه میدهد
چالشهای این روش شامل پدیده Hook Effect در غلظتهای بسیار بالا، تداخل آنتی بادیها و ناپایداری برخی سایتوکاینها میباشد که با راهکارهایی مانند رقیقکردن نمونه، استفاده از آنتی بادیهای با کیفیت و شرایط نگهداری مناسب نمونهها قابل حل هستند. در مقایسه با روشهای سنتی مانند الایزا، فلوسایتومتری مزایای قابل توجهی از جمله چندپارامتری بودن، سرعت بالا در پردازش نمونههای زیاد و نیاز به حجم کم نمونه را ارائه میدهد.
به طور کلی، فلوسایتومتری با ترکیب قابلیتهای کمی و کیفی، ابزاری ضروری در تحقیقات ایمونولوژی، مطالعات سرطان و بررسی بیماریهای التهابی محسوب میشود. این تکنیک با فراهم آوردن امکان بررسی همزمان فنوتایپ سلولی و پروفایل سایتوکاینها، درک جامعتری از مکانیسمهای ایمنی و پاتولوژیک ارائه میدهد.
همچنین بخوانید:




