مقدمهای بر القای دیابت در جوندگان
دیابت شیرین یک اختلال متابولیک مزمن است که با افزایش مداوم قند خون به دلیل نقص در ترشح انسولین، عملکرد انسولین یا هر دو مشخص میشود.این بیماری به طور کلی به دو نوع اصلی طبقهبندی میشود:
- دیابت نوع ۱ (T1D)، یک بیماری خودایمنی که منجر به تخریب سلولهای بتای پانکراس میشود
- دیابت نوع ۲ (T2D) که با مقاومت به انسولین و کاهش عملکرد سلولهای بتا مشخص میشود.
در هر دو شکل، پیامدهای متابولیک شامل هایپرگلیسمی، دیسلیپیدمی، استرس اکسیداتیو و التهاب مزمن است که همگی در طولانیمدت باعث عوارضی مانند نفروپاتی، نوروپاتی و بیماریهای قلبی عروقی می شوند.
مدل های حیوانی دیابت به طور گسترده در تحقیقات پیش بالینی جهت شبیه سازی بیماری انسانی و دسترسی به نحوه پیشرفت بیماری و درمان مورد استفاده قرار می گیرند.
موشهای کوچک آزمایشگاهی و موش های صحرایی (رتها) به دلیل قابلیت ردیابی ژنتیکی، شباهت فیزیولوژیکی به انسان برای شبیه سازی و تولید حیوان مدل بیماری مناسب هستند. از جمله رایجترین روش های مورد استفاده، میتوان به القای شیمیایی با استفاده از استرپتوزوتوسین (STZ) و مدلهای القا شده با رژیم غذایی همراه با STZ برای شبیهسازی جنبههای مختلف دیابت نوع 1 و دیابت نوع 2 اشاره کرد.
نحوه القا بیماری دیابت در موش سوری و موش صحرایی (رت)
دیابت نوع ۱ ناشی از استرپتوزوتوسین (STZ)
استرپتوزوتوسین یک ترکیب نیتروزواوره طبیعی است که از استرپتومایسس آکروموژنز مشتق شده است.به دلیل سمیت انتخابی آن بر روی سلولهای بتای پانکراس، خواص دیابتوژنیک قوی از خود نشان میدهد.پس از تجویز سیستمیک، STZ عمدتاً از طریق ناقل گلوکز ۲ (GLUT2) وارد سلولهای بتا میشود.
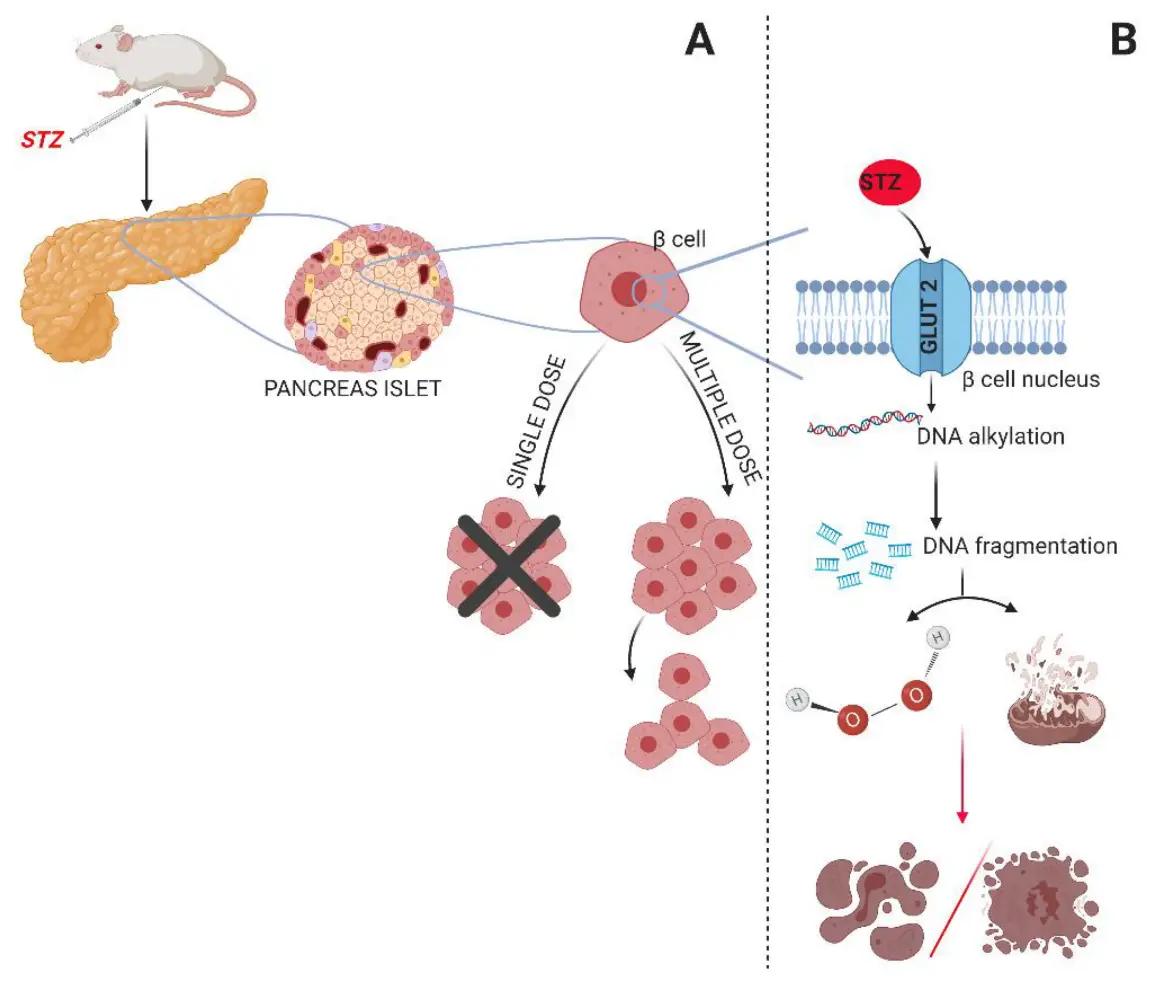
پس از ورود، باعث آلکیلاسیون DNA میشود که منجر به قطعه قطعه شدن گسترده DNA و فعال شدن پلی (ADP-ریبوز) پلیمراز (PARP) میشود. این امر NAD+ و ATP سلولی را تخلیه میکند و در نهایت منجر به نکروز سلولهای بتا میشود.
علاوه بر سمیت ژنتیکی، STZ گونههای فعال اکسیژن (ROS) و رادیکالهای اکسید نیتریک تولید میکند که به غشاهای میتوکندری و اندامکهای درون سلولهای بتا آسیب بیشتری وارد میکنند. تخریب این سلولهای تولیدکننده انسولین منجر به کمبود انسولین و متعاقباً افزایش قند خون میشود که دقیقاً مشابه دیابت نوع 1 در انسان است.
پروتکل معمول شامل یک دوز بالا (مثلاً 60-70 میلیگرم بر کیلوگرم) به صورت داخل صفاقی در موشهای صحرایی یا موش سوری، یا به طور جایگزین، استفاده از دوز های پایین تر برای چند روز متوالی(مثلاً 40 میلیگرم بر کیلوگرم هروز، و به مدت 5 روز)است.مدل تک دوز باعث نکروز سریع سلولهای بتا میشود و برای مطالعه عوارض دیابت در حالت late-stage است.
در حالی که مدل چند دوزی برای مطالعات دیابت ناشی از خودایمنی و و برای بررسی وقایع اولیه در انسولیت و آپوپتوز سلولهای بتا مورد استفاده قرار گرفته است.طی ۴۸ تا ۷۲ ساعت پس از تجویز STZ، حیوانات دچار هیپرگلیسمی پایدار، پرنوشی، پرخوری، کاهش وزن و گلیکوزوری(افزایش گلوگز در ادرار) میشوند.
سطح گلوکز خون معمولاً در موشهای کوچک آزمایشگاهی (موش سوری) از ۲۵۰ میلیگرم در دسیلیتر و در موشهای صحرایی از ۳۰۰ میلیگرم در دسیلیتر فراتر میرود. بررسی بافتشناسی، تخریب سلولهای بتا، آتروفی جزایر لانگرهانس و نفوذ تکهستهایها را در جزایر لانگرهانس پانکراس نشان میدهد.
محققان اغلب دیابت را از طریق قند خون ناشتا، آزمایش تحمل گلوکز و سنجش انسولین تأیید میکنند.این مدل به طور گسترده برای ارزیابی درمانهای جایگزینی انسولین، پیوند جزایر لانگرهانس، بازسازی سلولهای بتا و مکانیسمهای آسیب اکسیداتیو و التهابی در بیماری دیابت استفاده میشود.
با این حال، سمیت سلولی STZ محدود به پانکراس نیست؛ همچنین میتواند بر کلیهها و کبد تأثیر بگذارد، که نیاز به بهینهسازی دقیق دوز و نظارت بر حیوانات دارد.
رژیم غذایی پرچرب همراه با دوز پایین STZ (مدل دیابت نوع ۲)
برای شبیهسازی دیابت نوع 2، که شامل مقاومت به انسولین، هایپرانسولینمی و اختلال عملکرد جزئی سلولهای بتا میشود، محققان اغلب از رژیم غذایی پرچرب (HFD) همراه با دوز پایین استرپتوزوتوسین (STZ) استفاده میکنند.
این مدل، پیشرفت دیابت نوع 2 در انسان را شبیه سازی میکند، که در آن رژیم غذایی نامناسب و چاقی منجر به مقاومت به انسولین می شود.در ابتدا، جوندگان به مدت ۴ تا ۶ هفته با یک رژیم غذایی پرچرب، که معمولاً ۴۵ تا ۶۰ درصد کالری آن از چربی تشکیل میشود، تغذیه میشوند.
این رژیم غذایی باعث افزایش وزن، کبد چرب، اختلال در چربی خون و مقاومت به انسولین میشود. با افزایش مقاومت به انسولین، سلولهای بتای پانکراس با تولید بیش از حد انسولین این کمبود را جبران میکنند که منجر به استرس سلولی و مستعد شدن سلول ها به آسیب می شود.
پس از این دوره استرس متابولیک، دوز پایینی از STZ (مثلاً 25 تا 40 میلیگرم بر کیلوگرم به صورت داخل صفاقی) تجویز میشود تا به طور انتخابی عملکرد سلولهای بتا را بدون تخریب کامل، مختل کند.
نتیجه، مدلی است که هم ترشح انسولین مختلشده و هم مقاومت به انسولین در بافتهای محیطی را نشان میدهد؛ یعنی همان پاتوفیزیولوژی دارای نقص دوگانه که در دیابت نوع ۲ انسان دیده میشود. هایپرگلیسمی (افزایش قند خون) معمولاً ظرف چند روز ایجاد میشود و بسته به شدت آسیب به سلولهای β بتا و حساسیت سویه، در سطوح متوسط (بین ۲۰۰ تا ۳۵۰ میلیگرم در دسیلیتر) پایدار میماند.
از نظر بافتشناسی، این مدل از دست دادن جزئی سلولهای بتا، بزرگ شدن جزایر لانگرهانس، تجمع چربی در کبد و هیپرتروفی آدیپوسیتها در بافت چربی سفید را نشان میدهد.
از نظر بیوشیمیایی، حیوانات سطح گلوکز و انسولین ناشتا بالایی و و پروفایلهای لیپیدی تغییر یافته (سطح بالای تری گلیسیرید،کلسترول و LDL) را نشان میدهند. مشخصات التهابی نیز تغییر میکند و سطح TNF-α، IL-6 و CRP در گردش خون افزایش مییابد.
این مدل به طور گسترده برای ارزیابی داروهای خوراکی کاهنده قند خون (مانند متفورمین، آنالوگهای GLP-1 و مهارکنندههای (DPP-4 و همچنین داروهای ضدالتهاب، مداخلات سبک زندگی و درمانهای تغذیهای استفاده میشود.
نقطه قوت این مدل در توانایی آن برای شبیهسازی مراحل ابتدایی پیشدیابت، پیشرفت تدریجی مقاومت به انسولین، و اختلال عملکرد سلولهای β نهفته است؛ که یک سیستم پویا برای مطالعه شروع دیابت نوع ۲ و مداخلات درمانی فراهم میکند.
با این حال، پیچیدگی این مدل نیازمند کنترل دقیق ترکیب رژیم غذایی، زمانبندی و دوز STZ (استرپتوزوتوسین) است. علاوه بر این، باید به تفاوتهای واکنش بین سویههای حیوانی توجه شود تا تکرارپذیری و قابلیت تفسیر نتایج تضمین شود.
دیابت نوع 1 القا شده توسط آلوکسان در جوندگان
یکی دیگر از روشهای کلاسیک و پرکاربرد برای القای دیابت نوع ۱ در جوندگان آزمایشگاهی (موش صحرایی و موش سوری)، تجویز آلوکسان مونوهیدرات، یک مشتق اوره که سمیت سلولی خاصی را نسبت به سلولهای بتای پانکراس نشان میدهد، است. دیابت القا شده توسط آلوکسان، ویژگیهای اساسی دیابت شیرین وابسته به انسولین (IDDM)، از جمله تخریب انتخابی سلولهای بتا، هیپوانسولینمی و هایپرگلیسمی مداوم را در حیوان مدل به وجود می آورد و به عنوان جایگزین یا مکمل مدل استرپتوزوتوسین (STZ) عمل میکند.
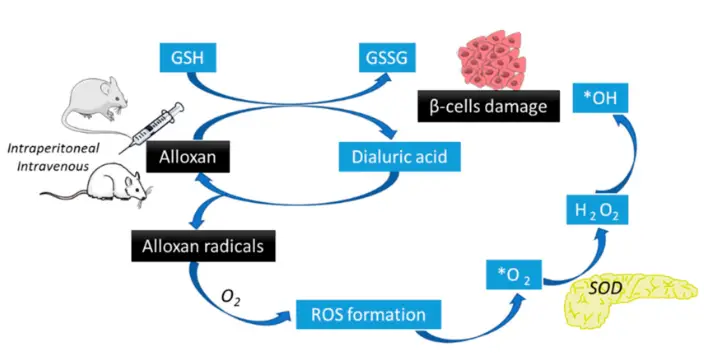
اثر دیابتزایی آلوکسان عمدتاً از طریق تولید گونههای فعال اکسیژن (ROS) انجام میشود.
پس از تزریق آلوکسان به جریان خون، این دارو به سرعت توسط ناقلهای GLUT2 سلولهای بتای پانکراس، جذب میشود.
در داخل سلول بتا، آلوکسان تحت چرخه ردوکس قرار میگیرد و با تیولهای درون سلولی (بهویژه گلوتاتیون احیا شده) واکنش میدهد و منجر به تولید رادیکالهای سوپراکسید، پراکسید هیدروژن و رادیکالهای هیدروکسیل میشود.
این گونههای فعال اکسیژن (ROS) باعث آسیب اکسیداتیو به لیپیدها، پروتئینها و اسیدهای نوکلئیک میشوند که منجر به اختلال عملکرد میتوکندری، آسیب شبکه آندوپلاسمی و در نهایت مرگ سلولی آپوپتوز یا نکروز میشود.
علاوه بر این، آلوکسان آنزیم گلوکوکیناز را که برای سنجش گلوکز و ترشح انسولین در سلولهای بتا ضروری است، مهار میکند. آلوکسان با اختلال در فسفوریلاسیون گلوکز، سنتز و ترشح انسولین را حتی قبل از تخریب سلولهای بتا مختل میکند.
اثر ترکیبی استرس اکسیداتیو و اختلال متابولیک منجر به از دست دادن سریع و برگشتناپذیر ظرفیت تولید انسولین میشود که معمولاً ظرف ۲۴ تا ۴۸ ساعت پس از تزریق بروز میکند.
دوز استاندارد آلوکسان برای القای دیابت بین ۱۲۰ تا ۲۰۰ میلیگرم بر کیلوگرم است که به صورت داخل صفاقی یا داخل وریدی تجویز میشود.
با این حال، اثربخشی آلوکسان به دوز، گونه حیوان و حتی شرایط محیطی مانند وضعیت ناشتا و هیدراتاسیون بسیار حساس است. برای کاهش نفروتوکسیسیته و جلوگیری از مرگ و میر زودرس، حیوانات اغلب به مدت ۱۲ تا ۱۶ ساعت قبل از تجویز آلوکسان ناشتا نگه داشته میشوند و سپس به مدت ۲۴ ساعت پس از تزریق، محلول ۵٪ گلوکز به صورت خوراکی یا در آب آشامیدنی به آنها داده میشود تا از شوک هیپوگلیسمی ناشی از انفجار اولیه انسولین ناشی از آسیب سلولهای بتا جلوگیری شود.
در عرض ۲ تا ۳ روز، علائم دیابت، از جمله هایپرگلیسمی قابل توجه، کاهش وزن، پرخوری، پرنوشی و گلیکوزوری، ظاهر میشوند.
در تجزیه و تحلیل بافتشناسی بافت پانکراس، معمولاً جزایرلانگرهانس کوچک شده یا آتروفیک، ناپدید شدن سلولهای بتا و نفوذ سلولهای التهابی را نشان میدهد. سطح گلوکز خون مشابه مدل STZ،اغلب در موشهای سوری از 250 میلیگرم در دسیلیتر و در موشهای صحرایی از 300 میلیگرم در دسیلیتر فراتر میرود.
دیابت القا شده توسط آلوکسان به طور گسترده برای ارزیابی انسولین درمانی، مطالعه بهبود زخم دیابتی و مدلسازی عوارضی مانند رتینوپاتی و نفروپاتی استفاده میشود.
در مقایسه با STZ، آلوکسان کمی ناپایدارتر است و نیاز به حمل و نقل دقیق و استفاده فوری پس از تهیه محلول دارد.
القا مدل دیابت با آلوکسان زمانی که محققان نیاز به بررسی مکانیسم های استرس اکسیداتیو را دارند مناسب است. این مدل بینشهای ارزشمندی در مورد پاتوژنز دیابت نوع ۱ ناشی از خودایمنی و ناشی از مواد شیمیایی ارائه میدهد و به طور قابل توجهی در توسعه رویکردهای مدرن مبتنی بر انسولین و سلول درمانی نقش داشته است.
نتیجه گیری
مدلهای حیوانی دیابت، نقش مهمی در پیشبرد درک ما از پاتوفیزیولوژی، پیشرفت و درمان دیابت نوع 1 و نوع 2 ایفا کردهاند.
این مدلها از طریق تخریب هدفمند یا سرکوب عملکرد سلولهای بتای پانکراس،یا با فراهم کردن شرایطی که منجر به مقاومت به انسولین می شود (مشابه آنچه در بدن انسان در اثر عادات بد غذایی اتفاق می افتد)، بستری مناسب جهت مطالعه این بیماری فراهم می آورند.
همچنین بخوانید:
- خدمات القا انواع بیماری و ایجاد حیوان مدل
- دوره کارآموزی کار با حیوانات آزمایشگاهی
- خرید انواع رت و موش آزمایشگاهی




