مقدمهای بر القای سرطان در موشهای کوچک آزمایشگاهی و رت
موشهای صحرایی (Rattus norvegicus) و موشهای آزمایشگاهی (Mus musculus) بهطور گسترده به عنوان مدلهای پیشبالینی برای مطالعه زیستشناسی سرطان، آزمایش داروها و ارزیابی راهبردهای درمانی مورد استفاده قرار میگیرند. القای سرطان در این حیوانات به محققان این امکان را میدهد که پیشرفت تومور را شبیهسازی کرده، مکانیسمهای مولکولی را بررسی کنند و مداخلات درمانی را توسعه دهند.
روشهای مختلفی برای القای سرطان وجود دارد که شامل استفاده از کارسینوژنهای شیمیایی، اصلاحات ژنتیکی، زنوگرافتها و انکوژنز ویروسی میشود. هر یک از این روشها دارای پروتکلهای مشخص، مخاطرات و ملاحظات اخلاقی هستند که نیازمند مدیریت دقیق میباشند.
این مقاله راهنمای جامعی از روشهای مختلف القای سرطان، پروتکلها، مخاطرات، ابزارهای موردنیاز، نحوه مراقبت از حیوانات و ملاحظات پس از القای سرطان ارائه میدهد.
روشهای القای سرطان
سرطان در جوندگان آزمایشگاهی از طریق روشهای شیمیایی، ژنتیکی، ویروسی یا پیوندی القا میشود. انتخاب روش به اهداف تحقیق، نوع سرطان و ملاحظات اخلاقی بستگی دارد.
سرطانزایی شیمیایی
- کارسینوژنهای شیمیایی از طریق ایجاد جهشهای DNA باعث القای سرطان شده و فرآیند تومورزایی را آغاز و تسریع میکنند.
A. کارسینوژنهای رایج مورد استفاده
|
کارسینوژن |
اندام/سیستم هدف |
روش تجویز |
|
DMBA (7,12-Dimethylbenz[a]anthracene) |
پستان، پوست، حفره دهانی |
خوراکی، موضعی، داخل صفاقی |
|
MCA (Methylcholanthrene) |
پوست، بافتهای نرم |
تزریق زیرجلدی |
|
N-Methyl-N-nitrosourea (MNU) |
پستان، کولون، مثانه |
داخل صفاقی، داخل وریدی |
|
Azoxymethane (AOM) |
کولون |
داخل صفاقی |
|
Benzo[a]pyrene |
ریه، کبد، پوست |
خوراکی، استنشاقی |
|
Diethylnitrosamine (DEN) |
کبد |
خوراکی، داخل صفاقی |
B. پروتکل سرطانزایی شیمیایی
آمادهسازی:
- کارسینوژن باید در هود شیمیایی و با تجهیزات محافظتی مناسب آماده شود.
- دوز مناسب بر اساس وزن حیوان و اندام هدف تومور تعیین شود.
روش تجویز:
- خوراکی: مخلوط با غذا یا از طریق گاواژ تجویز میشود.
- داخل صفاقی (IP): تزریق با استفاده از سرنگ با گیج 27-30 انجام میشود.
- کاربرد موضعی: برای سرطانهای اپیتلیالی مستقیماً روی پوست اعمال میشود.
- در معرض قرارگیری استنشاقی: نیازمند محفظههای تخصصی است.
پایش رشد تومور:
- حیوانات بهصورت هفتگی از نظر کاهش وزن، اندازه تومور و تغییرات رفتاری پایش میشوند.
- رشد تومور با استفاده از کولیس یا روشهای تصویربرداری (MRI، CT و بیولومینسانس) اندازهگیری میشود.
C. مخاطرات و اقدامات احتیاطی
- ریسکهای سمی: کارسینوژنهای شیمیایی برای انسان جهشزا و سرطانزا هستند.
- آلودگی محیطی: رعایت پروتکلهای سختگیرانه برای دفع مواد ضروری است.
اقدامات ایمنی در هنگام کار:
- استفاده از هود ایمنی زیستی.
- پوشیدن دستکش دولایه، روپوش آزمایشگاهی و محافظ صورت.
- نگهداری مواد در محیطهای دارای تهویه مناسب و محافظتشده از نور.
مدلهای مهندسی ژنتیکی (GEMs)
اصلاح ژنتیکی امکان القای دقیق تومور در بافتهای خاص را فراهم میکند.
A. روشهای رایج GEM
|
روش |
ژن هدف |
نوع سرطان |
|
ترانسژنیک (بیان بیشازحد انکوژن) |
MYC، RAS، TP53 |
پستان، ریه، پانکراس |
|
ناکاوت (حذف ژن سرکوبکننده تومور) |
p53، PTEN، BRCA1 |
کولون، پروستات |
|
سیستم Cre-LoxP |
KRAS، PIK3CA |
ریه، مغز |
|
ویرایش ژنی CRISPR-Cas9 |
ژنهای سفارشی |
انواع مختلف سرطان |
B. پروتکل القای سرطان ژنتیکی
پرورش موشهای ترانسژنیک:
- موشها برای حمل انکوژنها یا حذف ژنهای سرکوبکننده تومور پرورش داده میشوند.
انتقال ویروسی (واردسازی/حذف ژن):
- تزریق ویروسهای آدنوویروس یا لنتیویروس حامل انکوژن به اندامهای هدف انجام میشود.
القا و پایش تومور:
- موشها بهطور خودبهخود یا پس از یک محرک القایی (تاموکسیفن، داکسیسایکلین) دچار تومور میشوند.
- پیشرفت بیماری با استفاده از روشهای هیستوپاتولوژی، تصویربرداری یا نشانگرهای زیستی خونی ارزیابی میشود.
C. مخاطرات و اقدامات احتیاطی
- ریسک رشد غیرقابلکنترل تومور: نیازمند اجرای دقیق دستورالعملهای اتانازی است.
- ملاحظات اخلاقی: اصلاحات ژنتیکی ممکن است عوارض جانبی پیشبینینشدهای ایجاد کند.
اقدامات ایمنی:
- حفظ شرایط نگهداری استریل.
- رعایت کنترلهای دقیق در فرآیند پرورش.
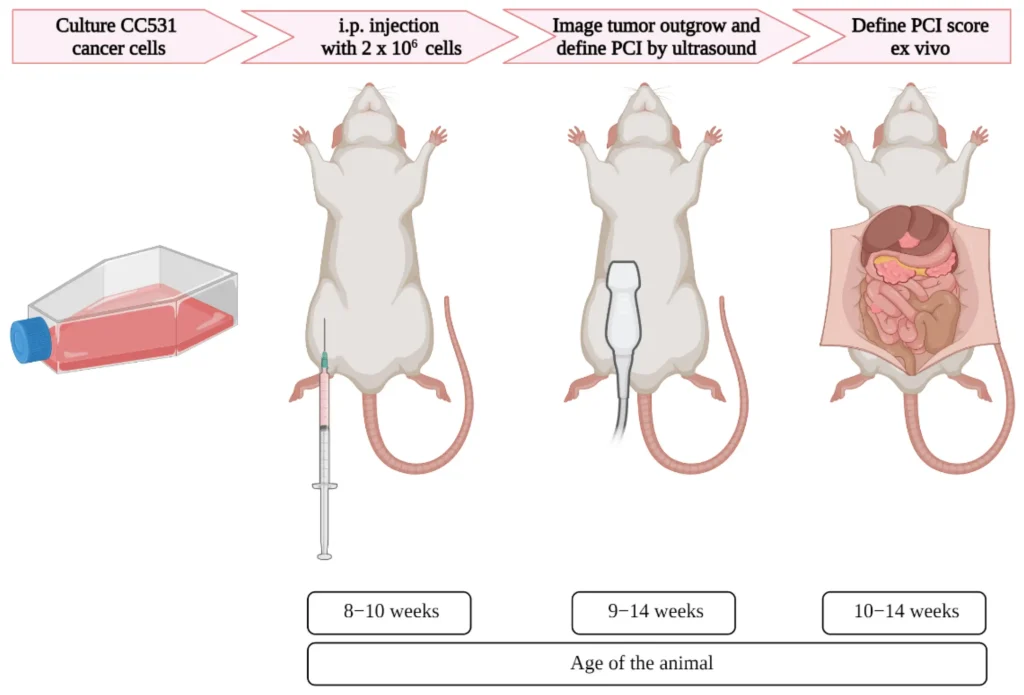
تزریق سلولهای توموری (زنوگرافت و آلوگرافت)
در این روش، سلولهای توموری به جوندگان آزمایشگاهی تزریق میشوند.
A. انواع تزریق سلولهای توموری
|
روش |
نوع سلول |
محل تزریق |
نوع سرطان |
|
زنوگرافت و آلوگراف زیرجلدی |
سلولهای سرطانی انسانی و سلول های سرطانی موشی |
پهلو (تزریق زیرجلدی) |
تومورهای جامد (پستان، پروستات) |
|
تزریق اورتوتوپیک |
سلولهای توموری جوندگان یا انسان |
اندام خاص |
ریه، مغز، پانکراس |
|
تزریق داخل وریدی (ورید دمی) |
سلولهای توموری در گردش |
تزریق IV |
مدلهای متاستاتیک |
|
تزریق داخل کبدی/طحالی |
سرطانهای کبد یا خون |
تزریق در اندام |
کارسینوم هپاتوسلولار |
B. پروتکل تزریق سلولهای توموری
آمادهسازی سلولهای توموری:
- سلولهای توموری در شرایط in vitro کشت داده شده، در مرحله رشد لگاریتمی برداشت شده و در PBS یا Matrigel معلق میشوند.
روش تزریق:
- زیرجلدی (SC): تزریق سلولها در ناحیه پهلو (۰.۱ تا ۰.۲ میلیلیتر).
- داخل قلبی/کبدی: نیاز به راهنمایی با اولتراسوند یا تصویربرداری دارد.
ارزیابی رشد تومور:
- بهصورت هفتگی با استفاده از کولیس و تصویربرداری بیولومینسانس اندازهگیری میشود.
- پایش علائم کاشکسی، درد و زخم شدن تومور انجام میشود.
C. مخاطرات و اقدامات احتیاطی
- ریسک نشت تومور: برای جلوگیری از آلودگی، باید از هود ایمنی زیستی استفاده شود.
- مشکلات مرتبط با پاسخ ایمنی: در زنوگرافتهای انسانی نیاز به ایمونوساپرسنتها است.
اقدامات ایمنی:
- استفاده از سرنگها و سوزنهای استریل.
- رعایت محدودیت بار توموری برای اجرای اتانازی.
سرطانزایی ویروسی
برخی از ویروسهای انکوژنیک میتوانند برای القای سرطان در جوندگان استفاده شوند.
A. نمونههایی از ویروسهای انکوژنیک
|
ویروس |
نوع سرطان |
روش تحویل |
|
ویروس پاپیلومای انسانی (HPV-16/18) |
سرطان گردن رحم |
داخل واژنی |
|
ویروس میمونی ۴۰ (SV40) |
مغز، کلیه |
تزریق داخل جمجمهای |
|
آدنوویروس- Myc |
کارسینوم کبدی |
تزریق داخل وریدی |
|
رتروویروسها |
لوکمی، سارکوم |
تزریق داخل وریدی یا داخل صفاقی |
B. پروتکل سرطانزایی ویروسی
آمادهسازی ویروس:
- ویروس در کشت سلولی تکثیر داده میشود قبل از اینکه به حیوان تزریق شود.
تزریق به بافت هدف:
- تزریق داخل وریدی یا داخل صفاقی انجام میشود.
- تحویل اختصاصی اندام برای سرطانهای هدفگذاری شده.
پایش توسعه تومور:
- نیاز به ایمونوهیستوشیمی و تحلیل PCR دارد.
C. مخاطرات و اقدامات احتیاطی
- ریسک ایمنی زیستی: استفاده از BSL-2 containment ضروری است.
- رشد غیرقابل پیشبینی تومور: نیاز به پایش طولانیمدت دارد.
مراقبت از حیوانات پس از القای سرطان
1. مدیریت درد:
- Buprenorphine (۰.۰۵-۰.۱ میلیگرم/کیلوگرم زیرپوستی هر ۱۲ ساعت)
- Meloxicam (۱-۲ میلیگرم/کیلوگرم زیرپوستی هر ۲۴ ساعت)
2. محدودیتهای بار توموری:
- اگر وزن بدن کمتر از 10% کاهش یابد یا زخمها ایجاد شوند، نیاز به اتانازی دارد.
پروتکل اتانازی:
- استنشاق CO₂ + جابجایی گردن (تایید شده توسط AVMA).
نتیجهگیری
القای سرطان در جوندگان آزمایشگاهی نیازمند پروتکلهای دقیق، پایش دقیق و ملاحظات اخلاقی است. انتخاب کارسینوژنها، مدلهای ژنتیکی، تزریق سلولهای توموری یا سرطانزایی ویروسی بستگی به اهداف تحقیق دارد. مهارتهای جراحی مناسب، اقدامات ایمنی زیستی و مراقبتهای انسانی بهطور همزمان رفاه حیوانات و اعتبار تحقیقات را تضمین میکنند.
همچنین بخوانید:
- خدمات القا انواع بیماری و ایجاد حیوان مدل
- دوره کارآموزی کار با حیوانات آزمایشگاهی
- خرید انواع رت و موش آزمایشگاهی




سلام،می خواستم درباره ی القای سرطان به حیوانات از طریق تزریق زیرجلدی بپرسم.
جهت مشاوره رایگان با ما تماس بگیرید
چطور میتونم یک موش را دچار بیماری سرطان کنم
با روش های مختلفی امکان پذیر است. جهت مشاوره رایگان با ما تماس بگیرید