مقدمهای بر القای التهاب سیستمیک کبد در جوندگان
التهاب کبد که در پاسخهای التهابی سیستمیک نقش دارد، یک ویژگی کلیدی در بسیاری از بیماریهای حاد و مزمن مانند سپسیس، استئاتوهپاتیت غیرالکلی (NASH)، هپاتیت خودایمنی و بیماریهای کبدی کلستاتیک است.
کبد، به عنوان یک اندام ایمونولوژیک مرکزی، نقش مهمی در حس کردن، پردازش و تقویت سیگنالهای التهابی سیستمیک ایفا میکند.
کبد به دلیل خونرسانی دوگانه (از ورید باب و شریان کبدی)، مستقیماً در معرض محصولات میکروبی مشتق شده از روده، واسطههای التهابی در گردش و متابولیتهای غذایی قرار دارد.
این امر کبد را به شدت مستعد آسیبهای ناشی از سیستم ایمنی میکند. برای مطالعه پاتوفیزیولوژی پیچیده التهاب سیستمیک مرتبط با کبد، مدلهای جوندگان – به ویژه موش های سوری و موشهای صحرایی – به دلیل شباهت ژنتیکی، اندازه قابل کنترل و پیشینه اثباتشده در تحقیقات ایمونولوژیکی و کبدی، به طور گسترده مورد استفاده قرار میگیرند.چندین روش برای القای التهاب سیستمیک کبد در داخل بدن حیوان مدل(in vivo) توسعه داده شدهاند.
پرکاربردترین روش های القای التهاب سیستمیک
هر روش شرح داده شده در این بررسی، مسیر منحصر به فردی از آسیب را معرفی میکند، چه از طریق فعالسازی سیستم ایمنی، آسیب اکسیداتیو، استرس متابولیک یا انسداد جریان صفرا.
۱. التهاب ناشی از لیپوپلیساکارید (LPS)
از جمله مدلهای شناختهشده التهاب سیستمیک کبد، استفاده از لیپوپلیساکارید (LPS)، یک اندوتوکسین قوی مشتق شده از غشای خارجی باکتریهای گرم منفی، است. وقتی LPS به جوندگان تزریق میشود، به سرعت سیگنالینگ ایمنی ذاتی را از طریق گیرنده Toll-like 4 (TLR4) فعال میکند، که این گیرنده به مقدار زیاد در ماکروفاژهای ساکن کبد که به عنوان سلولهای کوپفر شناخته میشوند، بیان میشود.
این فعالسازی، آبشاری از سیگنالینگ درون سلولی را آغاز میکند که منجر به رونویسی و آزادسازی سیتوکینهای پیشالتهابی، از جمله فاکتور نکروز تومور آلفا (TNF-α)، اینترلوکین-6 (IL-6) و اینترلوکین-1 بتا (IL-1β) میشود. کبد هم هدف و هم منبع این پاسخ التهابی میشود.
پس از تجویز LPS سلول های کوپفر اولین سلول های پاسخ دهنده هستند ،که LPSپس از اتصال به گیرنده های سلول های کوپفر مسیر سیگنالینگ مربوط به NF-κB را فعال کرده وبعد از چند ساعت طوفان سایتوکاینی به راه می افتد.
این پاسخ باعث القای پروتئینهای فاز حاد در سلولهای کبدی، تغییر نفوذپذیری عروق و ایجاد استرس اکسیداتیو در بافت کبد میشود. نتیجه آن آسیب سلولهای کبدی، افزایش سطح ترانسآمینازها ALT و AST و در موارد شدید، نکروز کبدی است.
۲. التهاب مزمن کبدی ناشی از تتراکلرید کربن (CCl₄)
یکی دیگر از مدلهای کلاسیک التهاب سیستمیک کبد، مبتنی بر قرار گرفتن مکرر در معرض تتراکلرید کربن (CCl₄)، یک ماده شیمیایی هپاتوتوکسیک است که از طریق آسیب اکسیداتیو باعث آسیب مزمن کبدی میشود.
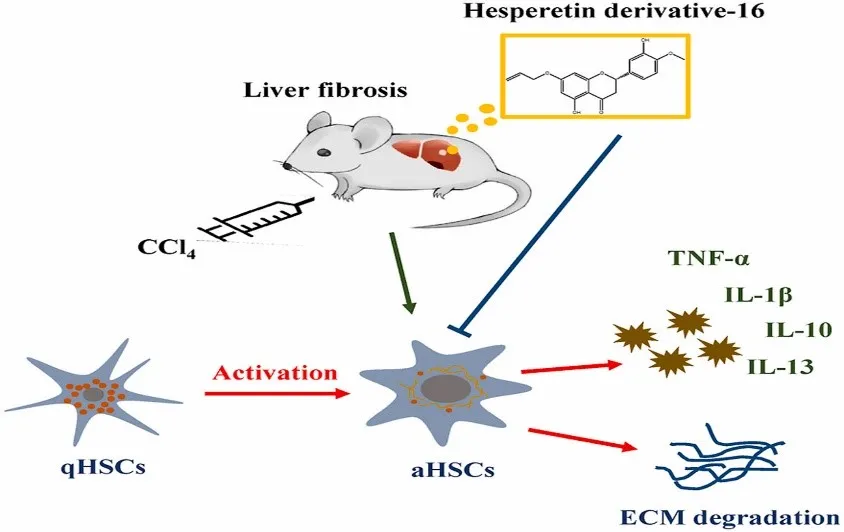
پس از تجویز، CCl₄ توسط آنزیمهای سیتوکروم P450 به ویژه CYP2E1 در سلولهای کبدی متابولیزه میشود و منجر به تولید رادیکالهای تریکلرومتیل و تریکلرومتیل پراکسی میشود. این گونههای بسیار واکنشپذیر، پراکسیداسیون لیپیدی غشاهای سلولهای کبدی را آغاز میکنند و در نهایت منجر به آسیب سلولی، نکروز و آزاد شدن محتویات داخل سلولی به پارانشیم اطراف میشوند.
این موج اولیه آسیب منجر به فعال شدن سلولهای کوپفر و سلولهای ستارهای کبدی (HSCs) میشود.
سلولهای کوپفر با آزاد کردن سیتوکینها و کموکینهای التهابی واکنش نشان میدهند، در حالی که سلولهای بنیادی خونساز (HSCs) به سلولهای شبه میوفیبروبلاست تبدیل میشوند که اجزای ماتریکس خارج سلولی را ترشح میکنند. این فرآیند منجر به فیبروز میشود که با رسوب پیشرونده کلاژن در پارانشیم کبد مشخص میشود. با گذشت زمان، این بازسازی فیبروتیک باعث التهاب بیشتر شده و عملکرد کبد را به خطر میاندازد.
از نظر سیستمیک، این التهاب مزمن کبدی باعث افزایش مداوم واسطههای التهابی در گردش خون میشود.
بعد از پیشرفت بیماری کبد بیمار، علائمی همچون بیماری کبد الکلی یا هپاتیت ویروسی نشان می دهد.
وافزایش سطح ALT، AST و بیلیروبین نشاندهنده اختلال عملکرد سلولهای کبدی و کلستاز است. سلولهای التهابی که از گردش خون به کار گرفته میشوند، درگیری سیستمیک را بیشتر تقویت میکنند و برخی از حیوانات ممکن است در مدلهای طولانیمدت، علائمی از فشار خون بالا در ورید باب کبدی، بزرگی طحال و تحلیل رفتن سیستمیک را نشان دهند.
برخلاف مدل LPS که نشاندهنده آسیب سیستمیک حاد است، آسیب ناشی از CCl₄ برای مدلسازی بیماری مزمن کبدی ارزشمند است. محققان اغلب از این مدل برای آزمایش ترکیبات ضد فیبروتیک، بررسی پیشرفت استئاتوهپاتیت یا مطالعه تعامل بین فیبروز کبدی و التهاب سیستمیک استفاده میکنند. برای توسعه کامل آسیبشناسی مزمن، مواجهه مکرر طی ۴ تا ۸ هفته مورد نیاز است.
۴. بستن مجرای صفراوی (BDL) به عنوان مدلی از التهاب کلستاتیک کبد
بستن مجرای صفراوی (BDL) یک مدل جراحی است که برای شبیهسازی بیماریهای کلستاتیک کبد مانند کلانژیت اسکلروزان اولیه (PSC) و کلانژیت صفراوی اولیه (PBC) استفاده میشود.این تکنیک شامل انسداد فیزیکی جریان صفرا از کبد با بستن و قطع مجرای صفراوی مشترک از طریق جراحی است.
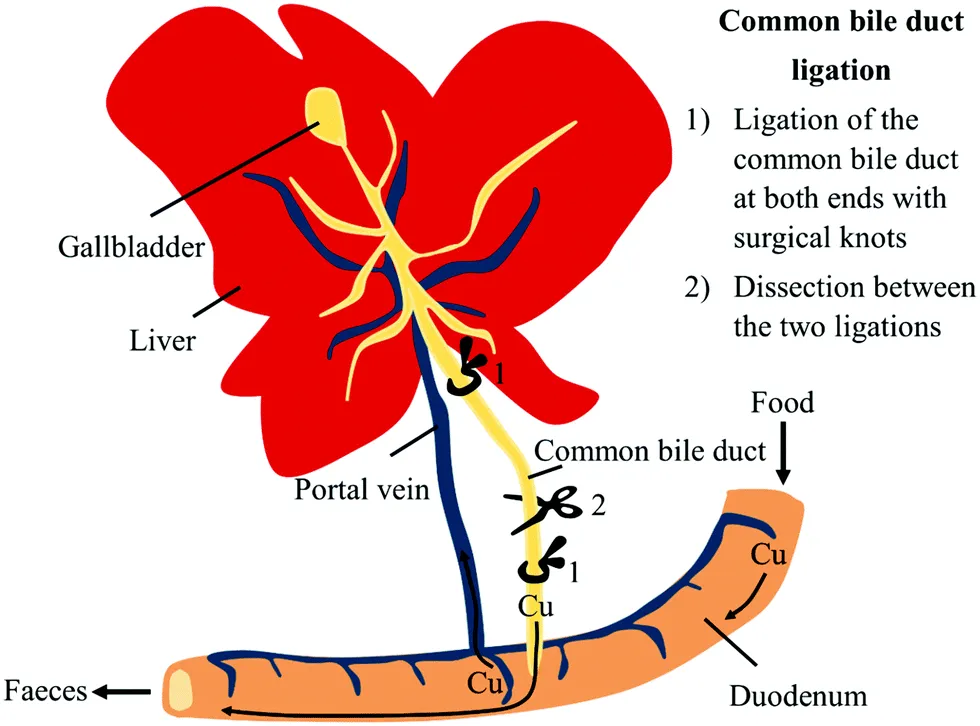
تجمع اسیدهای صفراوی داخل کبدی حاصل، آبشاری از پاسخهای سمی، التهابی و فیبروژنیک را آغاز میکند.بلافاصله پس از مسدود شدن جریان صفرا، اسیدهای صفراوی و سایر متابولیتهای سمی در کبد تجمع مییابند. این مواد به عنوان الگوهای مولکولی مرتبط با آسیب عمل میکنند و فعال شدن سلولهای کوپفر، کلانژیوسیتها و سلولهای ستارهای کبدی را تحریک میکنند.
پاسخ التهابی موضعی با افزایش بیان IL-6، TNF-α و پروتئین جذبکننده شیمیایی مونوسیت-1 (MCP-1) مشخص میشود که مونوسیتها و نوتروفیلها را بیشتر به بافت کبدی جذب میکند. این سلولهای التهابی در آسیب سلولهای کبدی، تکثیر مجاری صفراوی و مراحل اولیه فیبروز نقش دارند.
از نظر سیستمیک، تأثیر BDL از طریق آزادسازی مداوم سیتوکینهای التهابی به گردش خون، افزایش بیلیروبین سرم،افزایش آلکالین فسفاتاز (ALP) و ترانسآمینازها مشهود است. جوندگان همچنین علائم زردی، خارش و کاهش وزن را نشان میدهند که شبیه ویژگیهای بالینی بیماری کلستاتیک کبد در انسان است.
در این روش بیماری به صورت مزمن القا خواهد شد و با گذشت زمان باعث فیبروز پیشرونده، سیروز و در مدلهای شدید، انسفالوپاتی کبدی میشود. مدل BDL به طور گسترده برای مطالعه بیماریهای کلستاتیک، فیبروز صفراوی و برای آزمایش داروهای محافظتکننده کبد، تعدیلکنندههای اسید صفراوی و درمانهای ضد فیبروتیک استفاده میشود. با وجود تهاجمی بودن، این مدل همچنان یکی از مدلهای فیزیولوژیکی مرتبط با التهاب کبد با پیامدهای سیستمیک است.
۵. التهاب کبدی ناشی از کلرید کادمیوم (CdCl₂)
کلرید کادمیوم (CdCl₂) یک ترکیب فلزی سنگین است که به دلیل اثرات سمشناسی آن بر کبد و توانایی آن در القای پاسخهای التهابی سیستمیک، به طور گسترده مورد مطالعه قرار گرفته است. کادمیوم یک آلاینده محیطی غیرضروری و بسیار سمی است که عمدتاً از طریق غذا، آب آلوده یا مواجهه شغلی وارد بدن میشود.
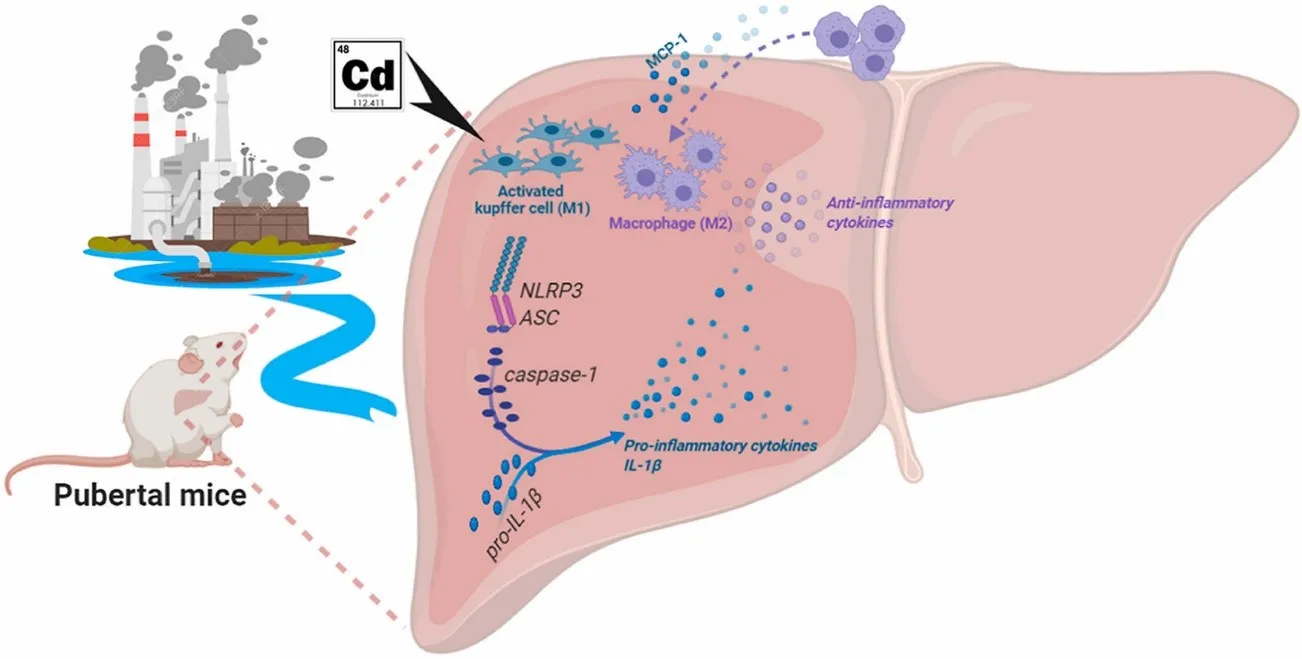
در مدل های جوندگان، تزریق وریدی یا درون صفاقی کلرید کادمیوم باعث القای آسیب کبدی ، التهاب و سمیت سیستمیک می شود.و این روش یک روش قدرتمند برای بررسی اثرات فلزات سنگین دربیماری کبدی است.
به دلیل نقش کبد در سم زدایی و رگ زایی، بعد از تجویز کلرید کادمیوم به حیوان مدل، یون های کادمیوم در کبد تجمع پیدا می کند.کادمیوم پس از ورود به سلولهای کبدی و کوپفر، مسیرهای سلولی متعددی را مختل میکند. یکی از مکانیسمهای اصلی آن تولید گونههای فعال اکسیژن (ROS) است که باعث آسیب اکسیداتیو به لیپیدها، پروتئینها و DNA میشود.
کادمیوم به خودی خود از نظر اکسیداسیون-احیا فعال نیست، اما به طور غیرمستقیم با کاهش سطح گلوتاتیون درون سلولی و مهار آنزیمهای آنتیاکسیدانی مانند سوپراکسید دیسموتاز (SOD) و کاتالاز، استرس اکسیداتیو را افزایش میدهد. عدم تعادل حاصل منجر به پراکسیداسیون لیپیدی غشاهای هپاتوسیت، اختلال عملکرد میتوکندری و فعال شدن مسیرهای مرگ سلولی میشود.
همزمان، کادمیوم در عملکرد پروتئینهای تنظیمکننده فلزات، بهویژه متالوتیونینها، که یونهای کادمیوم را در بافت کبد متصل و جدا میکنند، اختلال ایجاد میکند.
با این حال، این ظرفیت جداسازی محدود است و اضافه بار کادمیوم در نهایت منجر به آزادسازی کنترل نشده یونهای آزاد کادمیوم میشود و اثرات سمی را تشدید میکند.
آسیب به هپاتوسیتها و فعال شدن مسیرهای سیگنالینگ استرس، یک پاسخ التهابی قوی را تحریک میکند. سلولهای کوپفر و مونوسیت ها، مقادیر زیادی از سیتوکینهای پیشالتهابی مانند TNF-α، IL-1β و IL-6 تولید میکنند که نه تنها به صورت موضعی بر کبد تأثیر میگذارند، بلکه وارد گردش خون سیستمیک نیز میشوند و به التهاب گسترده کمک میکنند.
از نظر بافتشناسی، آسیب کبدی ناشی از کادمیوم با تورم سلولهای کبدی، نکروز، دژنراسیون واکوئلی و نفوذ نوتروفیلها و سلولهای تک هستهای در نواحی پورتال و پارانشیم مشخص میشود.بسته به دوز و مدت زمان مواجهه، این مدل میتواند هم التهاب حاد کبدی و هم سمیت نیمه مزمن را با پیامدهای سیستمیک مانند تغییر پارامترهای هماتولوژیک، آسیب کلیوی و التهاب ریه منعکس کند.
کلرید کادمیوم معمولاً به صورت داخل صفاقی در دوزهای بین ۱ تا ۴ میلیگرم بر کیلوگرم در موشهای سوری یا موشهای صحرایی تجویز میشود. اثرات آن وابسته به دوز و زمان است و آسیب حاد در عرض ۲۴ تا ۷۲ ساعت مشاهده میشود. محققان اغلب آنزیمهای کبدی سرم ALT، AST، نشانگرهای استرس اکسیداتیو MDA، GSH و سطح سیتوکینها را برای نظارت بر میزان التهاب و آسیب بافتی ارزیابی میکنند.
یکی از ویژگی های مهم کلریدکادمیوم عملکرد چندگانه آن است : در حالی که کبد هدف اصلی است، کادمیوم بر کلیهها، ریهها و اندامهای تولید مثل نیز تأثیر میگذارد. بنابراین، نظارت سیستمیک و نظارت اخلاقی هنگام استفاده از این مدل ضروری است. با این وجود، ظرفیت آن در ایجاد التهاب کبد با پیامدهای سیستمیک، کلرید کادمیوم را به یک عامل قوی برای مدلسازی بیماریهای کبدی تبدیل میکند.
مدلهای جوندگان التهاب سیستمیک کبد به طور قابل توجهی به درک ما از ایمونوبیولوژی کبدی و بیماریهای التهابی سیستمیک کمک کردهاند. این مدلها با شبیهسازی اشکال مختلف آسیب کبدی – از اندوتوکسمی حاد گرفته تا کلستاز مزمن یا سمیت فلزات سنگین – بینشی در مورد چگونگی ایجاد، تکامل و تأثیر التهاب کبدی بر بقیه بدن ارائه میدهند.
همچنین بخوانید:
- خدمات القا انواع بیماری و ایجاد حیوان مدل
- دوره کارآموزی کار با حیوانات آزمایشگاهی
- خرید انواع رت و موش آزمایشگاهی




