اطلاعات عمومی,ویکی ژن
آپتامر چیست؟ نحوه ساخت و کاربرد
مقدمهای بر آپتامر ها
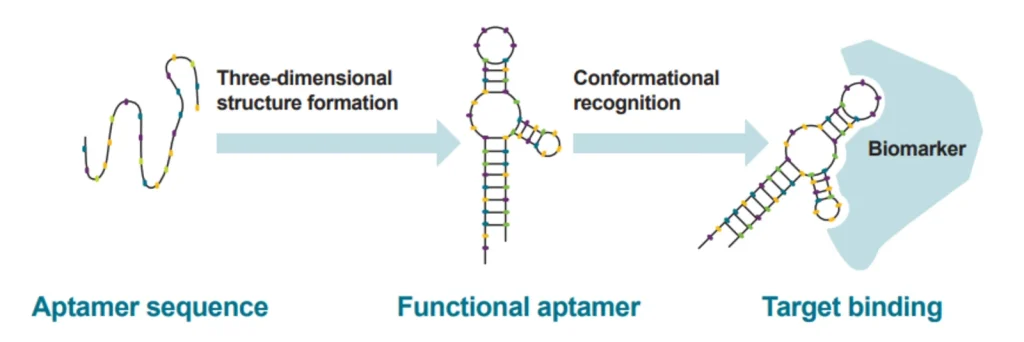
آپتامرها متشکل از توالیهایی از نوکلئوتید یا پپتیدها هستند که میتوانند محل خاصی را روی مولکول هدف متصل کنند. ویژگی آنها با آنتی بادیها رقابت میکند و کاربردهای تشخیصی و درمانی بسیار متفاوتی دارند.
آپتامرهای الیگونوکلئوتیدی از توالیهای کوتاهی از نوکلئوتیدها ساخته میشوند. آپتامرهای پپتیدی توالی پپتیدی کوتاهی هستند که روی یک ماتریس پروتئینی بزرگتر نمایش داده میشوند. مزیت اصلی هر دو نوع نسبت به آنتی بادیها این است که میتوان آنها را در یک لوله آزمایش، یعنی بدون تکثیر ردههای سلولی، ساخت.
ساخت و استفاده از آپتامرها
آپتامرهای الیگونوکلئوتیدی را میتوان در شرایط آزمایشگاهی از طریق فرآیندی به نام تکامل سیستماتیک لیگاندها با غنی سازی نمایی (SELEX) که اولین بار در سال 1990 ظهور کرد، تولید کرد.
یک کتابخانه بزرگ از اولیگونوکلئوتیدها در معرض لیگاند هدف قرار میگیرد و توالیهایی که به هدف متصل میشوند توسط PCR تکثیر میشوند.
این روش تولید نسبتا ساده و ارزان، مزایای قابل توجهی نسبت به آنتی بادیها دارد. از آنجایی که به جای تولید ردههای سلولی به سنتز شیمیایی متکی است، همچنین بسیار قابل تکرار است و ثبات محصول را تضمین میکند.
یکی دیگر از مزایای سنتز شیمیایی این است که آپتامرها به راحتی میتوانند برای جلوگیری از تخریب توسط آنزیمها و حفظ یکپارچگی در بدن، طراحی شوند. آنها همچنین ممکن است در درمانهای هدفمند و کنترل انتشار دارو در یک مکان خاص مفید باشند. برخلاف آنتیبادیها، آنها هیچ تعاملی با سیستم ایمنی ندارند، بنابراین احتمال بروز پاسخ ایمنی پیچیده بسیار کمتر است. در حال حاضر، درمانهای آپتامر بهدلیل استقرار آنتیبادیها در شرکتهای داروسازی، عموماً نواحی خاص را هدف قرار میدهند.
از سال 2015، تنها آپتامر تایید شده برای استفاده توسط FDA، Macugen است، یک آپتامر RNA که فاکتور رشد اندوتلیال عروقی را هدف قرار میدهد، تنظیم کننده مهمی که باعث رگزایی میشود و در بسیاری از سرطانها بیش از حد بیان میشود. با این حال، بسیاری دیگر نیز در حال توسعه هستند، به عنوان مثال، یک آپتامر با کاربردهای درمانی NOX-A12 که آپتامر RNA در فاز II آزمایشات بالینی است و به CCL2 متصل میشود. این هدف یک سایتوکین مهم در تنظیم رگزایی و پاسخ ایمنی در برخی سرطانها از جمله لنفوم غیر هوچکین و لوسمی لنفوسیتی مزمن است.
حسگرهای زیستی مبتنی بر آپتامر در مقایسه با آپتامرهای درمانی کاربرد وسیعتری در تشخیص نشان دادهاند. نمونهها شامل آپتامرهای DNA مبتنی بر سالمونلا تیفی موریوم و کانامایسین برای استفاده در نظارت بر ایمنی مواد غذایی است. سایر کاربردهای تشخیصی شامل نظارت بر نمونههای آبی و تشخیص سموم است.
با توسعه فناوری آپتامر، امیدواریم کاربردهای درمانی و تشخیصی بیشتری شناسایی شود. به خصوص از آنجایی که بسیاری از آپتامرهای درمانی فاز I و II کارآزماییهای بالینی را تکمیل کردهاند، ممکن است در سالهای آینده شاهد داروهای مبتنی بر آپتامر بیشتری باشیم.
مسائل و پیشرفتهای اخیر
درک پیکربندی بهینه آپتامرها برای اتصال هدف در زمینه بیولوژیکی، زمینه مهمی است که آپتامرها را میتوان بهبود بخشید. افزایش فراهمی زیستی برای اطمینان از اینکه آپتامرها میتوانند به عنوان درمانهای موثر در آینده عمل کنند، ضروری است.
این فراهمی زیستی کم به این دلیل است که آپتامرهای تولید شده توسط SELEX، دارای مکانیکهای اتصال متفاوتی در هنگام تولید با داخل بدن است. مشکل دیگر SELEX این است که میتواند زمان بر باشد و میزان موفقیت کمتری دارد و آن را به یک فرآیند نسبتا ناکارآمد تبدیل میکند.
یکی از روشهای افزایش فراهمی زیستی، محدود کردن renal filtration است. این کار با کانژوگه کردن آپتامرها با نانومواد بزرگ انجام میشود، به عنوان مثال، افزودن پلی اتیلن گلایکول (PEG) وزن مولکولی آپتامر را بیش از آستانه فیلتراسیون (40 کیلو دالتون) افزایش میدهد.
Macugen از این تکنیک برای افزایش فراهمی زیستی در خون و زمان استفاده میکند. PEGylation همچنین هیچ پاسخ ایمنی ناخواستهای ایجاد نکرد. افزایش جرم همچنین میتواند حساسیت آنها را به نوکلئازها کاهش دهد و تجمع سم را کاهش دهد.
بهبود طراحی کتابخانه اولیه میتواند ضایعات را در مرحله تولید کاهش دهد. افزودن نوکلئوتیدهای مصنوعی اصلاح شده میتواند مقاومت در برابر نوکلئازها را بهبود بخشد و میل اتصال را افزایش دهد. آنها همچنین تنوع کتابخانه و نرخ موفقیت را افزایش میدهند، زیرا نوکلئوتیدهای اضافی، تنظیمات اتصال و ترکیبهای الیگونوکلئوتیدی بیشتری را ممکن میسازند.
یکی دیگر از جنبههای محدود کننده، به دست آوردن آپتامرهای با میل ترکیبی بالا است که اغلب بیش از 10 دور SELEX مورد نیاز است. نوعی تکنیک ابتکاری که به نام الکتروفورز (NECEEM) شناخته میشود و با هدف کاهش تعداد دورها انجام میشود.
کتابخانه آپتامر به همراه ناحیه هدف انکوبه میشود تا زمانی که به تعادل برسند. میزان حرکات مختلف در الکتروفورز اجازه میدهد تا آپتامرهای متصل از آپتامرهای آزاد جدا شوند که میتواند آپتامرهای با میل ترکیبی بالا را در دورهای بسیار کم تولید کند. استفاده از تکنیکهای نوآورانه مانند این موارد و شناسایی زمینههای بهبود به بهینهسازی تولید و کاربرد آپتامرها کمک میکند. این موضوع باعث میشود که آپتامرها امری مهم در توسعه درمانی آینده باشند.
افزایش فراهمی زیستی باعث بهبود اثربخشی آپتامرها در کاربردهای درونی بدن میشود، در حالی که بهبود تولید، سرعت تحقیق و توسعه را افزایش میدهد و اجازه میدهد تمرکز بر روی بیماریها و مناطق تشخیصی برای استفاده از آپتامر قرار گیرد.
همچنین بخوانید:
- لنفوم هوچکین (Hodgkin Lymphoma) چیست؟ علائم، تشخیص، انواع، پیشگیری و درمان
- لوسمی لنفوسیتی حاد (ALL یا Acute Lymphocytic Leukemia)
- لوسمی لنفوسیتی مزمن (Chronic Lymphocytic Leukemia) چیست؟
- آنتی بادی (Antibody) چیست؟
مترجم: معصومه قریبی ششده