اطلاعات عمومی,ویکی ژن
آنتی بادی (Antibody) چیست؟
مقدمهای بر آنتی بادی
آنتی بادیها پروتئینهای بزرگ و Y شکل هستند. آنها توسط سیستم ایمنی برای شناسایی و خنثی کردن اجسام خارجی مانند باکتریها و ویروسها به کار گرفته میشوند.
سیستم ایمنی هومورال (Humoral immune system)
هر آنتی بادی دارای یک هدف منحصر به فرد است که به عنوان آنتی ژن (antigen) موجود بر روی ارگانیسم مهاجم شناخته میشود. این آنتی ژن مانند کلیدی است که به آنتی بادی در شناسایی ارگانیسم کمک میکند. این پدیده به این دلیل رخ میدهد که هم آنتی بادی و هم آنتی ژن ساختار مشابهی را در نوک ساختار “Y” شکل خود دارند.
همان طور که هر قفلی یک کلید دارد، آنتی بادی نیز یک کلید آنتی ژنی دارد. هنگامی که کلید در قفل قرار میگیرد، آنتی بادی فعال شده و هدف خود را علامت گذاری یا خنثی میکند. تولید آنتی بادیها وظیفه اصلی سیستم ایمنی هومورال است.
آنتی بادیها و ایمونوگلوبولینها (immunoglobulins)
ایمونوگلوبولینها اساسا پروتئینهایی هستند که به عنوان آنتی بادی عمل میکنند. اصطلاحات آنتی بادی و ایمونوگلوبولین اغلب به جای یکدیگر استفاده میشوند.
ایمونوگلوبولینها در خون و سایر بافتها و مایعات یافت میشوند. آنها توسط سلولهای پلاسما که از سلولهای B سیستم ایمنی مشتق شده اند، ساخته میشوند. سلولهای B سیستم ایمنی هنگامی که با اتصال یک آنتی ژن خاص روی سطوح آنتی بادی فعال میشوند، به سلولهای پلاسما تبدیل میگردند. در برخی موارد، برهمکنش سلول B با یک سلول کمکی T نیز ضروری است.
آنتی بادیها و آنتی ژنها
آنتی ژنها به طور کلاسیک به عنوان هر ماده خارجی که باعث ایجاد پاسخ ایمنی میشود، تعریف میشوند. به آنها ایمونوژن (immunogens) نیز میگویند. ناحیه خاصی روی یک آنتی ژن که آنتی بادی آن را میشناسد و به آن متصل میشود، اپی توپ (epitope) یا تعیین کننده آنتی ژنی نامیده میشود.
یک اپی توپ معمولا از یک زنجیره بلند 5-8 اسید آمینهای در سطح پروتئین ساخته شده است. زنجیره اسیدهای آمینه به شکل ساختار دو بعدی وجود ندارد بلکه به صورت یک ساختار سه بعدی ظاهر میشود.
یک اپی توپ تنها ممکن است به شکلی که در محلول وجود دارد یا به شکل سه بعدی اصلی آن شناسایی شود. اگر اپی توپ روی یک زنجیره پلی پپتیدی منفرد وجود داشته باشد، یک اپی توپ پیوسته (continuous) یا خطی (linear) است. آنتی بادی ممکن است فقط به قطعات یا بخشهای دناتوره شده یک پروتئین یا به پروتئین پایه بومی متصل شود.
انواع آنتی بادیها و ساختار آنها
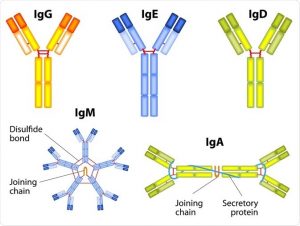
سرم حاوی آنتی بادیهای اختصاصی آنتی ژن، آنتی سرم (antiserum) نامیده میشود. پنج دسته از ایمونوگلوبولینها شامل IgM، IgG، IgA، IgD و IgE وجود دارد.
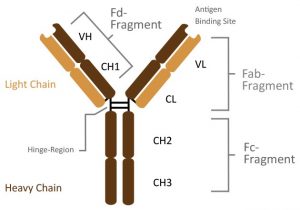
ساختار اصلی همه آنتیبادیها یکسان است. چهار زنجیره پلی پپتیدی وجود دارد که توسط پیوندهای دی سولفیدی به هم متصل میشوند. این چهار زنجیره پلی پپتیدی یک ساختار مولکولی متقارن را تشکیل میدهند.
دو نیمه یکسان با محلهای اتصال آنتی ژن بین انتهای زنجیرههای سنگین و سبک در هر دو طرف وجود دارد. یک لولا در مرکز و بین زنجیرهای سنگین وجود دارد تا پروتئین انعطاف پذیری داشته باشد. دو زنجیره سبک با یکدیگر یکسان هستند. آنها حاوی حدود 220 اسید آمینه میباشند. در حالی که زنجیرههای سنگین دارای 440 اسید آمینه هستند.
دو نوع زنجیره سبک در بین تمام کلاسهای ایمونوگلوبولین وجود دارد: یک زنجیره لامبدا (lambda chain) و یک زنجیره کاپا (kappa chain). هر دو این زنجیرهها از نظر عملکرد مشابه هستند. هر نوع ایمونوگلوبولین دارای یک نوع زنجیره سنگین متفاوت است.
عملکرد
آنتیبادی به آنتی ژنهای خاص متصل میشود. این اتفاق به سلولهای دیگر سیستم ایمنی سیگنال میدهد تا از شر میکروبهای مهاجم خلاص شوند. قدرت اتصال بین آنتی بادی و آنتی ژن در یک محل اتصال واحد به عنوان تمایل آنتی بادی به آنتی ژن شناخته (antibody’s affinity for the antigen) میشود. میل ترکیبی بین آنتی بادی و محل اتصال آنتی ژن بر اساس نوع پیوند ایجاد شده تعیین میشود.
از آن جایی که یک آنتی ژن میتواند چندین اپی توپ مختلف داشته باشد، تعدادی از آنتی بادیها میتوانند به پروتئین متصل شوند. هنگامی که دو یا چند محل اتصال آنتی ژن یکسان هستند، یک آنتی بادی میتواند پیوند قوی تری با آنتی ژن ایجاد کند.
فرمهای آنتی بادی
آنتیبادیها یا ایمونوگلوبولینها به اشکال مختلفی وجود دارند. بر اساس تفاوت در توالی اسیدهای آمینه در ناحیه ثابت زنجیرههای سنگین، آنها اغلب به پنج کلاس طبقه بندی میشوند. این پنج کلاس موارد زیر هستند:
- IgG – حاوی زنجیره سنگین گاما (gamma)
- IgM – حاوی زنجیره سنگین مو (mu)
- IgA – حاوی زنجیره سنگین آلفا (alpha)
- IgD – حاوی زنجیره سنگین دلتا (delta)
- IgE – حاوی زنجیره سنگین اپسیلون (epsilon)
زیر کلاس (ساب کلاس) های آنتی بادیها
هر یک از فرمها، تفاوت کمی در ناحیه ثابت زنجیره سنگین دارند. بر اساس این تفاوتها، Igs به زیر کلاسها طبقه بندی میشوند. این زیر کلاسها با ابزارهای سرولوژیکی شناسایی میشوند.
زیر کلاسها عبارتند از:
- IgG1 – زنجیرههای سنگین گاما 1
- IgG2 – زنجیرههای سنگین گاما 2
- IgG3 – زنجیرههای سنگین گاما 3
- IgG4 – زنجیرههای سنگین گاما 4
- زیر کلاسهای IgA
IgA1 – زنجیرههای سنگین آلفا 1
IgA2 – زنجیرههای سنگین آلفا 2
ایمونوگلوبولینها بر اساس نوع زنجیره سبکی که دارند، طبقه بندی میشوند. انواع زنجیره سبک نیز بر اساس تفاوت در توالی اسید آمینه در ناحیه ثابت زنجیره سبک تعیین میشود. دو نوع زنجیره سبک وجود دارد – زنجیرههای جانبی کاپا و لامبدا.
بر اساس زنجیرههای سبک، زیرگروههای دیگری نیز وجود دارد. به عنوان مثال زیرگروههای Lambda عبارتند از:
الف) لامبدا 1
ب) لامبدا 2
ج) لامبدا 3
د) لامبدا 4
IgG
این ها ساختارهای مونومری هستند که به صورت مولکولهای منفرد وجود دارند. این نوع از ایمونوگلوبینها، همه کاره ترین ایمونوگلوبولینها هستند و میتوانند تمام عملکردهای مولکولهای Ig را انجام دهند.
این ایمونوگلوبینها بزرگترین بخش در سرم را تشکیل داده و همچنین در فضاهای خارج عروقی نیز یافت میشود. این نوع تنها ایمونوگلوبولینی است که از جفت نیز عبور کرده و همچنین مولکولهایی به نام مکمل را ثابت میکند. این نوع به سلولها متصل شده و فاگوسیتوز را افزایش میدهد.
IgA
این ایمونوگلوبینها نیز ساختارهای مونومری هستند. آنها در ترشحات به صورت دایمر با زنجیره J یافت میشوند. IgA میتواند بدون تخریب در سراسر مخاط حرکت کند. این دومین Ig فراوان در سرم است. این کلاس اصلی Ig در ترشحات است، یعنی در اشک، بزاق، آغوز (شیر اولیه مادر)، مخاط و غیره و در ایمنی مخاطی مهم است. به سلولهای PMN و لنفوسیتها متصل میشود. به طور معمول مکمل را رفع نمیکند.
IgM
این ایمونوگلوبینها یک دومین اضافی روی زنجیرهmu (CH4) و پروتئین دیگری دارند که به صورت کووالانسی از طریق پیوند S-S متصل میشوند. این اشکال J به عنوان پلیمر وجود دارد.
معمولاً آنها پنتامرها یا خوشههای 5 تایی را تشکیل میدهند. این ایمونوگلوبولین اولین Ig است که توسط جنین ساخته میشود و همچنین سومین Ig فراوان در سرم است. مقادیر آن با مکملها تنظیم شده و یک Ig آگلوتینه کننده خوب است که منجر به از بین بردن میکروبها میشود. همچنین قادر است به برخی از سلولها را از طریق گیرندههای Fc متصل شود.
IgD
این ایمونوگلوبینها به صورت مونومر وجود دارند. سطح سرمی پایینی دارند. این نوع در درجه اول در سطح سلولهای B یافت میشود و به عنوان گیرنده آنتی ژنها عمل میکند. میزان آنها توسط مکملها تنظیم نمیشود.
IgE
این ایمونوگلوبینها به صورت مونومر ظاهر میشوند. این نوع کمترین Ig رایج در سرم است. آنها قبل از برهمکنش با آنتی ژنها به گیرندههای Fc روی بازوفیلها (basophils) و ماست سلها (mast cells) به شکل بسیار محکمی پیوند مییابند. بنابراین آنها در واکنشهای آلرژیک نقش دارند. این نوع در بیماریهای کرمی انگلی نیز نقش دارد.
آنتی بادیها در پزشکی
استفاده از آنتی بادی در تشخیص و درمان بیماری
آنتی بادیها به طور گسترده به عنوان ابزار تشخیصی در شکلهای مختلف استفاده میشوند. اصطلاحی که برای تستهای تشخیصی مبتنی بر آنتی بادی به کار میرود “ایمونواسی یا immunoassay” است. سنجشهای ایمنی مبتنی بر آنتیبادی، رایج ترین روشهای تشخیصی تأییدی بوده و سریع ترین فناوریهای رو به رشد برای آنالیز مولکولهای زیستی هستند.
ایمونواسیها (Immunoassays)
نمونههایی از ایمونواسی شامل تیتر آنتی بادیهای ضد ویروس Epstein-Barr یا بیماری لایم (Lyme) است که از خون تخمین زده میشود. در غیاب این آنتی بادیها، فرض بر این است که یا فرد آلوده به ویروس نیست یا عفونت “خیلی” قبل تر اتفاق افتاده است و سلولهای B که این آنتی بادیهای خاص را تولید میکنند، به طور طبیعی از بین رفته اند.
برای ایمونواسی، سطوح گروههای جداگانه ایمونوگلوبولینها با نفلومتری (nephelometry یا کدورت سنجی) اندازهگیری میشوند تا مشخصات آنتی بادی بیمار را مشخص کنند.
تست کومبس (Coombs test) همچنین برای غربالگری آنتی بادی در آماده سازی انتقال خون استفاده میشود. این آزمایش برای غربالگری آنتی بادی در زنان قبل از زایمان نیز استفاده میشود.
ایمونواسی در مولتیپل اسکلروزیس (multiple sclerosis)، پسوریازیس (psoriasis) و بسیاری از انواع سرطان از جمله لنفوم غیر هوچکین (non-Hodgkin’s lymphoma)، سرطان کولورکتال (colorectal cancer)، سرطان سر و گردن و سرطان سینه استفاده میشود.
در ادامه روش دیگر استفاده از آنتی بادیهای نشاندار رادیویی است که میتواند در تشخیص بیماریها نیز استفاده شود. این آنتی بادیهای نشاندار شده رادیویی برای تشخیص یا تشخیص کل سلولها، گیرندهها و آنزیمها استفاده میشود. همچنین سنجشهای ایمنی با برچسب آنزیمی نیز وجود دارد.
آنتی بادیهای مونوکلونال (Monoclonal antibodies)
در گذشته، بیشتر ایمونواسیها بر اساس آنتی سرمهای پلی کلونال گرفته شده از خرگوشهای ایمن شده بودند که با وجود داشتن آنتی ژنهای محدود، پاسخ ایمنی خوبی را ارائه میکردند. همان طور که در سال 1975 توسط Köhler و Milstein توضیح داده شد، این روش با ظهور آنتی بادیهای مونوکلونال تغییر کرد.
آنتی بادیهای مونوکلونال انقلابی را در استفاده از آنتی بادیها در درمان بیماریها به نام ایمونوتراپی (immunotherapeutics) ایجاد کردند. آنتی بادیهای مونوکلونال بخش بزرگی از این روش ایمونوتراپی شده اند.
پیشرفتهای اخیر
اطلاعات اخیر در رابطه با تشخیص مبتنی بر آنتی بادی، پیشرفتهایی را در اختصاصی بودن سنجش، فناوریهای تشخیص و حساسیت نشان میدهد. حساسیت و اختصاصی بودن بسته به اینکه آیا آنتی ژنی که باید اندازه گیری شود با آنتی ژن نشاندار شده برای تعداد محدودی از محلهای اتصال آنتی بادی رقابت میکند یا خیر تضمین میشود.
آنالیز فلوسایتومتری (Flow cytometric analysis)
یکی دیگر از فناوریهای جدید مهم با اهمیت ویژه در تشخیص، آنالیز فلوسایتومتری است. این روش از بسیاری از آنتی بادیهای مونوکلونال جدید علیه ساختارهای سطح سلولی مختلف استفاده کرده و به فلوسیتومتری در تشخیص سرطان خون کمک میکند. فلوسیتومتری همچنین اخیراً در پایش بیماری و در ارزیابی میزان پاسخ تومور به درمان استفاده شده است.
آماده سازی آنتی بادی تایید شده
از سال 2011، 35 آنتیبادی مونوکلونال توسط سازمان غذا و داروی ایالات متحده برای استفاده توسط انسان تایید شده است. برخی از این موارد عبارتند از:
- Muromonab-CD3 (OKT3) و دو مونوکلونال ضد CD3 انسانی: این آنتی بادی ها در پیشگیری از رد حاد پیوند عضو – به عنوان مثال پیوند کلیه – استفاده میشوند.
- Omalizumab (Xolair®) به IgE متصل میشود بنابراین از اتصال IgE به ماست سلها جلوگیری میکند. این آنتی بادی در آسم آلرژیک استفاده میشود.
- Infliximab (Remicade®) و adalimumab (Humira®) – این آنتی بادیها به (TNF-α) متصل شده و در آرتریت روماتوئید (rheumatoid arthritis) استفاده میشوند.
- Daclizumab (Zenapax®) – به گیرنده IL-2 که در سطح سلولهای T فعال شده قرار دارند، متصل میشود. این آنتی بادی برای جلوگیری از رد حاد کلیههای پیوندی و در لنفوم سلول T استفاده میشود.
- ریتوکسیماب (Rituximab) به CD20 متصل شده و در لنفوم غیر هوچکین استفاده میشود.
- هسپتین (Heceptin) در سرطان سینه متاستاتیک استفاده میشود.
آنتی بادیها در حین و قبل از زایمان
فاکتور رزوس (Rhesus factor) که به عنوان آنتی ژن رزوس D (RhD) نیز شناخته میشود، آنتی ژنی است که روی گلبولهای قرمز خون یافت میشود. وجود آنتی ژن باعث میشود فرد رزوس مثبت (Rh+) شده و عدم وجود آن فرد را رزوس منفی (Rh-) میکند.
در هنگام زایمان طبیعی، آسیب در زایمان یا عوارض دوران بارداری، خون جنین میتواند وارد سیستم مادر شود. در مورد مادر و کودک ناسازگار با Rh، ممکن است یک مادر Rh- نسبت به آنتی ژن Rh روی سلولهای خونی Rh+ کودک حساس شود. این امر ممکن است ادامه بارداری و هر حاملگی بعدی را در معرض خطر مرگ جنین به دلیل همولیز قرار دهد.
برای درمان از آنتیبادیهای Rho (ویژه آنتی ژن Rhesus D (RhD) انسانی) استفاده میشود. آنتی بادیهای ضد RhD به عنوان بخشی از یک رژیم درمانی قبل از تولد تجویز میشوند تا از ایجاد حساسیتی که ممکن است در زمانی که مادر رزوس منفی جنین رزوس مثبت داشته باشد ایجاد شود، جلوگیریکند.
آنتی بادیها در صنعت
آنتی بادیها همچنین در پیش بینیهای ساختاری استفاده میشوند. این اطلاعات برای مهندسی پروتئین، اصلاح میل اتصال آنتی ژن و شناسایی اپی توپ یک آنتی بادی معین استفاده میشود.
کریستالوگرافی اشعه ایکس (X-ray crystallography) یکی از روشهای رایج برای تعیین ساختار آنتی بادی است. با این حال، این روش یک روند دشوار است. روشهای محاسباتی جایگزین ارزانتر و سریعتری برای کریستالوگرافی ارائه میکنند اما دارای نتایج مبهم تری هستند.
بنابراین آنتی بادیها مولکولهایی هستند که میتوانند برای پیش بینی ساختار زیست مولکولها استفاده شوند. وب سرورهای آنلاین مانند “Web Antibody Modeling” (WAM) و “Prediction of Immunoglobulin Structure” (PIGS) مدلسازی محاسباتی مناطق متغیر آنتی بادی را امکان پذیر میکنند.
ساختار
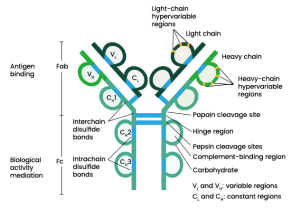
آنتیبادیها پروتئینهایی با وزن مولکولی حدود 150 کیلو دالتون هستند. آنها ساختار پایه مشابهی دارند که شامل چهار زنجیره پلی پپتیدی است که توسط پیوندهای دی سولفیدی به هم متصل میشوند. این چهار زنجیره پلی پپتیدی یک ساختار مولکولی متقارن را تشکیل میدهند. یک لولا در مرکز و بین زنجیرهای سنگین وجود دارد تا پروتئین انعطاف پذیری داشته باشد. دو نوع زنجیره وجود دارد:
- دو زنجیره سبک – حاوی حدود 220 اسید آمینه
- دو زنجیره سنگین – حاوی حدود 440 اسید آمینه
زنجیرههای سبک و سنگین
دو نوع زنجیره سبک در بین تمام کلاسهای ایمونوگلوبولین وجود دارد: یک زنجیره لامبدا و یک زنجیره کاپا. هر دو از نظر عملکرد مشابه هستند. هر نوع ایمونوگلوبولین دارای یک نوع زنجیره سنگین متفاوت است. بسته به نوع زنجیرههای سنگین آنها به پنج کلاس طبقه بندی میشوند.
سایر اجزای آنتی بادیها
به غیر از اسیدهای آمینه، مولکولهای قند نیز در آنتیبادیها وجود دارد. بنابراین آنتی بادیها گلیکوپروتئین هستند نه یک پروتئین تنها. ایمونوگلوبولینها به صورت مونومر (به عنوان مثال تنها یک واحد Ig) یا به صورت دیمر (دو مولکول، به عنوان مثال IgA) یا به عنوان تترامر (چهار مولکول به عنوان مثال teleost fish IgM) یا به صورت پنتامر (پنج مولکول به عنوان مثال در IgM پستانداران) وجود دارند.
قطعات ایمونوگلوبولین
قطعات ایمونوگلوبولین تولید شده توسط هضم پروتئولیتیک توسط آنزیمها اساس مطالعه روابط ساختاری و عملکردی هستند.
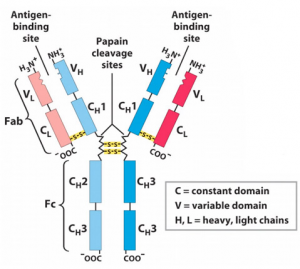
Fab
هنگامی که Ig با پاپائین (papain) تجزیه میشود، در ناحیه لولا قبل از پیوند دی سولفیدی بین زنجیره ای، H-H میشکند. این اتفاق منجر به تشکیل دو قطعه یکسان میشود که شامل زنجیره سبک و حوزههای VH (زنجیره سنگین متغیر) و CH1 (زنجیره سنگین ثابت) از زنجیره سنگین است. این قطعات پس از آن Fab نامیده میشوند زیرا حاوی محلهای اتصال آنتی ژن-آنتی بادی هستند. هر قطعه Fab یک ظرفیتی است.
Fc
هضم با پاپائین همچنین منجر به تشکیل قطعه ای میشود که شامل بقیه دو زنجیره سنگین است که هر کدام حاوی یک دامنه CH2 و CH3 است. این قطعه به راحتی متبلور میشود.
F(ab’)2
هنگامی که آنتیبادی با پپسین (pepsin) هضم میشود، Igs از قسمت زنجیره سنگین پس از شکسته شدن پیوندهای دی سولفیدی بین زنجیره ای
H-H، شکسته میشود. قطعات به دست آمده حاوی هر دو محل اتصال آنتی ژن هستند. این قطعه به دلیل دو ظرفیتی بودن F(ab’)2 نامیده شد. این قطعه میتواند به آنتی ژنها متصل شود اما منجر به عملکردهای موثری نمیشود.
دومینهای ایمونوگلوبولین
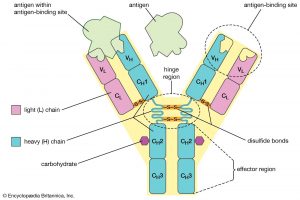
مونومر Ig یک مولکول “Y” شکل است. دارای چهار زنجیره پلی پپتیدی – دو “زنجیره سنگین” یکسان و دو “زنجیره سبک” یکسان – میباشد. پنج نوع زنجیره سنگین Ig پستانداران وجود دارد که با حروف یونانی نشان داده میشوند: α، δ، ε، γ و μ. این ها به ترتیب IgA، IgD، IgE، IgG و IgM را تشکیل میدهند.
Ig دارای یک پاراتوپ (paratope) در انتهای آمینه مونومر آنتی بادی است. این پاراتوپ در دومین های متغیر از زنجیرههای سنگین و سبک وجود دارد. دومین متغیر ناحیه FV است که مهم ترین ناحیه برای اتصال به آنتی ژنها میباشد. در این منطقه حلقه (لوپ) های متغیری از رشتههای β وجود دارد.
در زنجیره سبک سه حلقه VL و در زنجیره سنگین سه حلقه VH وجود دارد. این حلقهها مسئول اتصال به آنتی ژن هستند. از این حلقهها به عنوان مناطق تعیین کننده مکمل (CDRs) یاد میشود. به این CDRها idiotypes نیز میگویند.
پایه Y فعالیت سلولهای ایمنی را تعدیل میکند. این منطقه “منطقه Fc (Fragment یا قطعه، قابل تبلور یا crystallizable)” نامیده میشود. در این ناحیه دو زنجیره سنگین وجود دارد که بسته به کلاس آنتیبادی، دو یا سه دومین ثابت را تشکیل میدهند.
عملکرد
آنتی بادیها نقش مهمی در سیستم ایمنی دارند. ایمونوگلوبولینهای موجود در سطح لنفوسیت B سیگنالهایی را به انتخاب کنندههای سیتوپلاسمی و هسته ای ارسال میکنند. این آنتیبادیها همچنین آنتی ژن را به سلول میرسانند، جایی که میتوان آن را از بین برد، پردازش کرد و به سطح سلول بازگرداند تا توسط مولکولهای MHC کلاس II به سلولهای کمکی T اختصاصی آنتی ژن ارائه شود.
لنفوسیتهای T به نوبه خود سیگنالهایی را به سلولهای B ارسال میکنند تا بالغ شدع و آنتی ژنها را شناسایی کنند و همچنین آنتیبادیهایی را که به طور خاص علیه آن هدف قرار میگیرند را ایجاد کنند.
پاسخ ایمنی هومورال (Humoral immune response)
آنتی بادیهای ترشح شده توسط لنفوسیتهای B مسئول پاسخ ایمنی هومورال هستند. سیستم ایمنی هومورال به از بین بردن پاتوژنهای خارجی کمک کرده و از گسترش عفونتهای داخل سلولی جلوگیری میکند. این سیستم ایمنی ما را در برابر سموم نیز محافظت میکند.
عملکردهای مختلف قسمتهای مختلف آنتی بادی
دو بخش ساختاری آنتی بادی، یعنی قطعه متغیر (Fab) و قطعه ثابت (Fc)، عملکردهای بیولوژیکی متمایزی را ایجاد میکنند.
این عملکردها به شرح زیر هستند:
عملکردهای با واسطه Fab:
- تشخیص آنتی ژن – یکی از عملکردهای اصلی ناحیه Fab، تشخیص آنتی ژن است. سیستم ایمنی تعداد زیادی آنتی بادی تولید میکند که میتواند تقریباً تمام آنتی ژنهای ممکن موجود در پاتوژنها و محصولات آنها را تشخیص دهد. این آنتی ژنها ممکن است بر روی میکروبهای مهاجم مانند باکتریها، ویروسها و انگلها و همچنین آنتی ژنهای محیطی باشند. آنتیبادیها را میتوان علیه همه انواع مولکولها از جمله کربوهیدراتها، اسیدهای نوکلئیک و فسفولیپیدها تولید کرد اما برای اتصال به پروتئینها مناسبتر هستند.
- خنثی سازی پاتوژنها – هنگامی که آنتی بادیها آنتی ژنها را شناسایی میکنند، اتصال در خارج از سلول اتفاق میافتد. خارج از سلول جایی است که بیشتر باکتریها و سموم باکتریایی یافت میشوند. این اتصال از دسترسی پاتوژن به سلولها و همچنین از عفونت یا تخریب سلولهای میزبان جلوگیری میکند. آنتی بادیها همچنین با اتصال به پروتئینهای سطح سلول، اتصال باکتری به سلولهای میزبان را مسدود میکنند. آنتی بادیها نیز به طور مشابه ما را از ابتلا به عفونتهای ویروسی محافظت میکنند.
- آنتی بادیها اولین خط دفاعی هستند – آنتی بادیهای IgM ساختار پنتامری دارند و به سرعت در خون تولید میشوند. آنها میتوانند به آنتی ژنهای چند ظرفیتی مانند پلی ساکاریدهای دیواره سلولی باکتریایی متصل شوند. این امر به این دلیل است که هر پنتامر IgM دارای 10 محل اتصال آنتی ژن است. این اتفاق قدرت و توانایی آن را برای اتصال به آنتی ژنها افزایش میدهد. آنتی بادیهای IgM نیز در فعال سازی کمپلمان انتخابی هستند. IgG همچنین به opsonization و فعال سازی مکمل کمک میکند. IgG در بافتها پخش شده و به سرعت به سموم متصل میشود. بنابراین IgG میتواند آنتی ژنهای خارجی را خنثی کند و از سلولهای اپیتلیال که به عنوان اولین خط دفاعی عمل میکنند، در برابر عوامل عفونی محافظت کند.
عملکردهای تاثیر گذار با واسطه Fc:
- فعال سازی سلولهای موثر – آنتی بادیها از طریق قطعات Fc خود میتوانند سلولهای جمع آوری کننده جانبی (activate accessory elector cells) را فعال کنند. این سلولها شامل سلولهای فاگوسیتیک مانند ماکروفاژها (macrophages) و نوتروفیلها (neutrophils)، سلولهای T مانند سلولهای کشنده طبیعی (T cells like natural killer cells) و ائوزینوفیلها (eosinophils) و ماست سلها هستند. هر یک از این سلولها یک گیرنده برای قطعه Fc دارند. بنابراین این سلولها میتوانند یک قطعه Fc را شناسایی کرده و پاتوژنها را از بین ببرند.
- اتصال کمپلمان – پس از اتصال به آنتی ژن، کمپلکسهای آنتی ژن-آنتی بادی تشکیل میشود. این امر باعث فعال شدن مجموعه پیچیده ای از واکنشها به نام آبشار مکمل (complement cascade) میشود. مکملها مجموعه ای از پروتئینهای پلاسما هستند که به آزادسازی واسطههای شیمیایی از ماست سلها (دگرانولاسیون ماست سل)، فاگوسیتوز (خوردن سلولهای باکتریایی و میکروبی توسط ماکروفاژها) و لایز سلولی (تجزیه یا ترکیدن سلولهای مهاجم) کمک میکنند. فعال سازی کمپلمان زمانی آغاز میشود که مولکول C1q به مولکولهای آنتی بادی متصل به سطح پاتوژن متصل میشود و مسیر کلاسیک فعال سازی کمپلمان را آغاز میکند. عملکرد اصلی مکملها این است که فاگوسیتها را قادر سازند تا باکتریهایی را که در غیر این صورت تشخیص نمیدادند، از بین ببرند. نه مکمل و نه فاگوسیتها برای پاتوژن خاص نیستند اما آنتی بادیها خاص هستند.
اپسونیزاسیون (Opsonization) – آن دسته از میکروبهایی که سلولهای بیرونی را تکثیر میکنند با برهمکنش قسمت Fc با گیرندههای خاص روی سطح سلولهای الکتور حذف میشوند. آنتی بادیها سطح پاتوژن را میپوشانند و امکان اتصال دومینهای Fc خود را به گیرندههای Fc موجود در سلولهای الکتور میدهند. سپس ماکروفاژها و نوتروفیلها پاتوژن را میبلعد و میکروب را به درون خود میکشند که باعث تخریب آن میشود.
حساسیت مفرط یا واکنشهای آلرژیک ناشی از آنتی بادی
آنتی بادیها در بدن به عنوان یک شمشیر دو لبه عمل میکنند. آنها با یک لبه از بدن در برابر میکروبها محافظت میکنند و با لبه دیگر میتوانند واکنشهای آلرژیک شدید به پروتئینهای نسبتاً بی ضرر و سایر مولکولهای موجود در غذا، محیط زیست، داروها و غیره را ایجاد کنند.
IgE مهم ترین واسطه حساسیت مفرط یا واکنشهای آلرژیک است. هنگامی که به آنتی ژنهای چند ظرفیتی متصل میشود، ماست سلها فعال میشوند که واسطههای شیمیایی ذخیره شده در گرانولها را آزاد میکنند و خود قادر به واسطهگری در واکنشهای التهابی موضعی هستند. به این پدیده دگرانولاسیون ماست سل (mast cell degranulation) میگویند.
کاربردهای آنتی بادی
آنتی بادیها پروتئینهایی هستند که میتوانند به مولکولهای خاصی به نام آنتی ژن متصل شوند. آنها بخشهای مختلفی در ساختار Y شکل خود دارند که میتوانند به آنتی ژنها و مولکولهای موثر متصل شوند. انواع مختلفی از آنتی بادیها مانند آنتی بادیهای اولیه و ثانویه و مونوکلونال و پلی کلونال با ویژگیهای متفاوت در سالهای اخیر ساخته شده اند. این پیشرفتها، آنتیبادیها را به اجزای ضروری در روشهای گسترده در پزشکی و تحقیقات زیست پزشکی تبدیل کرده است.
برخی از کاربردهای مهم آنتی بادیها در پزشکی و تحقیقات زیست پزشکی در زیر مورد بحث قرار گرفته است:
دارو
تشخیص
- آنتی بادیها در تشخیص پزشکی بسیار مفید هستند. بسیاری از سنجشهای بیوشیمیایی امکان تشخیص آنتی بادیهای خاص را برای تشخیص بیماریها فراهم میکنند.
- اکثر تکنیکهای تشخیص ایمنی مانند الایزا (ELISA) از آنتی بادیهای متعدد برای شناسایی آنتی ژنهای خاصی که قادر به ایجاد بیماریهای عفونی هستند، استفاده میکنند.
- در ایمونولوژی بالینی، سطوح کلاسهای مختلف ایمونوگلوبولینها در تجزیه و تحلیل مشخصات آنتی بادی بیمار کمک کننده است.
- افزایش برخی ایمونوگلوبولینها نیز یک شاخص مفید در تشخیص بسیاری از بیماریها است. به عنوان مثال، افزایش IgM نشانه هپاتیت ویروسی است.
- آنتی بادیهایی که میتوانند به گنادوتروپین جفتی انسانی (human chorionic gonadotropin) متصل شوند در کیتهای تست بارداری بدون نسخه استفاده میشوند.
روشهای درمانی
- آنتی بادیها برای درمان کمبودهای ایمنی مانند هیپوگاماگلوبولینمی (hypogammaglobulinemia) استفاده میشوند. در این حالت، آنتی بادیهای آماده برای ایجاد ایمنی غیر فعال به بیمار تزریق میشود.
- آنتی بادیهای مونوکلونال به طور گسترده برای درمان چندین بیماری مانند مولتیپل اسکلروزیس، آرتریت روماتوئید، پسوریازیس و چندین سرطان مختلف از جمله سرطان کولورکتال و سرطان سینه استفاده میشوند. تاکنون حدود 12 آنتی بادی مونوکلونال برای درمان سرطان توسط سازمان غذا و داروی ایالات متحده تایید شده است. آزمایشهای بالینی برای تولید آنتی بادیهای مونوکلونال بیشتری در حال انجام است که میتوانند به درمان بسیاری از انواع سرطان کمک کنند.
روندهای درمانی پیش از تولد
آنتی بادیهای گلوبولین ایمنی Rho (D) در روندهای درمانی پیش از تولد برای جلوگیری از خطر ابتلا به بیماری همولیتیک (hemolytic disease) در نوزاد استفاده میشوند. در مورد جنین و مادر ناسازگار با Rh، هرگونه اختلاط خون ممکن است باعث حساسیت مادر Rh- نسبت به آنتی ژن Rh+ از کودک شود.
اگر مادر قبل از زایمان با آنتی بادیهای ضد RhD درمان شود (تحت معرض این مواد قرار گیرد)، آنتی ژن Rh جنین را قبل از اینکه آنتی ژن سلولهای B مادر را تحریک کند، از بین میبرد. بنابراین، درمان با گلوبولین ایمنی Rho (D) از ایجاد حساسیتی که میتواند باعث بیماری Rh حتی در بارداریهای آینده شود، جلوگیری میکند.
تحقیقات زیست پزشکی
اختصاصیت و حساسیت بالای آنتی بادیها یک مزیت واقعی در کاربردهای تحقیقاتی زیست پزشکی است. پیشرفت در بیوتکنولوژی تولید آنتی بادیها را در مقیاس بزرگ امکان پذیر کرده است. این بخش مروری بر کاربرد آنتی بادیها در تحقیقات زیست پزشکی ارائه میدهد.
وسترن بلاتینگ (Western blotting)
در این روش، پروتئینها به روش الکتروفورز جدا شده و سپس به یک کاغذ بلاتینگ منتقل میشوند که در معرض آنتی بادیهای نشاندار شده برای شناسایی پروتئینها قرار میگیرد.
سنجش ایمونوسوربنت (Immunosorbent assays)
سنجشهای ایمونوسوربنت مرتبط با آنزیم (ELISAs) تکنیکهای بسیار محبوبی هستند که برای تشخیص و تعیین کمیت یک آنتی ژن خاص در سرم خون استفاده میشوند. این سنجشها از اختصاصیت بالای آنتی بادیها برای آنتی ژنهای هدف مختلف استفاده میکنند. ELISAهای مستقیم از آنتی بادیهای مونوکلونال برای شناسایی یک آنتی ژن خاص در محلول استفاده میکنند. ELISA غیر مستقیم از یک آنتی بادی اولیه و ثانویه برای تشخیص آنتی ژن استفاده میکند.
ایمونوهیستوشیمی (Immunohistochemistry) یا ایمونوسیتوشیمی (immunocytochemistry)
ایمونوهیستوشیمی و ایمونوسیتوشیمی تکنیکهایی هستند که برای تعیین حضور و مکان پروتئینها در محل استفاده میشوند. در این تکنیکها، از آنتی بادیهای اولیه برای اتصال به آنتی ژنهای هدف و از آنتی بادیهای ثانویه کونژوگه (تجمع یافته) برای تشخیص کمپلکس آنتی ژن-آنتی بادی اولیه استفاده میشود.
سنجش رسوب ایمنی (Immunoprecipitation assays)
در سنجش ایمونوپسیتیشن، آنتی بادیها به نشانه گذاری و رسوب آنتی ژنهای هدف از محلول آبی کمک میکنند. دانههای آگارز ابتدا به ناحیه Fc آنتی بادی متصل میشوند و سپس امکان جداسازی کمپلکسهای آنتی بادی-آنتی ژن را به صورت گریز از مرکز به ما میدهند.
کاربردهای In vivo
در مطالعات ایمونولوژیک، آنتی بادیها را میتوان در داخل بدن برای جداسازی سلولهای خاص برای آنالیزهای عملکردی استفاده کرد. آنتی بادیها نیز در داخل بدن برای خنثی کردن گیرندههای سطح سلولی ساخته میشوند تا اتصال به عوامل محلول را امکان پذیر کنند.
فلوسیتومتری (Flow cytometry)
آنتی بادیها به طور گسترده در فلوسیتومتری برای تجزیه و تحلیل درون سلولی استفاده میشوند. در این روش، سوسپانسیونهای تک سلولی با آنتی بادیهایی با نشانه فلوئوروکروم (fluorochrome-tagged antibodies) بسیار اختصاصی رنگ آمیزی میشوند که به راحتی قابل تشخیص هستند.
سلولها همچنین میتوانند با چندین آنتی بادی نشانه گذاری شوند زیرا فلوسیتومترهای پیشرفته قادر به تشخیص 3 فلوروکروم یا بیشتر به طور همزمان هستند. این امر میتواند به شناسایی پروتئینها در سیتوزول، هسته و اندوزومها کمک کند.
آنتی بادیهای مونوکلونال
آنتی بادیهای مونوکلونال (MAbs) از یک کلون سلول B تولید میشوند و میتوانند به یک نوع محل اتصال آنتی ژن متصل شوند. MAbs آنتی بادیهای همگنی هستند که نمیتوانند با پروتئینهای مونومر شبکه تشکیل دهند زیرا میتوانند تنها به یک اپی توپ روی آنتی ژن متصل شوند.
Mabs که در دهه 1970 توسعه یافتند، میتوانند علیه هر ماده ای تولید شوند. بنابراین میتوان از آنها برای شناسایی و خالص سازی هر ماده مورد نظری استفاده کرد. این امر MAbs را به ابزاری قدرتمند برای زیست شناسی مولکولی، بیوشیمی و پزشکی تبدیل کرده است.
تولید آنتی بادیهای مونوکلونال
MABها با استفاده از فناوری هیبریدوما (Hybridoma Technology) تولید میشوند. این روش یک منبع آنتی بادی همگن نامحدود با ویژگیهای مورد نظر را فراهم میکند.
فناوری هیبریدوما (Hybridoma Technology)
فناوری هیبریدوما در سال 1975 توسط ژرژ کوهلر (Georges Köhler) و سزار میلشتاین (César Milstein) که جایزه نوبل فیزیولوژی-پزشکی را در سال 1984 به اشتراک گذاشتند، توسعه یافت. روش آنها از ظرفیت سلولهای میلوما (myeloma cells) برای تقسیم و رشد دائمی و تولید آنتی بادی بهره میبرد.
در این روش، لنفوسیتهای B از پستانداران ایمن شده با سلولهای میلوم نامیرا ترکیب میشوند. محصولات همجوشی برای تشکیل هیبریدومها کلون شده و به طور نامحدود تکثیر میشوند. هیبریدومها با استفاده از الایزا به منظور انتخاب ترکیب ایمونوگلوبولین همگن مورد نظر که میتواند برای القای تومور در حیوان دوم مورد استفاده قرار گیرد، مورد سنجش قرار میگیرند.
تومور مایع غنی از آنتی بادی به نام آسیت (ascites) ترشح میکند که استخراج شده و برای جداسازی MAbs تحت کروماتوگرافی قرار میگیرد. سپس این MAbs برای حذف آلایندهها قبل از استفاده در آزمایشگاه برای اهداف مختلف، خالص میشوند. از آن جایی که هیبریدومها نامیرا هستند، این فناوری منبع تجدید پذیری از MAbs را ارائه میدهد.
کاربرد آنتی بادیهای مونوکلونال
اختصاصیت منفرد MAbs برای استفاده در زمینههای زیر مورد توجه قرار میگیرد:
پژوهش
- بررسی تغییرات ساختار مولکولی
- تجزیه و تحلیل حالت فسفوریلاسیون
- مطالعات برهمکنش پروتئین-پروتئین
- در آنالیزهای ساختاری مانند کریستالوگرافی اشعه ایکس
- شناسایی اعضای مجرد خانوادههای پروتئینی
دارو
- در تشخیص و درمان سرطان
- برای جلوگیری از رد آلوگرافت (allograft rejection)
- در درمان بیماریهای نئوپلاستیک (neoplastic) و خون ساز (hematopoietic)
- برای درمان انفارکتوس میوکارد (myocardial infarctions)
- در معکوس کردن سمیت دارویی
مزایای آنتی بادیهای مونوکلونال
مزایای کلیدی MAbs در زیر ذکر شده است:
- MAbs همگن و سازگار هستند.
- پس از ایجاد هیبریدوم مناسب میتوان آنها را به صورت تجدیدی تولید کرد.
- خلوص و غلظت یک آنتی بادی خاص در MAbs در مقایسه با آنتی بادیهای پلی کلونال بیشتر است.
- MAbs به تغییرات کوچک در غلظت نمک و pH بسیار حساس هستند.
- آنها را میتوان به راحتی برای واکنش متقابل (cross-reactivity) آزمایش کرد.
معایب آنتی بادیهای مونوکلونال
برخی از معایب MAbs در زیر ذکر شده است:
- اختصاصیت منفرد MAbs کاربردهای آنها را محدود میکند.
- تغییرات جزئی در ساختار اپی توپ آنتی ژن بر عملکرد MAbs تأثیر میگذارد.
- تولید MAb باید برای آنتی ژنی که نیاز به اتصال به آن دارد، بسیار خاص باشد.
- آنها برای استفاده در سنجشهایی مانند هماگلوتیناسیون (hemagglutination) شامل پیوند متقابل آنتی ژن مناسب نیستند. تغییرات جزئی بر محل اتصال آنتی بادی تأثیر میگذارد.
- اگر چه این محدودیتها را میتوان با ادغام چندین MAb دارای اختصاصیتهای مورد نیاز رفع کرد، شناسایی چنین MABها میتواند گران، پر زحمت و زمان بر باشد.
آنتی بادیها برای سالها ابزار فوق العادهای در تحقیقات آزمایشگاهی بودهاند. MAbs حدود 25 سال پیش ساخته شد و دومین آنتی بادیها را برای تشخیص خارج از بدن طیف گسترده ای از بیماریها گسترش داده است. دانشمندان با استفاده از آنها در ایمونوتراپی از سطح بالای اختصاصیت و توانایی اتصال انتخابی آنها بیشتر و بیشتر استفاده میکنند.
ظهور فناوری هیبریدوما منجر به دسترسی نامحدود MAbs شده است. بسیاری از MABهای تولید شده با استفاده از این فناوری به شناسایی و تجزیه و تحلیل آنتی ژنهای مرتبط با تومور از چندین ملانوم انسانی (human melanomas) مختلف، کارسینوم (carcinomas)، لنفوم (lymphomas) و لوسمی (leukemias) کمک کرده است. اسناد موجود تا به امروز بیش از 100 Mabs منحصر به فرد را علیه سرطانهای انسانی گزارش میدهد.
آنتی بادیهای پلی کلونال (pAbs) چیست؟
آنتی بادیهای پلی کلونال (pAbs) مخلوط پیچیده ای از چندین آنتی بادی هستند که معمولاً توسط کلونهای مختلف سلول B یک حیوان تولید میشوند. این آنتی بادیها بسیاری از اپی توپهای مختلف یک آنتی ژن را شناسایی کرده و به آنها متصل میشوند و از این رو میتوانند شبکههایی را با آنتی ژنها تشکیل دهند.

آنتی بادیهای پلی کلونال چگونه تولید میشوند؟
آماده سازی آنتی ژن
کیفیت و کمیت آنتی ژن مورد استفاده مستقیماً بر پاسخ ایمنی تأثیر میگذارد. حتی مقادیر کمی از ناخالصیها منجر به واکنش بیشتر آنتی بادیها به ناخالصی نسبت به آنتی ژن مورد نظر میشود. مقادیر آنتی ژن بسیار کم یا بیش از حد ممکن است باعث ایجاد حساسیت، سرکوب یا سایر اثرات تعدیل کننده ایمنی ناموجه شود. بنابراین، خالص سازی آنتی ژن یک فرآیند حیاتی برای دستیابی به افزایش اختصاصیت آنتی بادی است.
آنتی ژن باید در شرایط استریل تهیه شود تا از عاری بودن آن از آندوتوکسین (endotoxin) اطمینان حاصل شود. مقدار آنتی ژن به عوامل متعددی مانند خواص آنتی ژن خاص، گونه حیوانی انتخاب شده، مسیر تزریق، دفعات تزریق و مرحله خلوص آنتی ژن بستگی دارد.
انتخاب گونههای جانوری
عواملی که بر انتخاب گونههای جانوری تأثیر میگذارند عبارتند از: مقدار pAb مورد نیاز، رابطه فیلوژنتیکی (phylogenetic relationship) بین حیوان و آنتی ژن، سن حیوان، سهولت در گرفتن نمونههای خون و کاربردی که در آن از pAb استفاده میشود.
گونههای حیوانی که معمولاً در آزمایشگاه استفاده میشوند عبارتند از: خرگوش، rats، mice، خوکچه هندی، همستر، بز، مرغ و گوسفند. خرگوشها به دلیل جثه و طول عمر نسبتاً طولانی به سایرین ترجیح داده میشوند. با این حال، برای تولید مقادیر بیشتری از pAbs، از حیوانات مزرعهای مانند بز، گوسفند و اسب استفاده میشود.
پروتکل ایمن سازی
پروتکل ایمن سازی برای گونههای مختلف جانوری متفاوت است. ادجوانتها (Adjuvants) ترکیباتی هستند که به عنوان محرک در مواردی استفاده میشوند که در غیر این صورت پاسخ ایمنی القایی ناکافی است. رایج ترین ادجوانت مورد استفاده برای تولید pAbs، ادجوانت کامل فروند (FCA یا Freund’s complete adjuvant) است.
FCA تیتر آنتی بادی بالایی را به اکثر انواع آنتی ژنها القا میکند. با این حال، باید مراقب بود که FCA بیش از حد تجویز نشود. استفاده از FCA باید به یک بار محدود شود زیرا FCA میتواند باعث آسیب شدید بافت شود.
کمترین حجم آنتی ژنی که قادر به القای پاسخ ایمنی موثر است به حیوان تزریق میشود. با این حال، مسیر تزریق به ماهیت آنتی ژن و همچنین حیوان مورد استفاده بستگی دارد. آنتی ژن را میتوان به صورت یک حجم یا چند حجم کمتر در محلهای مختلف تزریق کرد.
در صورتی که غلظت تیتر آنتی بادی ثابت شده یا در حال کاهش باشد، تزریق تقویت کننده (Booster injections) انجام میشود. چنین تزریقاتی همیشه به ادجوانت نیاز ندارند و مقادیر بسیار کمی از آنتی ژن برای بهبود غلظت آنتی بادی کافی است. حداکثر سه تزریق تقویت کننده توصیه میشود.
مشاهده پس از ایمن سازی
حیوانات برای ارزیابی عوارض جانبی ایمن سازی روزانه تحت نظر قرار میگیرند و در فواصل زمانی معین از آنها خون گرفته میشود. سرم حیوانات برای نظارت بر پاسخهای آنتی بادی و استخراج آنتی بادیها در صورت تولید مقدار کافی، تجزیه و تحلیل میشود.
مزایای آنتی بادیهای پلی کلونال
تولید این نوع آنتی بادیها یک فرآیند نسبتاً ارزان است و میتوان از آن برای جداسازی مقادیر زیادی از یک آنتی بادی در یک مخلوط استخراج شده استفاده کرد. PAbs ترکیبی ناهمگن از آنتی بادیها هستند که میتوانند به طیف وسیعی از اپی توپهای آنتی ژنی متصل شوند. از این رو کمتر احتمال دارد که تغییرات کوچک در اپی توپهای یک آنتی ژن، روی pAbs تأثیر بگذارد. این آنتی بادیها در طیف وسیعی از غلظت نمک و مقادیر pH بسیار پایدار هستند.
معایب آنتی بادیهای پلی کلونال
میل ترکیبی pAbs به آنتی ژنها ممکن است در طول زمان تغییر کند و در نتیجه منجر به تنوع زیادی بین دستهها شود. علاوه بر این، مقدار pAbs تولید شده به اندازه و طول عمر حیوان محدود میشود. سطح خلوص و غلظت یک آنتی بادی خاص در pAbs کمتر از آنتی بادیهای مونوکلونال است.
آنتی بادیهای پلی کلونال چگونه استفاده میشوند؟
pAbs طیف گسترده ای از کاربردها، از جمله آزمایشهای تشخیصی و همچنین تجزیه و تحلیلهای کمی و کیفی بیولوژیکی دارند. به عنوان مثال، pAbs در روشهای ایمونوفلورسانس (immunofluorescence) و ایمونوهیستوشیمی مانند sandwich ELISA برای شناسایی نشانگرهای تومور و سایر پروتئینهای مورد نظر استفاده میشود.
pAbs همچنین برای اهداف میانی یا مدولاسیون (modulation) مانند ایمونوتراپی، سیگنال دهی فعال یا برای فعالیتهای خنثی کننده استفاده میشوند. نمونه ای از این مورد، استفاده از pAbs در درمان digoxin Immune Fab در سمیت کشنده دیگوکسین (fatal digoxin toxicity) است.
pAbs مانند گلوبولین ایمنیRho (D) به مادران دارای گروه خونی Rhesus منفی برای جلوگیری از بیماری همولیتیک در نوزاد تازه متولد شده، تزریق میشود. Rho (D) از مجموعهای از پلاسمای انسانی جمع آوریشده از اهدا کنندگان رزوس منفی که دارای آنتی بادیهایی برای آنتی ژن D (موجود در گلبولهای قرمز) هستند، تولید میشود.
pAbs همچنین در آنالیزهای هیستوپاتولوژیک (histopathological analyses) که از رنگ آمیزی ایمونوپروکسید (immunoperoxide staining) استفاده میکنند، کاربرد پیدا میکنند. جدای از این کاربردها، pAbs در خالص سازی ایمونوفینیتی (immunoaffinity) برای خالص سازی یا غنی سازی آنتی ژنها استفاده میشود.
به دلیل توانایی pAbهای نوترکیب در هدف گیری ترکیبی سلولهای تومور در مقایسه با آنتی بادیهای مونوکلونال، از آنها در درمان سرطان استفاده میشود. اگرچه آنتی بادیهای مونوکلونال به طور گسترده در درمان سرطان مورد استفاده قرار میگیرند اما عود مجدد بیماری به دلیل ظهور سلولهای تومور مقاوم به آنتی بادی رایج است. با استفاده از pAbs، میتوان آنتی بادیهای نوترکیب متنوعی ایجاد کرد که با انواع مختلف سرطانها واکنش متقابل دارند.
راه پیش رو ما نشان میدهد که از pAbهای نوترکیب برای به حداقل رساندن چند واکنشی غیر ضروری استفاده میشود همان طور که این امر در هنگام استفاده از pAbهای سنتی دیده میشود. استفاده از pAbs در سنجشهای مختلف نه تنها باعث تولید در توان بالا میشود، بلکه ممکن است برای تولید آنتیبادیهای اختصاصی برای محصولات ژنی انسانی که قابل تجدید نیز هستند، استفاده شود.
مطالعه بیشتر:
مترجم: فاطمه فریادرس