اطلاعات عمومی,ویکی ژن
آسپارژین: تعریف، ساختار، منبع، خواص، بیوسنتز و کاربرد
آسپارژین چیست؟
آسپارژین نوعی اسید آمینه آلفا غیر ضروری است که برای اولین بار در سال 1806 توسط Vauquelin و Robiquet از شیره مارچوبه کشف شد.
آنها آسپارژین را پس از مشاهدهی کریستالهای مکعبی در شیره مارچوبه (توسط دلاویل در سال 1802) کشف کردند. اولین اسید آمینه کشف شده آسپارژین است. این ماده تشکیل دهنده پروتئین است که در حالت آزاد گیاهان و حیوانات یافت میشود و نقش مهمی در بیوسنتز گلیکوپروتئینها و سایر پروتئینها دارد که از مشتقات بتا آمیدو اسید آسپارتیک است و نوعی حامل غیرسمی از آمونیاک است که آمونیاک را از بدن منتقل میکند. بدن میتواند آسپارژین را تولید کند و همچنین نوعی آمینو اسید گلوکوژنیک است که توسط کبد تولید میشود.
ساختار آسپارژین
آسپارژین دارای فرم فعال نوری با پیکربندی L است که L-آسپارژین است و شامل یک گروه آلفا کربوکسیل، گروه آلفا آمینه و دارای یک گروه زنجیره جانبی متشکل از اسیدهای آمینه آلیفاتیک قطبی است.
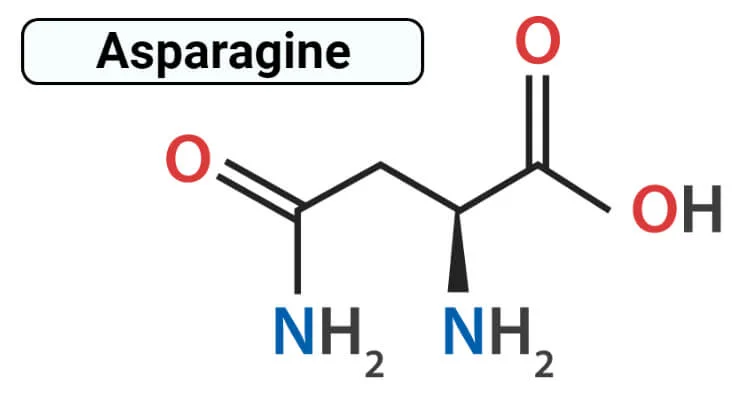
آسپارژین، آمید اسید آسپارتیک است که در هیچ شرایطی از pH ، باری ندارد. گروه آمید آسپارژین میتواند در حالی که دو پیوند هیدروژنی دارد اهدا کننده باشد در حالی که گروه کربونیل به عنوان گیرنده پیوند هیدروژنی عمل میکند و در سطح و همچنین درون پروتئینها یافت میشود. آسپارژین فاقد بار منفی از گروه اسید کربوکسیلیک آسپارتات است و قطبیت را حفظ میکند و همچنین نقش عمدهای در محل آنزیمها ایفا میکند.
منبع آسپارژین
آنها به مقدار زیادی در منابع گیاهی مانند حبوبات، سویا، آجیل، گندم، سیب زمینی یافت میشوند. آسپارژین در منابع حیوانی نیز یافت میشود مانند غذاهای دریایی، ماهی، تخم مرغ، لبنیات، لاکتالبومین و غیره. همچنین در قهوه برشته و سیب زمینی سرخ کرده نیز وجود دارد.
خواص فیزیکی آسپارژین
- رنگ سفید با ظاهری کریستالی
- قطبی
- بدون بار
- پودر خشک، جامد
- بلورهای بیسفنوئیدی ارتورومبیک
- در طبیعت قابل اشتعال
خواص شیمیایی آسپارژین
- فرمول مولکولی C4H8N2O3 است.
- وزن مولکولی: 132. 12
- خنثی
- نقطه ذوب: 234-235ºC
- نقطه جوش: 438ºC
- نامحلول در متانول، اتانول، اتر و بنزن
- محلول در اسید و باز اما نسبتاً محلول در آب
- نسبت N:C آسپارژین 2:4 است
- pKa: 8.82
- حلالیت: 29400 میلی گرم در لیتر در دمای 25 درجه سانتی گراد
- نقطه ایزوالکتریک: 5.41
بیوسنتز آسپارژین
در مطالعات قبلی، مشخص شد که سنتز آسپارتات با آمیداسیون آسپارتات توسط واکنشی مشابه واکنشی که توسط گلوتامین سنتتاز کاتالیز میشود، رخ میدهد. اما بعدها مشخص شد که آسپارژین از اسید آسپارتیک و آمونیاک توسط آنزیم آسپارژین سنتتاز سنتز میشود. کل واکنشی که رخ میدهد واکنش های آمیدوترانسفراز وابسته به ATP است. اگزالواستات در ترانس آمیناسیون جزء اصلی در بیوسنتز آسپارژین است که کل فرآیند از آن شروع میشود.
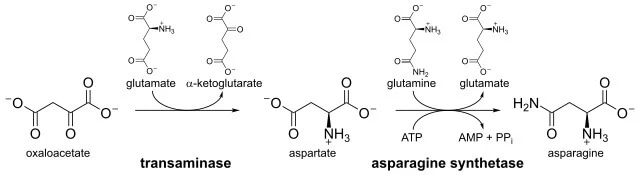
اگزالواستات توسط آسپارتات آمینوترانسفراز 1 کاتالیز میشود. ال-آسپارژین در واکنشی که توسط آنزیم آسپارژین سنتتاز کاتالیز میشود ( که از ال-گلوتامین به عنوان دهنده آمید استفاده میکند)، از ال-اسپارتات بوجود میآید. یونهای منیزیم و آدنوزین تری فسفات (ATP) برای این واکنش مورد نیاز هستند که شامل تشکیل یک بتا-آسپارتیلادنیلات واسطه است که سپس به ال-آسپارژین تبدیل میشود. در این فرآیند، آمونیاک از ال-گلوتامین برای تولید ال-گلوتامات و AMP منتقل میشود. آسپارژین سنتتاز در انسان به دلیل رونویسی حاصل از یک ژن واقع در کروموزوم 7، مسئول استرس سلولی است.
کاربردهای آسپارژین
- از آنجایی که آسپارژین از آسپارتات و گلوتامین سنتز میشود، یک آمینو اسید قابل مصرف است که سه عملکرد اصلی دارد:
- منبع اصلی اسید آمینه است که در تولید سایر اسیدهای آمینه قابل مصرف از طریق آنزیم ترانس آمیناز استفاده میشود.
- پیش مادهای است که برای سنتز DNA، RNA و ATP لازم است.
- میتواند تولید انرژی سلولی را با کمک زنجیرههای کربنی به چرخه اسید سیتریک افزایش دهد.
- به عنوان یک ادرارآور عمل میکند.
- به کنترل فعالیتهای متابولیک مغز و به حفظ تعادل کمک میکند.
- به عنوان مکمل برای درمان کمبود رژیم غذایی و برای افراد فاقد تعادل بدنی استفاده میشود.
- جهش در آسپارژین سنتتاز منجر به ناتوانی ذهنی و جسمی میشود.
سمیت آسپارژین
- مصرف بیش از حد آسپارژین میتواند باعث سرطان خون و لنفوم شود زیرا آسپارژیناز به عنوان یک عامل ضد سرطان عمل میکند و در درمان تومورها استفاده میشود.
- کمبود آسپارژین منجر به تحریک پذیری، سردرد، افسردگی، گیجی و روان پریشی میشود.
همچنین بخوانید:
- چارت کدون (Codon Chart) و جدول اسیدهای آمینه
- مولکول پروتئین چیست؟ خواص، ساختار، انواع، عملکرد پروتئینها
مترجم: معصومه قریبی ششده



