فهرست مطالب
نمایش
خالص سازی پروتئین چیست؟
- در بیوشیمی، پروتئین یک زنجیره بلند از اسیدهای آمینه است که همه به هم مرتبط هستند. پروتئینها بخش مهمی از نحوه ساخت و عملکرد سلولها هستند.
- اما اگر میخواهید پروتئینها را مطالعه کنید، ابتدا باید آنها را پیدا و از باقی قسمتهای سلول، جدا کنید. بیوشیمی دانان از روشی به نام «خالص سازی پروتئین با توان بالا» استفاده میکنند تا این اتفاق بیفتد.
- ابتدا پروتئینها خارج میشوند و سپس بر اساس وزن مولکولی، حلالیت، بار و توانایی اتصال به مکانهای خاص به گروههایی تقسیم میشوند.
- این فرآیند به دانشمندان کمک میکند تا چگونگی ساخته شدن پروتئینها و نحوه تعامل آنها با یکدیگر را مطالعه کنند.
- خالص سازی پروتئین مجموعه ای از مراحل است که برای به دست آوردن پروتئین مورد نظر از یک مخلوط پیچیده انجام میشود تا بتوان آن را مطالعه کرد. بدست آوردن یک پروتئین به دانشمندان کمک میکند تا اطلاعات زیر را به دست آورند:
- اندازه و ساختار
- میل به اتصال
- فعالیت در موجودات زنده
- ویژگیهای فیزیکی و شیمیایی
- این فرآیند در تحقیقات به خصوص برای ساخت پروتئینهای نوترکیب در مقیاس بزرگ کاربردهای زیادی دارد. (با این حال، خالص سازی پروتئینهای طبیعی دشوار است. وقتی این اتفاق میافتد، از برچسبهای میل ترکیبی مانند پلیهیستیدین، گلوتاتیون-S-ترانسفراز و تگهای His برای جداسازی و اتصال آنها استفاده میشود.)
روشهای خالص سازی پروتئین
استخراج عصاره پروتئین خام
- فرآیند خالص سازی تک مرحلهای را نمیتوان برای به دست آوردن پروتئین گیاهی خالص استفاده کرد زیرا بافتهای گیاهی دارای انواع مختلفی از پروتئینها، دیواره سلولی سخت ساخته شده از مواد سلولزی و ترکیبات فنلی هستند که میتوانند پروتئینها را تجزیه کنند.
- فرآیند استخراج با قرار دادن یک نمونه گیاهی تازه یا منجمد با وزن مناسب در مایع N2 شروع میشود.
- همه اینها را در یک مخلوط سرد با مقدار مناسب بافر استخراج (3 برابر نمونه) با هم مخلوط کنید.
- نوع بافر استخراج و pH آن منحصر به نوع نمونه است. برای بهبود کیفیت عصاره ساخته شده باید مقداری افزودنی به بافر استخراج اضافه شود. از جمله این افزودنیها میتوان به موارد زیر اشاره کرد:
- برای توقف فعالیت پروتئاز، فنیل متیل سولفونیل فلوراید (PMSF) درست قبل از استخراج در مقدار بسیار کمی پروپانول حل میشود.
- ترکیبات با فلاوین (FAD)
- دی تیوتریتول (DTT)، برای جلوگیری از تجزیه گروه سولفیدریل.
- EDTA به عنوان یک کلات شیمیایی، بهترین عملکرد را با بافر فسفات دارد.
- فلوراید سدیم میتواند از عملکرد فسفاتاز جلوگیری کند.
- 25 گرم پلی فنیل پیروات (PVP) بر کیلوگرم وزن تازه نمونه که یک ترکیب نامحلول است که به ترکیبات فنلی موجود در نمونه متصل میشود. ترکیب حاصل با سانتریفیوژ دور ریخته میشود.
- 30٪ گلیسرول که ممکن است به برخی از پروتئینهای بسیار ناپایدار کمک کند که در جای خود باقی بمانند.
- آنتی بیوتیکهایی مانند هیبیتان اغلب برای دریافت پروتئین از ریزومها یا سایر قسمتهای زیرزمینی گیاه استفاده میشود.
- سپس از سانتریفیوژ خنک کننده برای چرخاندن آن در 10000 گرم به مدت 10 دقیقه استفاده کنید.
- فرآیند استخراج و چرخاندن بافت را سه بار تکرار کنید تا مطمئن شوید که تمام پروتئینها خارج شدهاند.
- تقریباً از همین روش برای استخراج روبیسکو از برگ گندم، پروتئین از دانه اسپندهارمالا و پروتئین از دانه نخود استفاده شد.
- در عصارههای خام، مقدار کل پروتئین و فعالیت باید اندازه گیری شود. اگر پروتئین هدف یک آنزیم باشد، فعالیت آن نیز باید اندازه گیری شود.
- کیت بافر استخراج پروتئین مخمر میتواند برای میکروارگانیسمهایی مانند مخمر استفاده شود.
- این بافر از مواد بافر آلی ساخته شده است که از دترجنتهای غیریونی ملایم و ترکیبی از نمکها و عوامل مختلف استفاده میکنند تا خروج پروتئینها از محلول آسانتر و پایدار بماند.
- همچنین یک آماده سازی Zymolyase نیز وجود دارد که قابل استفاده است.
اختلاف حلالیت- غلظت عصاره خام
- در خالص سازی پروتئین، سولفات آمونیوم (NH4)2SO4 اغلب به عنوان اولین مرحله برای جداسازی پروتئینها استفاده میشود.
- برای این کار، سولفات آمونیوم بیشتری اضافه میکنید و مقادیر مختلف پروتئینی را که رسوب میکنند، جمع آوری میکنید.
- یکی از خوبیهای این روش این است که میتوان آن را ارزان و در مقادیر بسیار زیاد انجام داد.
- پروتئینهای محلول در آب اولین مواردی هستند که پاکسازی میشوند. پروتئینهای غشایی یکپارچه را نمیتوان از پروتئینهای دیگر در همان بخش غشایی بدون شکستن غشای سلولی جدا کرد.
- گاهی اوقات میتوان ابتدا یک دستگاه غشایی خاص را جدا کرد. به عنوان مثال، میتوکندریها را میتوان از سلولها قبل از خالص شدن پروتئین موجود در غشای میتوکندری جدا کرد.
- سدیم دودسیل سولفات (SDS) یک ماده دترجنت است که میتواند برای تجزیه غشاهای سلولی و نگه داشتن پروتئینهای غشایی در محلول در طول خالص سازی استفاده شود. با این حال، از آنجایی که SDS پروتئینها را دناتوره میکند، میتوان از دترجنتهای ملایمتری مانند Triton X-100 یا CHAPS برای حفظ شکل طبیعی پروتئینها در طول خالص سازی استفاده کرد.
رسوب سولفات آمونیوم
- سولفات آمونیوم جامد را به عصارههای خام اضافه کنید تا غلظت نهایی به 70% (w/v) برسد یا برای انتخاب غلظت متفاوت به جدول 1 نگاه کنید. این کار برای تغلیظ یا کاهش مقدار کل عصاره خام انجام میشود.
- پس از حل شدن کامل سولفات آمونیوم جامد، مخلوط به مدت 24 ساعت در دمای 4 درجه سانتیگراد باقی میماند. سپس رسوب با چرخاندن مخلوط در 10000 گرم به مدت 10 دقیقه در سانتریفیوژ خنک کننده جمعآوری میشود.
- پروتئینهایی که به هم چسبیدهاند در کمترین مقدار بافر استخراج حل شدند. دیالیز بر روی همان بافر برای حذف یونهای اضافی آمونیوم انجام میشود.
کاهش رسوب با استون
- برای این کسر پروتئین، بهترین محدوده برای رسوب بین 37.5٪ و 50٪ (v/v) است.
- عصاره پروتئین در حمام نمک-یخ به مقدار مناسب سرد میشود.
- به ازای هر 1 میلی لیتر محلول پروتئین 0.60 میلی لیتر استون اضافه کنید (به صورت قطرهای و هم زدن مداوم).
- پس از اضافه شدن استون، به هم زدن ادامه دهید و به مدت 10 دقیقه دما را چک کنید.
- هنگامی که مخلوط استون-پروتئین با 3000 xg به مدت 10 دقیقه چرخانده شود، رسوب تشکیل شده جمع آوری میشود.
- پروتئینی که به هم چسبیده است با استفاده از کمترین مقدار بافر استخراج خارج میشود.
- مقدار مایع رویی اندازهگیری میشود و به ازای هر میلی لیتر محلول پروتئین 0.25 میلی لیتر استون اضافه میشود.
- همانند مرحله آخر، از سانتریفیوژ برای حل کردن پروتئینی که در انتها ته نشین شده است، استفاده میشود. برای حذف باقی مانده استون، لولههای سانتریفیوژ با کاغذ صافی در بالا وارونه میشوند.
- پلت برای مرحله بعدی خالص سازی در مقدار کمی بافر نگهداری میشود.
اولتراسانتریفیوژ
- سانتریفیوژ فرآیندی است که از نیروی چرخشی برای جدا کردن ذرات با اندازهها یا چگالیهای مختلف که در یک مایع شناور هستند، استفاده میکند.
- هنگامی که یک لوله یا بطری با مخلوطی از پروتئینها یا ذرات کوچک دیگر مانند سلولهای باکتریایی به سرعت می چرخد، تکانه زاویهای به هر ذره نیرویی به بیرون میدهد که متناسب با جرم آن است.
- به دلیل این نیرو، ذره ممکن است در مایع حرکت کند. با این حال، مایع به سمت ذره فشار وارد میکند.
- هنگامی که نمونه در سانتریفیوژ قرار میگیرد، نتیجه این است که ذرات کوچک، متراکم و سنگین سریعتر از ذرات یا ذراتی با چگالی کمتر یا سنگین تر به بیرون حرکت میکنند که بیشتر در مایع “کشش” ایجاد میکنند.
- هنگامی که از سانتریفیوژ برای “چرخش” سوسپانسیون ذرات استفاده میشود، ممکن است یک “پلت” در پایین ظرف تشکیل شود. این پلت از متراکمترین ذرات تشکیل شده است که زیاد در مایع حرکت نمیکنند.
- مایع با ذرات غیر متراکم که هنوز بیشتر در آن وجود دارد، “سوپرناتانت” نامیده میشود و مایع رویی را میتوان از ظرف خارج کرد تا آن را از گلوله جدا کرد.
- شتاب زاویهای نمونه، که معمولاً در رابطه با g اندازه گیری میشود، به ما میگوید که سانتریفیوژ با چه سرعتی حرکت میکند.
- اگر نمونهها به اندازه کافی چرخانده شوند، ذرات داخل ظرف به تعادل خواهند رسید. این بدان معنی است که ذرات در نقطهای جمع میشوند که نیروی شناوری و گریز از مرکز هر دو برابر است.
- با این نوع سانتریفیوژ “تعادل”، یک ذره را میتوان تا حد زیادی کنترل کرد.

سانتریفیوژ شیب ساکارز
- در لوله، شکر (معمولا ساکارز گلیسرول یا پرکول) را به گونهای می گذارند که بیشترین غلظت در قسمت پایین و کمترین غلظت در قسمت بالایی باشد.
- سپس، یک نمونه پروتئین در بالای گرادیان قرار داده میشود و از یک اولتراسانتریفیوژ برای چرخش بسیار سریع آن استفاده میشود. این باعث میشود که ماکرومولکولهای سنگینتر سریعتر از مولکولهای سبکتر به انتهای لوله حرکت کنند.
- هنگامی که سانتریفیوژ بدون ساکارز انجام میشود، ذرات با دورتر شدن از مرکز چرخش، نیروی گریز از مرکز بیشتری دریافت میکنند (هرچه بیشتر حرکت کنند، سریعتر نیز می رسند).
- اگر یک نمونه را دو برابر بیشتر بچرخانید، ذره مورد نظر دو برابر دورتر نخواهد شد. خیلی دورتر خواهد رفت اما همانطور که پروتئینها از طریق گرادیان ساکارز حرکت میکنند، با مایعی برخورد میکنند که متراکمتر و غلیظتر میشود.
- اگر گرادیان ساکارز درست تنظیم شود، در برابر نیروی گریز از مرکز فزاینده عمل میکند، بنابراین ذرات به گونهای حرکت میکنند که تقریباً متناسب با مدت زمانی است که در میدان گریز از مرکز بودهاند.
- سانتریفیوژهای “Rate zoneal” برای جداسازی نمونهها بر اساس این تفاوتها استفاده میشوند. پس از جداسازی پروتئین/ذرات، گرادیان تقسیم شده و جمعآوری میشود.
روشهای کروماتوگرافی
- اکثر روشهای خالص سازی پروتئینها دارای یک یا چند مرحله کروماتوگرافی هستند.
- در کروماتوگرافی، مرحله اساسی این است که اجازه دهید محلول با پروتئین در ستونی پر از مواد مختلف جریان یابد.
- پروتئینهای مختلف به طرق مختلف با مواد ستون تعامل دارند. این به این معنی است که زمان عبور پروتئین از ستون یا شرایطی که برای خارج شدن از ستون نیاز دارد میتواند برای جداسازی پروتئینها استفاده شود. بیشتر اوقات، جذب در 280 نانومتر برای یافتن پروتئینها در حین خروج از ستون استفاده میشود.
روشهای مختلف کروماتوگرافی
-
کروماتوگرافی اندازهای
- با استفاده از ژلهای متخلخل، میتوان از کروماتوگرافی برای جداسازی پروتئینها در محلول یا در شرایطی که باعث تجزیه آنها میشود، استفاده کرد.
- در ماتریس متخلخل، مولکولهای کوچکتر باید در حجم بزرگتر حرکت کنند زیرا کوچکتر هستند.
- بنابراین، پروتئینها در یک محدوده اندازه معین، قبل از اینکه بتوانند در انتهای دیگر ستون ژل جمعآوری شوند، به مقدار متفاوتی از دترجنت (حلال) نیاز دارند.
- در فرآیند خالص سازی پروتئینها، مایع شستشو را معمولا در لولههای آزمایش مختلف قرار داده و با هم مخلوط میکنند.
- تمام لولههای آزمایش تهی از پروتئینی که باید خالص شود، دور ریخته میشوند.
- بنابراین، محلول باقیمانده از پروتئینی که باید خالص شود و هر پروتئین دیگری که تقریباً هم اندازه آن باشد، تشکیل میشود.
-
کروماتوگرافی تبادل یونی
- کروماتوگرافی تعویض یونی مواد را بر اساس نوع و مقدار بار یونی آنها جدا میکند.
- نوع و قدرت بار تعیین میکند که کدام ستون مورد استفاده قرار گیرد.
- رزینهای تبادل آنیون دارای بار مثبت هستند و برای نگهداری و جداسازی مولکولهای دارای بار منفی استفاده میشوند، در حالی که رزینهای تبادل کاتیونی دارای بار منفی هستند و برای جداسازی مولکولهای دارای بار مثبت استفاده میشوند.
- قبل از شروع جداسازی، یک بافر از طریق ستون پمپ میشود تا یونهای دارای بار مخالف همگی در یک مکان قرار گیرند.
هنگامی که نمونه به رزین تزریق میشود، مولکولهای املاح با یونهای بافری که سعی میکنند به رزین متصل شوند، جای خود را عوض میکنند.
- مدت زمان نگهداری املاح به شدت بار آن بستگی دارد.
- ابتدا ترکیباتی با ضعیف ترین بارها بیرون میآیند، سپس آنهایی که بارهای قویتر دارند.
- به دلیل نحوه عملکرد جداسازی، pH، نوع بافر، غلظت بافر و دما همگی نقش مهمی در کنترل جداسازی دارند.
- کروماتوگرافی تبادل یونی یک روش بسیار موثر برای حذف ناخالصیهای موجود در پروتئینها است و اغلب برای جداسازی مواد برای اهداف تحلیلی و عملی استفاده میشود.
-
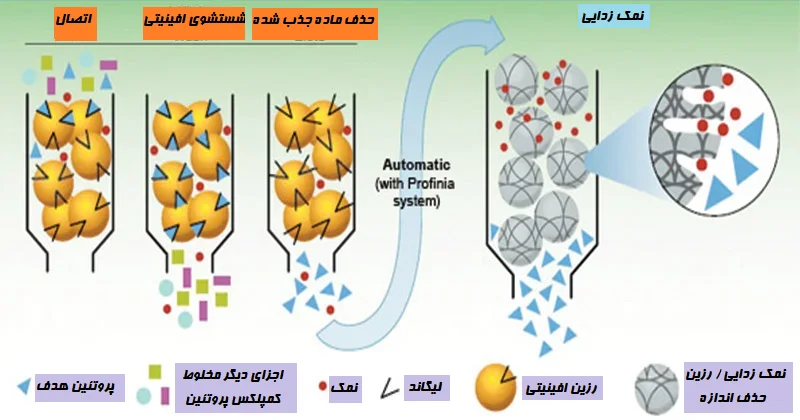
کروماتوگرافی میل ترکیبی
- کروماتوگرافی میل ترکیبی روشی برای جداسازی بر اساس نحوه شکلگیری مولکولها است. اغلب از رزینهای مخصوص استفاده میشود.
- در سطح این رزینها لیگاندهایی وجود دارد که مخصوص ترکیباتی است که باید جدا شوند.
- در بیشتر مواقع، این لیگاندها به گونهای عمل میکنند که شبیه نحوه تعامل آنتی بادیها و آنتی ژنها است.
- این تناسب «قفل و کلید» بین لیگاند و ترکیب هدف، آن را اختصاصی میکند و اغلب یک پیک واحد تولید میکند در حالی که هر چیز دیگری را در نمونه پشت سر میگذارد.
- بسیاری از پروتئینهای غشایی گلیکوپروتئین هستند و میتوان از کروماتوگرافی میل ترکیبی لکتین برای جداسازی آنها استفاده کرد.
- پروتئینهایی که توسط مواد دترجنت تجزیه شدهاند میتوانند به رزین کروماتوگرافی که تغییر یافته است متصل شوند تا لکتین به صورت کووالانسی به آن متصل شود.
- با معرفی غلظت بالایی از قندی که با گلیکوپروتئینهای متصل شده در محل اتصال لکتین رقابت میکند، میتوان گلیکوپروتئینهای متصل شده را به طور خاص شستشو داد.
- برخی از لکتینها در رقابت با قندها برای اتصال به الیگوساکاریدهای گلیکوپروتئینها مشکل دارند. گلیکوپروتئینهای متصل باید با دناتوره کردن لکتین آزاد شوند.
-
اتصال فلزی
- افزودن دنبالهای از 6 تا 8 هیستیدین به پایانه C- پروتئین یک روش رایج است.
- یونهای فلزی دو ظرفیتی، مانند نیکل و کبالت، با اتصال سخت به پلی هیستیدین میچسبند.
- پلی هیستیدین (به عنوان لیبل) را میتوان با عبور دادن آن از ستونی با یونهای نیکل که به هم چسبیدهاند به پروتئین متصل کرد.
- تمام پروتئینهایی که لیبل ندارند از ستون عبور میکنند.
- پروتئین را میتوان با استفاده از ایمیدازول که از اتصال پلی هیستیدین به ستون جلوگیری میکند و یا با کاهش pH (معمولاً به 4.5) از ستون آزاد کرد که باعث میشود لیبل کمتر به رزین بچسبد.
- این روش معمولاً برای تمیز کردن پروتئینهای نوترکیب با لیبل مهندسی شده، مانند تگ 6xHis یا تگ HAT Clontech استفاده میشود. با این حال، میتوان از آن برای جداسازی پروتئینهای طبیعی که تمایل طبیعی به کاتیونهای دو ظرفیتی دارند نیز استفاده کرد.
-
ایمونوفینیتی
- کروماتوگرافی ایمونوفینیتی (IAC) نوعی کروماتوگرافی مایع است که از آنتی بادیها برای اتصال به آنتی ژنی که پروتئین هدف را به روشی بسیار خاص نشان میدهد، استفاده میکند.
- به دلیل چسبندگی محکم و انتخابی آنتی ژنها و آنتی بادیها به یکدیگر، میتوان از آنها به روشهای مختلف استفاده کرد.
- IAC برای جداسازی آمیدازهای جهش یافته و نوترکیب از سودوموناس آئروژینوزا استفاده شده است. این کار با استفاده از آنتی ژنهای بیحرکت یا آنتی بادی انجام شد.
- برای تشخیص ایمنی و بیوداروها، آنتی بادیها بر اساس کلاس آنتی بادی جدا میشوند و سطوح بالاتر خالص سازی هم به روشهای تشخیصی و هم به استفادههای درمانی کمک میکند.
- از آنجایی که جداسازی آنتی بادیها بسیار مهم است، توجه بیشتری به IAC معطوف میشود که روش خوبی برای جداسازی پروتئینها بر اساس نحوه تعامل پروتئینهای هدف با آنتی بادیهای بیحرکت خاص است.
- آنتی بادیهای مونوکلونال (MAbs) را میتوان برای درمان بسیاری از شرایط مختلف مانند سرطان، بیماریهای خود ایمنی، بیماریهای عفونی، بیماریهای قلبی و بیماریهای قلبی عروقی استفاده کرد.
- به این ترتیب از آنتی بادیهای اختصاصی برای جداسازی کلاس IgG که مهمترین نقش را در کاربردهای بالینی ایفا میکند (IgGهایپرایمون) استفاده شد.
- لیگاندهای مصنوعی جدید به دلیل هزینه اندک، خطر کم و ایمنی بالا (لیگاندهای تقلیدی مصنوعی پروتئینهای A و L) مورد توجه تحقیقات قرار گرفتهاند.
- با استفاده از آنتی بادیهای تک اختصاصی و کروماتوگرافی میل ترکیبی، آنتی ژنهای پروتئین مایکوباکتریوم توبرکلوزیس H37Ra ES-31، ES-43، و EST-6 که میتوانند برای تشخیص ایمنی مورد استفاده قرار گیرند، از آنتی ژن سونیکات محلول در دترجنت (DSS) جدا شدند.
- آنتی ژنهای ES-31، ES-43 و EST-6 هر دو فیلتر کشت و آنتی ژن DSS خالص شده، سرم واکنشی مشابهی با حساسیت (به ترتیب) 85، 80 و 75 درصد نشان دادند.
-
HPLC
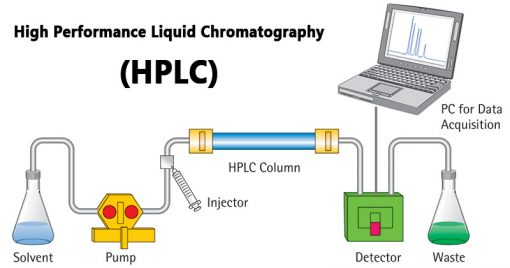
- کروماتوگرافی مایع با کارایی بالا که کروماتوگرافی مایع با فشار بالا نیز نامیده میشود، نوعی کروماتوگرافی است که از فشار بالا برای حرکت سریعتر املاح در ستون استفاده میکند.
- در این روش انتشار کمتری وجود دارد، بنابراین وضوح بهتر است.
- افزایش مقادیر یک حلال آلی (ایجاد شیب)، مانند استونیتریل، برای خارج کردن پروتئینها استفاده میشود.
- پروتئینها بر اساس میزان آب دوستی، بیرون میآیند.
- پس از خالص سازی HPLC، پروتئین در محلولی با ترکیبات فرار قرار میگیرد.
- خالص سازی HPLC اغلب باعث میشود که پروتئینها شکل خود را از دست بدهند، بنابراین نمیتوان از آن برای پروتئینهایی که خود به خود تا نمیشوند، استفاده کرد.
همچنین بخوانید:
- اولتراسانتریفیوژ: اصول، انواع، قطعات، روش کار، موارد استفاده
- کروماتوگرافی میل ترکیبی (Affinity Chromatography): تعریف، اصول، اجزا، مراحل و کاربرد
- کروماتوگرافی ژل تراوایی: تعریف، اصل، اجزا، مراحل، موارد استفاده
- کروماتوگرافی مایع با عملکرد بالا (HPLC) چیست؟
مترجم: معصومه قریبی ششده




سلام و درود فراوان. عضر میخام یه پروتئین گیاهی را میخام بگیرم. فقط با نمک طعام، و هیچ وسیله آزمایشگاهی ندارم، بصورت رسوب ته نشین میتونم این کار را انجام بدم، ممنون
بله، شما میتوانید با استفاده از نمک طعام و روشهای ساده، پروتئین گیاهی را استخراج و رسوب دهید. این روش برای اهداف اولیه و خانگی مناسب است. اگر به خلوص یا دقت بیشتری نیاز دارید، روشهای آزمایشگاهی دقیقتری مانند رسوبدهی با آمونیوم سولفات یا استخراج با بافرهای اختصاصی توصیه میشود.
سلام استاد گرامی، روزتون بخیر، عضر میخام. من میخام یه پروتئین خالص را با استفاده از استون استخراج کنم، با این وسایل شدنی هست👈دانه گیاه+استون+مخلوط کن+36 ساعت استراحت مخلوط بعد صاف کردن آن با صافی، بعد خشک کردن آن در دمای اتاق، ایا اشتباهی در کار هست؟؟ ممنون میشم راهنمایی کنید
روش پیشنهادی شما برای استخراج پروتئین با استون بهینه نیست. بهتر است ابتدا پروتئینها با بافر استخراج شوند و سپس با استون رسوب داده شوند. همچنین، دمای پایین و زمان کوتاهتر برای حفظ کیفیت پروتئین بسیار مهم است. اگر تجهیزات آزمایشگاهی ندارید، استفاده از یخچال و ابزارهای ساده نیز میتواند کافی باشد.